Eisen
- Seiten, die Timeline verwenden
- Feuergefährlicher Stoff
- Gruppe-8-Element
- Übergangsmetall
- Schwermetall
- Periode-4-Element
- Chemisches Element
- Eisen
- Koenzym/Kofaktor
- Mineral
- Kubisches Kristallsystem
- Elemente (Mineralklasse)
- Magnetwerkstoff
- Wikipedia:Artikel-Feedback/Zusätzliche Artikel
| Eigenschaften | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemein | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name, Symbol, Ordnungszahl | Eisen, Fe, 26 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie | Übergangsmetalle | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppe, Periode, Block | 8, 4, d | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aussehen | metallisch glänzend mit einem gräulichen Farbton | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS-Nummer | 7439-89-6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massenanteil an der Erdhülle | 4,7 %[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomar [2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atommasse | 55,845 u | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomradius (berechnet) | 140 (156) pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalenter Radius | low-spin: 123 pm, high-spin: 152 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronenkonfiguration | [Ar] 3d6 4s2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Austrittsarbeit | 4,5 eV[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. Ionisierungsenergie | 762,5 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. Ionisierungsenergie | 1561,9 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. Ionisierungsenergie | 2957 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physikalisch [2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aggregatzustand | fest | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Modifikationen | vier[4] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dichte | 7,874 g/cm3 = 7874 kg/m3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohshärte | 4,0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetismus | ferromagnetisch | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzpunkt | 1811 K (1538 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Siedepunkt | 3273 K[5] (3000 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molares Volumen | 7,09 · 10−6 m3/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Verdampfungswärme | 354 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzwärme | 13,8 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schallgeschwindigkeit | 4910 m/s bei 293,15 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Spezifische Wärmekapazität | 449[1] J/(kg · K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektrische Leitfähigkeit | 1 · 107 A/(V · m) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Wärmeleitfähigkeit | 80 W/(m · K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemisch [2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidationszustände | 2, 3, 4, 5, 6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxide (Basizität) | FeO, Fe2O3, Fe3O4 (amphoter) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Normalpotential | −0,44 V (Fe2+ + 2 e− → Fe) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativität | 1,83 (Pauling-Skala) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotope | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Weitere Isotope siehe Liste der Isotope | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NMR-Eigenschaften | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Eisen (mhd. isen; vergleichbar mit kelt. isara ‚kräftig‘, got. eisarn und aiz, lateinisch aes ‚Erz‘)[A 1] ist ein chemisches Element mit dem Elementsymbol Fe (lateinisch ferrum, ‚Eisen‘) und der Ordnungszahl 26. Es zählt zu den Übergangsmetallen, im Periodensystem steht es in der 8. Nebengruppe (Eisen-Platin-Gruppe), nach der neuen Zählung in der Gruppe 8 oder Eisengruppe.
Im Kontext der industriellen Fertigung versteht man unter Eisen den Werkstoff Gusseisen, wohingegen der Werkstoff Stahl gewöhnlich nicht als Eisen, sondern als Eisenmetall bezeichnet wird.
Geschichte
Belege für die Nutzung von Eisen in den verschiedenen Kulturen durch archäologische Funde sind gegenüber den Funden von Bronze relativ selten. Einerseits wurde Eisen in den ältesten Perioden der Geschichte nur in geringem Umfang genutzt, andererseits neigt Eisen an feuchter Luft, im Wasser und in der nassen Erde zur Korrosion, wodurch viele Gegenstände nicht erhalten blieben. Nur besondere Umstände oder große Ausmaße des Gegenstandes verhinderten den Verlust solcher Stücke.
Früheste Nutzung von Meteoriteneisen
Bevor die Menschen in den verschiedenen Kulturkreisen lernten, Eisen aus Erz zu gewinnen, nutzten sie das bereits vor der eigentlichen „Eisenzeit“ bekannte und an seinem spezifischen Nickelgehalt von etwa 5 bis 18 % erkennbare Meteoreisen oder auch Meteoriteneisen. Aufgrund seiner Seltenheit war dieses „Himmelseisen“ (altägyptisch: bj-n-pt = „Eisen des Himmels“[9]) entsprechend wertvoll und wurde vorwiegend zu Kultgegenständen und Schmuck verarbeitet. So fand man im Alten Ägypten in zwei Gräbern aus vordynastischer Zeit Schmuckperlen aus Meteoreisen mit einem Nickelgehalt von ca. 7,5 %.[10] Die ältesten, bekannten Funde aus Meteoreisen stammen allerdings aus Mesopotamien, das von den dort lebenden Sumerern als „urudu-an-bar“ (= Kupfer des Himmels) bezeichnet wurde. Unter anderem wurde in der Stadt Ur ein Dolch mit einer Klinge aus Meteoreisen (10,8 % Ni) und goldbelegtem Griff entdeckt, dessen Herstellung auf eine Zeit um 3100 v. Chr. datiert ist.[11]
Eisenerzeugung aus Erz
Zu den Anfängen der Eisenverhüttung siehe
Mittelmeerraum und Kleinasien
Die Nutzung von nickelfreiem, also terrestrischem Eisen muss in Mesopotamien ebenfalls schon früh bekannt gewesen sein, belegt durch einen nickelfreien Eisendolch mit Bronzegriff aus der Zeit zwischen 3000 und 2700 v. Chr., der in den Ruinen von Ešnunna bei Tell Asmar im heutigen Irak gefunden wurde.[11] Aus den Aufzeichnungen der Hethiter im Archiv von Boğazkale (ehemals Boğazköy) in Zentralanatolien geht hervor, dass Eisen bereits zur Zeit von König Anitta (ca. 1800 v. Chr.) bekannt war und die Verhüttung von Eisen mindestens seit ca. 1300 v. Chr.[12]
Den alten Ägyptern war die Nutzung von nickelfreiem terrestrischem Eisen bereits um 2600 v. Chr. bekannt, belegt durch den Fund eines Eisenmessers in den Fugen der Cheopspyramide[10]. Ein weiterer bekannter Fund ist eine Dolchklinge als Grabbeigabe Tutanchamuns von ca. 1350 v. Chr., wobei bis heute unklar ist, ob diese aus terrestrischem Eisen oder Meteoreisen besteht und ob diese überhaupt in Ägypten gefertigt wurde.[13][14] Ein weiterer Eisenfund in einem Grab bei Abydos aus der 6. Dynastie (2347–2216 v. Chr.) ließ sich zwar als nickelfrei und damit terrestrischen Ursprungs bestimmen, sein früherer Verwendungszweck konnte jedoch nicht ermittelt werden, da das Stück völlig verrostet war.[10]
Weiterhin gehörten auch die Chalyber zu den Völkern des Mittelmeerraums und Kleinasiens, die bereits gute Kenntnisse über die Nutzung des Eisens als Hüttenwerkstoff gewonnen hatten. Ihr Name lebte in dem griechischen Wort für Stahl (chalybs) weiter, im Gegensatz zum gewöhnlichen Eisen (sideros).[15] Früheste Spuren von Eisenverhüttung auf griechischem Gebiet fanden sich in Form von Eisenschlacke aus der Zeit um 2000 v. Chr. in Agia Triada auf Kreta.[16]
Im Alten Ägypten und in Gerar (Palästina) war die Eisenverhüttung etwa ab 1000 v. Chr. bekannt (für Gerar belegt durch Eisenschmelzöfen und örtlich hergestellte Ackerbaugeräte[15]) und in China mindestens seit der Han-Dynastie (206 v. Chr. bis 222 n. Chr.)[17].
Zwischen 1600 und 1200 v. Chr. wurde Eisen verstärkt genutzt. Die Hethiter kannten wohl eine Methode zur wirtschaftlichen Herstellung von Eisen, es löste Bronze allerdings noch nicht ab. In dieser Zeit blieb die Eisenproduktion weitgehend ein Monopol des Hethitischen Reiches und war ein Faktor für dessen Aufstieg. Ab 1200 v. Chr. fand mit dem Untergang des Hethitischen Reiches und der Verbreitung des entsprechenden Wissens im Nahen Osten der Übergang von der Bronzezeit zur Eisenzeit statt. Die Überlegenheit eiserner Rüstungen und Waffen gegenüber bronzener Ausrüstung wird hierfür als der wesentliche Grund angesehen. Es gibt allerdings Vermutungen, dass nicht nur die Materialüberlegenheit des Eisens, sondern auch ein Mangel an Zinn, das zur Bronzeherstellung benötigt wird, dem Übergang Vorschub leistete.
Europa
Zu den ältesten europäischen Stücken gehören die eisernen Zelte und Speere, die Graf Gozzadini 1853 in etruskischen Gräbern bei Bologna entdeckt hat. Sie stammen aus dem 9. bis 10. Jahrhundert vor Christus.
Einer der ältesten bekannten Eisenfunde in Deutschland ist ein eiserner Niet als Verbindung zwischen bronzener Lanzenspitze und hölzernem Schaft, der in Helle (Ostprignitz) gefunden wurde und etwa aus der Zeit um 800 v. Chr. stammt[15]. Im deutschsprachigen Raum markiert allerdings die erst 300 Jahre später beginnende La-Tène-Zeit eine erste Hochkultur mit zahlreichen Eisenverhüttungsplätzen und Eisenfunden.
Neben seiner herausragenden Bedeutung als Werkstoff wurde Eisen in der Alchemie verwendet, wo es mit dem Zeichen für Mars/Männlichkeit ♂ assoziiert wurde. Bis ins 18. Jahrhundert waren Rennöfen bzw. Rennwerke mit angeschlossenen Schmieden in Europa weit verbreitet. Flüssiges Roheisen entstand mit diesem Verfahren allerdings nicht, da ein Rennofen nur Temperaturen zwischen 1000 und 1200 °C erreichen konnte, der Schmelzpunkt von reinem Eisen jedoch bei 1538 °C liegt (Schmelzpunkt von reinem Zementit, Fe3C: 1250 °C). Die Entwicklung von Gusseisen fand erst im 13. Jahrhundert in Schweden (Lapphyttan und Vinarhyttan) statt. Mit der gegossenen Kanonenkugel verbreitete sich die Gusseisenverarbeitung schnell wie die Feldzüge über ganz Europa.
Als die schwindenden Wälder den wachsenden Holzkohlebedarf zur Eisengewinnung in Großbritannien nicht mehr decken konnten, wurde Kohle (genauer das Kohleprodukt Koks) von Abraham Darby als Alternative entwickelt. Diese Umstellung, zusammen mit der Erfindung der Dampfmaschine, gilt als Beginn der industriellen Revolution. Die Hüttenwerke produzierten zunächst hauptsächlich Gusseisen, mit der Einführung des Puddelverfahrens auch Schmiedeeisen.
Eisennutzung und Funde außerhalb Europas und Kleinasiens
Auch in China wurden die ersten Erfahrungen mit Eisen an Meteoriteneisen gewonnen. Erste archäologische Spuren von Schmiedeeisen finden sich im Nordwesten, nahe Xinjiang, aus dem 8. vorchristlichen Jahrhundert. Man vermutet, dass diese Produkte, die mit den Methoden des Nahen Ostens erstellt wurden, durch Handel nach China gelangt sind. 550 v. Chr. wurde der Hochofen entwickelt: Damit war das Herstellen von Gusseisen möglich.
In den Gräbern von Turan, einer Region, die sich über den Osten Irans, den Süden Afghanistans und den Südwesten Pakistans zog, fanden sich eiserne Gegenstände und größere Eisenlager in den Ruinen von Khorsabad. Entdeckt wurden Ringe und Kettenteile zusammen mit etwa 160.000 kg Eisenbarren. Layard stieß bei seinen Ausgrabungen in Nimrud auf eiserne Waffen, wie Helme, Speere und Dolche. Berühmt ist die Eiserne Säule in Delhi, ein sieben Meter hoher schmiedeeiserner Pfeiler aus dem 4./5. Jahrhundert.
In Australien und den umliegenden, besiedelten Inseln Polynesiens war dagegen die Nutzung von Eisen bis zur Entdeckung durch europäische Forscher unbekannt. Auch in der ansonsten hochstehenden Kultur der Inkas und Azteken Mittel- und Südamerikas verarbeitete man zwar Gold, Silber, Kupfer und Bronze von guter Qualität und großer Kunstfertigkeit, Eisen jedoch nur in geringer Menge und nur Meteoreisen.[18]
Vorkommen
Eisen steht in der Reihe der relativen Elementhäufigkeit bezogen auf Silicium im Universum mit 8,3 · 105 Atomen je 1 · 106 Siliciumatomen an 9. Stelle. Die Fusion von Elementen in Sternen endet beim Eisen, da bei der Fusion höherer Elemente keine Energie mehr frei wird, sondern aufgewendet werden muss (siehe Nukleosynthese). Schwerere Elemente entstehen endotherm bei Supernovaexplosionen, die auch für das Verstreuen der im Stern entstandenen Materie verantwortlich sind.
Eisen steht in der Reihe der Elementhäufigkeit nach dem Massenanteil an 2. Stelle in der gesamten Erde (28,8 %), an 4. Stelle in der Erdhülle (4,70 %) und an 4. Stelle in der kontinentalen Erdkruste (5,63 %); im Meerwasser ist es nur zu 0,002 mg/L enthalten. Eisen ist zusammen mit Nickel wahrscheinlich der Hauptbestandteil des Erdkerns. Vermutlich angetrieben von thermischen Kräften erzeugen Konvektionsströmungen von flüssigem Eisen im äußeren Kern das Erdmagnetfeld.
Eisen in Erzen
Die ersten Vorkommen, die abgebaut wurden, waren Raseneisenstein und offenliegende Erze. Heute wird vor allem 40-prozentiges Magneteisenerz abgebaut. Das wichtigste Mineral zur Eisengewinnung ist Hämatit, welches größtenteils aus Fe2O3 besteht. Die größten Eisenerzvorkommen finden sich in den sogenannten Banded Iron Formations (BIF, gebändertes Eisenerz oder Bändererz), die auch als Takonit oder Itabirit bezeichnet werden und Eisen hauptsächlich in den Mineralen Hämatit und Magnetit enthalten.
Eisen als Mineral
Selten kommt Eisen in der Natur auch gediegen vor, meist in Form kleiner Bläschen oder Verdickungen im umgebenden Gestein, aber auch als massige Mineral-Aggregate mit bis zu 25 t Gewicht[19], und ist deshalb als Mineral anerkannt. Die International Mineralogical Association (IMA) führt es gemäß der Systematik der Minerale nach Strunz (9. Auflage) unter der System-Nr. „1.AE.05“ (Elemente - Metalle und intermetallische Verbindungen - Eisen-Chrom-Familie)[20] (8. Auflage: I/A.07-10). Die im englischsprachigen Raum ebenfalls geläufige Systematik der Minerale nach Dana führt das Element-Mineral unter der System-Nr. „1.1.11.0“.
Weltweit konnte gediegen Eisen bisher (Stand: 2010) an 120 Fundorten nachgewiesen werden, wobei die überwiegende Mehrheit allerdings aus meteoritischen Eisenfunden der Varietät Kamacit besteht.[21]
Eisen kristallisiert im kubischen Kristallsystem, hat je nach Bildungsbedingungen und Reinheitsgrad eine Mohs-Härte zwischen 4 und 5[22] und eine stahlgraue bis schwarze Farbe. Auch die Strichfarbe ist grau.
Wegen der Reaktion mit Wasser und Sauerstoff (Rosten) ist gediegenes Eisen nicht stabil. Es tritt daher in Legierung mit Nickel entweder als Kamacit (4 bis 7,5 % Ni) oder Taenit (20 bis 50 % Ni) nur in Eisenmeteoriten auf sowie in Basalten, in denen es manchmal zu einer Reduktion von eisenhaltigen Mineralen kommt. Eisen mit geringeren Nickelanteilen gelten als Varietät desselben und sind unter der Bezeichnung Josephinit bekannt[23], allerdings ist diese Bezeichnung auch ein Synonym des Minerals Awaruit (Ni3Fe)[24].
Eisenerze findet man dagegen vergleichsweise häufig, wichtige Beispiele sind die Minerale Magnetit (Magneteisenstein, Fe3O4), Hämatit (Roteisenstein, Fe2O3), Pyrrhotin (Magnetkies, FeS) und Pyrit (Eisenkies, FeS2), Siderit (Eisenspat, FeCO3) und das als Gestein geltende Limonit (Brauneisenstein, Fe2O3·n H2O). Das Sedimentgestein Eisen-Oolith, manchmal als Eisenstein bezeichnet, besteht aus Eisenhydroxidmineralien, verkittet mit tonigen oder kalkigen Bindemitteln. Insgesamt sind derzeit (Stand: 2010) 1424 Eisenminerale bekannt.[25]
Förderung
Die Volksrepublik China ist mit 629,7 Millionen Tonnen (58,2 Prozent) das im Jahr 2011 bei weitem bedeutendste Herstellerland für Roheisen, gefolgt von Japan 81,0 Millionen Tonnen (7,5 Prozent) und Russland 48,1 Millionen Tonnen (4,4 Prozent). Die drei Staaten hatten zusammen einen Anteil von 70,1 Prozent an der Weltproduktion von 1082,7 Millionen Tonnen. In Europa waren weitere wichtige Produzenten die Ukraine, Deutschland, Frankreich, Italien und Großbritannien.
Weltweit wurden 2011 etwa 2,8 Milliarden Tonnen Eisenerz abgebaut. Die bedeutendsten Eisenerzlieferanten waren die Volksrepublik China, Australien, Brasilien, Indien und Russland. Zusammen hatten sie einen Anteil von 82,5 Prozent an der Weltförderung. Aus dem Eisenerz wurden neben dem Roheisen auch 63,5 Millionen Tonnen Eisenschwamm gewonnen. Zusätzlich wird aus Schrott noch neues Eisen hergestellt.
| Rang | Land | Produktion (in Mio. t) |
Rang | Land | Produktion (in Mio. t) | |
|---|---|---|---|---|---|---|
| 1 | VR China | 202,3 | 10 | Frankreich | 13 | |
| 2 | Japan | 82,1 | 11 | Taiwan | 10,3 | |
| 3 | Russische Föd. | 48,3 | 12 | Italien | 10,1 | |
| 4 | Vereinigte Staaten | 39,1 | 13 | Vereinigtes Königreich | 10,1 | |
| 5 | Brasilien | 32 | 14 | Kanada | 8,5 | |
| 6 | Ukraine | 29,6 | 15 | Belgien | 7,8 | |
| 7 | Deutschland | 29,5 | 16 | Südafrika | 6,2 | |
| 8 | Südkorea | 27,3 | 17 | Australien | 6,1 | |
| 9 | Indien | 26,1 | 18 | Niederlande | 5,8 |
|
Entwicklung der weltweiten Eisenerzförderung (in Millionen Tonnen)[26]  |
Entwicklung der weltweiten Roheisenerzeugung (in Millionen Tonnen)[27]  |
Gewinnung und Darstellung
Erzgewinnung und -verarbeitung
Eisenerz wird im Tagebau und im Tiefbau (Untertagebau) gewonnen. Dort, wo die als abbauwürdig erkannten Eisenerzlagerstätten offen zutage treten, kann das Erz im weniger aufwändigen Tagebau gewonnen werden. Heute wird Eisenerz hauptsächlich in Südamerika, besonders Brasilien, im Westen Australiens, in der Volksrepublik China, in Ost-Europa (beispielsweise Ukraine) und Kanada auf diese Weise abgebaut.
Diese Länder verdrängten in den letzten Jahren die ursprünglich bedeutendsten Eisenerz-Förderländer wie Frankreich, Schweden und Deutschland, dessen letzte Eisenerzgrube in der Oberpfalz 1987 geschlossen wurde.
Nur ein kleiner Teil der Erze kann als Stückerz direkt im Hochofen eingesetzt werden. Der Hauptanteil der Eisenerze wird als Feinerz in einer Sinteranlage zu Sinter verarbeitet, denn nur in dieser Form als gesinterte grobe Brocken ist der Einsatz im Hochofen möglich, da das feine Erz die Luftzufuhr (Wind) sehr beeinträchtigen oder sogar verhindern würde. Gröbere Erzkörner werden nach ihrer Größe sortiert und gesintert. Kleine Erzkörner müssen dazu gemeinsam mit Kalkzuschlagsstoffen auf mit Gas unterfeuerte, motorisch angetriebene Wanderroste (Rost-Förderbänder) aufgebracht und durch starke Erhitzung angeschmolzen und dadurch „zusammengebacken“ (gesintert) werden. Sehr feines Erz wird pulverfein aufgemahlen, was oft bereits zur Abtrennung von Gangart nötig ist. Dann wird es mit Kalkstein, feinkörnigem Koks (Koksgrus) und Wasser intensiv vermischt und auf einen motorisch angetriebenen Wanderrost aufgegeben. Durch den Wanderrost werden von unten Gase abgesaugt. Von oben wird angezündet und eine Brennfront wandert von oben nach unten durch die Mischung, die dabei kurz angeschmolzen (gesintert) wird. Ein wesentlicher Anteil der Erze wird jedoch zu Pellets verarbeitet. Hierzu wird mit Bindemitteln, Zuschlägen und Wasser eine Mischung erzeugt, die dann auf Pelletiertellern zu Kügelchen von 10 bis 16 mm Durchmesser gerollt wird. Diese werden auf einem Wanderrost mit Gasbefeuerung zu Pellets gebrannt. Sinter ist nicht gut transportierbar und wird deshalb im Hüttenwerk erzeugt, Pelletanlagen werden meist in der Nähe der Erzgruben betrieben.
Eisenerzeugung im Hochofen
Das Eisen wird überwiegend im Hochofen durch chemische Reduktion des Eisenoxids der Eisenerze mit Kohlenstoff gewonnen. Der Hochofen ist ein Schachtofen. Koks und Erz werden abwechselnd in Lagen oben in den Ofen hineingeschüttet. Dazu sind oberhalb des Ofengefäßes i. d. R. zwei Bunker angeordnet, die als Gasschleusen zwischen dem Ofengefäß und der Umgebung dienen. Ganz oben befindet sich innerhalb des Ofengefäßes eine Drehschurre, mit der das Material spiralförmig flächig auf der Beschickungsoberfläche verteilt wird. Die Kokslagen halten im unteren Bereich des Ofens, wenn das Erz plastisch wird, die Durchströmbarkeit der Schüttung mit Prozessgas aufrecht (Koksfenster).
Der Einsatz sinkt im Ofenschacht ab und wird dabei durch das etwa 2000 °C heiße, aus Kohlenstoffmonoxid und Stickstoff bestehende aufsteigende Prozessgas getrocknet, aufgeheizt, die Eisenoxide reduziert und schließlich geschmolzen (Redoxreaktion). Das Prozessgas wird erzeugt, indem unten in den Ofen durch wassergekühlte Kupferdüsen (Blasformen) auf etwa 1200 °C vorgeheizte Luft eingeblasen wird. Der Sauerstoff der Luft verbrennt mit Koks zu Kohlenstoffmonoxid. Der gesamte Vorgang dauert etwa acht Stunden.
Das übrig bleibende Abgas, das am oberen Ende des Ofenschachtes gewonnen wird, ist brennbar und wird zum Vorheizen der Luft verwendet. Mit Überschussgas wird in einem Kraftwerk Strom erzeugt.
Der Ofen erzeugt neben dem flüssigen Eisen auch flüssige Schlacke. Beides ist miteinander vermischt, hat eine Temperatur von etwa 1450 °C und wird durch ein Stichloch abgezogen, das etwa alle zwei Stunden durch Anbohren geöffnet und jeweils nach etwa einer Stunde durch Verstopfen mit einer keramischen Masse verschlossen wird. Eisen und Schlacke werden außerhalb des Ofens getrennt. Das Eisen wird in Transportpfannen gefüllt und ins Stahlwerk gebracht.
Das Eisen ist bei 1450 °C flüssig, da durch den im Eisen gelösten Kohlenstoff eine Schmelzpunktserniedrigung erfolgt. Die Schlacke wird mit Wasser verdüst. Dabei erstarrt sie durch das Abschrecken als feinkörniges Glas (Schlackensand). Dieser Schlackensand wird fein gemahlen und als Betonzusatzstoff (Füller) verwendet. Ein Hochofen erzeugt pro Tonne Eisen etwa 200 bis 300 kg Schlacke.
Erz und Koks enthalten als Hauptverunreinigung Siliciumdioxid (Quarzsand, Silikate) SiO2 und Aluminiumoxid Al2O3. Ein kleiner Teil des Siliciumdioxids wird zu Silicium reduziert, das im Eisen gelöst wird. Der Rest bildet zusammen mit dem Aluminiumoxid die Schlacke (Aluminiumsilikate).
Da der Schmelzpunkt eines Gemisches von SiO2 und Al2O3 zu hoch ist, um eine bei 1450 °C flüssige Schlacke zu bilden, wird Calciumoxid (Gebrannter Kalk, CaO) zur Schmelzpunktserniedrigung verwendet. Dies wird meist bereits bei der Herstellung des Eisenerzsinters als Kalkstein zugegeben.
Das Eisen des Hochofens (Roheisen) hat nur einen Eisengehalt von etwa 95 %. Es enthält für die meisten Anwendungen zu viel Kohlenstoff, Schwefel, Silicium und Phosphor. Üblicherweise wird daher im Stahlwerk zunächst durch Einblasen von Calciumcarbid, Magnesium oder Branntkalk reduzierend entschwefelt. Die Entschwefelungsschlacke wird abgezogen und das Roheisen dann in einem Konverter (Sauerstoffblasverfahren) unter Zusatz von Branntkalk oxidierend verblasen. Dabei wird Silicium zu Siliciumdioxid und Kohlenstoff zu Kohlenstoffdioxid verbrannt. Der Phosphor wird als Calciumphosphat gebunden. Das flüssige Eisen hat danach eine Temperatur von etwa 1600 °C. Es enthält soviel Sauerstoff, dass beim Erstarren aus verbliebenem Kohlenstoff Kohlenmonoxidblasen entstehen. Beim heute meist verwendeten Strangguss ist dies unerwünscht. Beim Abstechen des Stahls aus dem Konverter in die Gießpfanne wird daher Aluminium zugegeben, um den Sauerstoff als Aluminiumoxid zu binden. Bei hohen Anforderungen an die Qualität des Stahls folgen auf den Konverterprozess noch weitere Verfahrensschritte, wie z. B. eine Vakuumbehandlung (Sekundärmetallurgie).
Eisenerzeugung ohne Hochofen
Hochöfen haben einen großen Material- und Energiebedarf, der bei ungünstigen Rohstoff- und Energiebedingungen nicht immer bereitgestellt werden kann. Daher wurden verschiedene Verfahren entwickelt, um die vorhandenen Eisenerze ohne oder nur mit geringem Einsatz von Koks bzw. alternativ mit Steinkohle, Braunkohle, Erdöl oder Erdgas zu reduzieren. Bei der überwiegenden Anzahl der Verfahren fällt das erzeugte Roheisen in fester, poriger Form an, das als Eisenschwamm bezeichnet wird.
Bekannte Verfahren sind, sortiert nach dem jeweiligen Reduktionsgefäß, unter anderem:[28]
- Eisenerzeugung im Schachtofen:
- Wiberg-Verfahren, entwickelt ca. 1918 in Schweden
- Purofer-Verfahren, entwickelt in Oberhausen
- Midland-Ross-Verfahren, entwickelt von der Midland-Ross-Corporation in Cleveland, Ohio
- Alle drei Verfahren nutzen einen mehr oder weniger kurzen Schachtofen und als Einsatzstoffe eisenreiche Stückerze, Sinter oder Pellets, die vorgewärmt und am Ofenkopf eingebracht werden. Am Ofengrund wird ein 1000°C heißes Reduktionsgasgemisch aus Kohlenmonoxid (CO), Wasserstoff (H2), Kohlendioxid (CO2), Wasser (H2O) und ggf. Methan (CH4) eingeblasen. Der erzeugte Eisenschwamm hat eine Reinheit von 85 bis 95 %.
- Eisenerzeugung in der Retorte:
- Höganäs-Verfahren, entwickelt 1908 von E. Sieurin in Höganäs, Schweden
- HyL-Verfahren, entwickelt 1957 bei der Gesellschaft Hojalata-y-Lamina S.A. in Monterry, Mexiko
- Sehr reiche Eisenerzkonzentrate werden hier in keramische Retorten oder Muffeln eingebracht und entweder mit feinkörniger Kohle, Koksgrus und Kalkstein oder mit Erdgas reduziert. Der erzeugte Eisenschwamm hat eine Reinheit von 80 bis 95 % und wird entweder zur Herstellung von Sonderstählen oder als Eisenpulver für die Pulvermetallurgie genutzt.
- Eisenerzeugung im Drehgefäß:
- Krupp-Eisenschwammverfahren
- RN-Verfahren, entwickelt von der Republic Steel Corporation und der National Lead Corporation
- SL-Verfahren, entwickelt von der Steel Company of Canada und der Lurgi Gesellschaft für Chemie und Hüttenwesen
- Eingebracht werden hier Stückerz oder Pellets zusammen mit Kalkstein oder Dolomit in bis zu 110 m lange Drehrohröfen, die mit Braunkohle, Koksofengas oder Heizöl auf bis zu 1050 °C aufgeheizt werden. Erzeugt wird Eisenschwamm mit einer Reinheit von 85 bis über 90 %.
- Dored-Verfahren (Domnarf-Reduktions-Verfahren), entwickelt bei der Stora Kopparbergs Bergslag in Schweden
- Vorgewärmtes Eisenerz wird mit Kohle oder Koks auf einem Roheisensumpf in einen Drehrohrofen eingebracht. Durch Einblasen von reinem Sauerstoff wird das im Reduktionsgas enthaltene Kohlenmonoxid zu Kohlendioxid verbrannt und der Drehrohrofen auf ca. 1300 bis 1350 °C aufgeheizt. Erzeugt wird flüssiges Roheisen.
- Eisenerzeugung im Wirbelschichtreaktor
- H-Iron-Verfahren, entwickelt von der Hydrocarbon Research Inc. (USA)
- FIOR-Verfahren (Fluid Iron Ore Reduction), entwickelt von der Standard Oil Company, New York
- Erzeugt wird Eisenschwamm aus feinkörnigen Eisenerzen, das entweder mit eingeblasenem Wasserstoff, Erdgas oder Raffinerierestgas aufgewirbelt und reduziert wird.
- Eisenerzeugung im Elektroofen
- Ohne Vorwärmung und Vorreduktion der Einsatzstoffe kommen das Tysland-Hole-Verfahren und das Demag-Verfahren aus.
- Elektrokemisk-Verfahren und Strategic-Udy-Verfahren benötigen dagegen die Vorwärmung und Vorreduktion des Erzes durch Drehrohröfen.
- Die Eisenerzeugung in Elektroöfen lohnt allerdings nur, wenn Strom in ausreichender Menge und kostengünstig bereitgestellt werden kann. Je nach Güte von Eisenerz und Kohlenstoffträger liegt der Energieverbrauch zwischen 2000 und 2500 kWh pro Tonne Roheisen.
Eigenschaften
Physikalische Eigenschaften

Das durchschnittliche Eisenatom hat etwa die 56-fache Masse eines Wasserstoffatoms. Der Atomkern des Eisenisotops 56Fe weist einen der größten Massendefekte und damit eine der höchsten Bindungsenergien pro Nukleon aller Atomkerne auf. Deshalb wird es als Endstufe bei der Energieerzeugung durch Kernfusion in den Sternen betrachtet. Den absolut höchsten Massendefekt hat jedoch 62Ni gefolgt von 58Fe und erst auf dem dritten Platz folgt 56Fe[29].
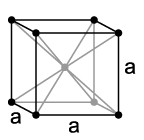
Bei Raumtemperatur ist die allotrope Modifikation des reinen Eisens das Ferrit oder α-Eisen. Diese Modifikation kristallisiert in einer kubisch-raumzentrierten Kristallstruktur (Wolfram-Typ) in der Raumgruppe Im3m mit dem Gitterparameter a = 286,6 pm sowie zwei Formeleinheiten pro Elementarzelle. Diese Modifikation ist unterhalb von 910 °C stabil. Oberhalb dieser Temperatur wandelt es sich in die γ-Modifikation oder Austenit um. Diese besitzt eine kubisch-flächenzentrierte Struktur (Kupfer-Typ) mit der Raumgruppe Fm3m und dem Gitterparameter a = 364,7 pm. Eine dritte Strukturänderung erfolgt bei 1390 °C, oberhalb dieser Temperatur bis zum Schmelzpunkt bei 1535 °C ist wieder das kubisch-raumzentrierte δ-Ferrit stabil. Bei hohem Druck finden ebenfalls Phasenübergänge statt: bei Drücken von mehr als etwa 10 GPa und Temperaturen von höchstens einigen hundert Grad Celsius wandelt sich α-Eisen in ε-Eisen, dessen Kristallgitter eine hexagonal dichteste Kugelpackung (hcp) ist, um; bei höheren Temperaturen bis hin zum Schmelzpunkt findet eine entsprechende Umwandlung von γ-Eisen zu ε-Eisen statt, wobei der Druck des Phasenübergangs mit der Temperatur steigt. Darüber hinaus gibt es möglicherweise einen weiteren Phasenübergang von ε-Eisen nach β-Eisen, der bei etwa 50 GPa und mehr als 1500 K liegt; allerdings ist die Existenz dieser β-Phase umstritten, und auch zu ihrer Kristallstruktur gibt es verschiedene Befunde, u.a. eine orthorhombische oder eine doppelte hcp-Struktur.[30] Diese Umwandlungen nennt man auch die „Polymorphie des Eisens“.[4]
Das Fehlen einer β-Phase in der Standard-Nomenklatur der Eisenallotrope rührt daher, dass früher angenommen wurde, dass die Änderung des Magnetismus am Curiepunkt bei 766 °C von Ferro- auf Paramagnetismus mit einer Strukturänderung einhergeht und somit eine weitere Modifikation zwischen 766 und 910 °C existiert, die als β-Modifikation oder β-Eisen bezeichnet wurde. Dies stellte sich jedoch nach genaueren Messungen als falsch heraus.
Der Schmelzpunkt des Eisens ist experimentell nur für Drücke von bis zu etwa 50 GPa gut bestimmt. Bei höheren Drücken liefern verschiedene experimentelle Techniken stark unterschiedliche Ergebnisse. So lokalisieren verschiedene Studien den γ-ε-Tripelpunkt bei Drücken, die sich um mehrere Dutzend Gigapascal unterscheiden, und liegen bei den Schmelztemperaturen unter hohem Druck um 1000 K und mehr auseinander. Im Allgemeinen ergeben molekulardynamische Modellrechnungen und Schockexperimente höhere Temperaturen und steilere Schmelzkurven als statische Experimente in Diamantstempelzellen.[31]
Chemische Eigenschaften
Eisen ist beständig an trockener Luft, in trockenem Chlor sowie in konzentrierter Schwefelsäure, konzentrierter Salpetersäure und basischen Agenzien (außer heißer Natronlauge) mit einem pH-Wert größer als 9. In Salzsäure sowie verdünnter Schwefel- oder Salpetersäure löst sich Eisen rasch unter Entwicklung von Wasserstoff. An feuchter Luft und in Wasser, das Sauerstoff oder Kohlenstoffdioxid enthält, wird Eisen leicht unter Bildung von Eisenoxidhydrat (Rosten) oxidiert. Wird Eisen an trockener Luft erhitzt, so bildet sich eine dünne Schicht von Eisen(II,III)-oxid (Fe3O4, Eisenhammerschlag), die stark gefärbt ist (Anlassen). Sehr fein verteiltes, pyrophores Eisen reagiert schon bei Raumtemperatur mit Sauerstoff aus der Luft unter Feuererscheinung. Brennende Stahlwolle reagiert in feuchtem Chlor-Gas kräftig unter Bildung von braunen Eisen(III)-chlorid-Dämpfen. Wird ein Gemisch aus Eisen- und Schwefelpulver (im Gewichtsverhältnis 7:4) erhitzt, so entsteht vorwiegend Eisen(II)-sulfid.[32] Auch mit weiteren Nichtmetallen wie Phosphor, Silicium und Kohlenstoff bildet Eisen bei erhöhter Temperatur Phosphide, Silicide oder Carbide.[33]
Geruch des Eisens
Reines Eisen ist geruchlos. Der typische, als metallisch klassifizierte Geruch, wenn man Eisengegenstände berührt, entsteht durch eine chemische Reaktion von Stoffen des Schweißes und des Fetts der Haut mit den sich dabei bildenden zweiwertigen Eisenionen.[34]
Einer der wichtigsten Duftträger ist 1-Octen-3-on, das noch in großer Verdünnung pilzartig-metallisch riecht. Vorstufe der Geruchsstoffe sind Lipidperoxide. Diese entstehen, wenn Hautfett durch bestimmte Enzyme oder nichtenzymatische Prozesse (z. B. UV-Anteil des Lichts) oxidiert werden. Diese Lipidperoxide werden dann durch die zweiwertigen Eisenionen zersetzt, wobei die Duftstoffe gebildet werden. Die zweiwertigen Eisenionen entstehen durch Korrosion des Eisens bei Berührung mit dem Handschweiß, der korrosive organische Säuren und Chloride enthält.
Beim Verreiben von Blut auf der Haut entsteht ein ähnlicher Geruch. Blut enthält ebenfalls Eisenionen.
Isotope
Eisen hat 27 Isotope und zwei Kernisomere, von denen vier natürlich vorkommende, stabile Isotope sind. Sie haben die relativen Häufigkeiten: 54Fe (5,8 %), 56Fe (91,7 %), 57Fe (2,2 %) und 58Fe (0,3 %). Das Isotop 60Fe hat eine Halbwertszeit von 1,5 Millionen Jahren, 55Fe von 2,73 Jahren und das Isotop 59Fe eine von 44,503 Tagen. Die restlichen Isotope und die beiden Kernisomere haben Halbwertszeiten zwischen weniger als 150 ns und 8,275 Stunden. Die Existenz von 60Fe zu Beginn der Entstehung des Planetensystems konnte durch den Nachweis einer Korrelation zwischen den Häufigkeiten von 60Ni, dem Zerfallsprodukt von 60Fe, und den Häufigkeiten der stabilen Fe-Isotope in einigen Phasen mancher Meteorite (beispielsweise in den Meteoriten Semarkona und Chervony Kut) nachgewiesen werden. Möglicherweise spielte die freigesetzte Energie beim radioaktiven Zerfall von 60Fe, neben der atomaren Zerfallsenergie des ebenfalls vorhandenen radioaktiven 26Al, eine Rolle beim Aufschmelzen und der Differenzierung der Asteroiden direkt nach ihrer Bildung vor etwa 4,6 Milliarden Jahren. Heute ist das ursprünglich vorhanden gewesene 60Fe in 60Ni zerfallen. Die Verteilung von Nickel- und Eisenisotopen in Meteoriten erlaubt es, die Isotopen- und Elementehäufigkeit bei der Bildung des Sonnensystems zu messen und die vor und während der Bildung des Sonnensystems vorherrschenden Bedingungen zu erschließen.
Von den stabilen Eisenisotopen besitzt nur 57Fe einen von null verschiedenen Kernspin.
Verwendung
Eisen ist der Hauptbestandteil von Stahl. Stähle sind Legierungen des Eisens, die beim Vermischen (Legieren) mit anderen Metallen und auch Nichtmetallen (insbesondere Kohlenstoff) entstehen. Eisen ist mit 95 Prozent Gewichtsanteil an genutzten Metallen das weltweit meistverwendete. Der Grund dafür liegt in seiner weiten Verfügbarkeit, welche es recht preiswert macht, und darin, dass es hervorragende Festigkeit und Zähigkeit beim Eingehen von Legierungen mit anderen Metallen wie Chrom, Molybdän und Nickel, erreicht, die es für viele Bereiche in der Technik zu einem Grundwerkstoff machen. Es wird bei der Herstellung von Landfahrzeugen, Schiffen und im gesamten Baubereich (Stahlbeton) eingesetzt.
Eisen ist (neben Cobalt und Nickel) eines jener drei ferromagnetischen Metalle, die mit ihrer Eigenschaft den großtechnischen Einsatz des Elektromagnetismus u. a. in Generatoren, Transformatoren, Drosseln, Relais und Elektromotoren ermöglichen. Es wird rein oder u. a. mit Silicium, Aluminium, Kobalt oder Nickel (siehe Mu-Metall) legiert und dient als weichmagnetisches Kernmaterial zur Führung von Magnetfeldern, zur Abschirmung von Magnetfeldern oder zur Erhöhung der Induktivität. Es wird hierzu massiv und in Form von Blechen und Pulver (Pulverkerne) produziert.
Reines Eisenpulver wird auch in der Chemie verwendet.
Industriell sind verschiedene Stähle verbreitet; in Deutschland sind etwa 7.500 Sorten genormt. Eisen wird in den nachfolgend angeführten Formen genutzt:
- Roheisen enthält vier bis fünf Prozent Kohlenstoff sowie unterschiedliche Anteile an Schwefel, Phosphor und Silicium. Es ist ein Zwischenprodukt in der Herstellung von Gusseisen und Stahl.
- Gusseisen enthält 2,06 bis 6,67 % Kohlenstoff und weitere Legierungselemente, wie beispielsweise Silicium und Mangan. In Abhängigkeit von der Abkühlgeschwindigkeit liegt der Kohlenstoff im Gusseisen als Carbid oder elementar als Graphit vor. In Anlehnung an das Aussehen der Bruchflächen spricht man im ersten Fall von weißem und im zweiten Fall von grauem Gusseisen. Gusseisen ist sehr hart und spröde. Es lässt sich gewöhnlich nicht plastisch verformen (schmieden).
- Stahl enthält zwischen 0,06 % und 2,06 % Kohlenstoff. Im Gegensatz zu Gusseisen ist er plastisch umformbar. Durch Legieren, sowie durch eine geeignete Kombination von thermischer Behandlung und plastischer Formung (Kaltwalzen) können die mechanischen Eigenschaften des Stahls in weiten Grenzen variiert werden.
- Bei unlegierten Stählen mit einem Kohlenstoffgehalt bis 0,8 % spricht man von Baustahl, bei über 0,8 % von Werkzeugstahl.
In der Medizin werden eisenhaltige Präparate als Antianämika eingesetzt, kausal in der Behandlung von Eisenmangelanämien und additiv in der Behandlung von durch andere Ursachen hervorgerufenen Anämien.
Biologische Bedeutung
Bestandteil von Lebewesen
Eisen ist ein essentielles Spurenelement für fast alle Lebewesen, bei Tieren vor allem für die Blutbildung. In pflanzlichen Organismen beeinflusst es die Photosynthese sowie die Bildung von Chlorophyll und Kohlenhydraten.[35] Im Körper von Menschen und Tieren liegt es oxidiert als Eisen(II) und Eisen(III) vor. Als Zentralatom des Kofaktors Häm b in Hämoglobin und Myoglobin und in Cytochromen ist es bei vielen Tieren und beim Menschen für Sauerstofftransport und -speicherung sowie für die Elektronenübertragung verantwortlich. In diesen Proteinen ist es von einem planaren Porphyrinring umgeben.
Weiter ist Eisen Bestandteil von Eisen-Schwefel-Komplexen (so genannte Eisen-Schwefel-Cluster) in vielen Enzymen, beispielsweise Nitrogenasen, Hydrogenasen oder den Komplexen der Atmungskette. Als dritte wichtige Klasse der Eisenenzyme sind die so genannten Nicht-Häm-Eisenenzyme zu nennen, beispielsweise die Methan-Monooxygenase, Ribonukleotid-Reduktase und das Hämerythrin. Diese Proteine nehmen in verschiedenen Organismen Aufgaben wahr: Sauerstoffaktivierung, Sauerstofftransport, Redoxreaktionen und Hydrolysen. Ebenso wichtig ist dreiwertiges Eisen als Zentralion im Enzym Katalase, das in den Peroxisomen der Zellen das im Stoffwechsel entstehende Zellgift Wasserstoffperoxid abbaut.
Die Speicherung des Eisens erfolgt intrazellulär in dem Enzym Ferritin (20 % Eisenanteil) und dessen Abbauprodukt Hämosiderin (37 % Eisenanteil). Transportiert wird Eisen durch Transferrin.[36]
Externer Elektronendonor und -akzeptor
Einige Bakterien nutzen Fe(III) als Elektronenakzeptor für die Atmungskette. Sie reduzieren es damit zu Fe(II), was eine Mobilisierung von Eisen bedeutet, da die meisten Fe(III)-Verbindungen schwer wasserlöslich sind, die meisten Fe(II)-Verbindungen aber gut wasserlöslich. Einige phototrophe Bakterien nutzen Fe(II) als Elektronendonator für die Reduktion von CO2.[37]
Eisen zur Gen-Steuerung früher Lebensformen?
Eine Gruppe von Forschern um Loren Williams an der School of Chemistry and Biochemistry am Georgia Institute of Technology kommt zur Ansicht, dass die Ribonukleinsäure (RNA) und nicht wie heute die Desoxyribonukleinsäure (DNA) zu Beginn der Entwicklung des Lebens als Träger der Erbinformationen fungierte. Die DNA besteht - wie auch die RNA aus Nukleotiden, deren Verkettung die Information zum Bau von Proteinen verschlüsselt. Bei den heutigen Lebewesen sind positiv geladene Magnesium-Ionen eine wichtige Voraussetzung für die komplexen Vorgänge.
Den Forschern gelang der Nachweis, dass RNA-Moleküle unter der Wirkung von Eisenionen ebenfalls die für ihre Funktion wichtigen Strukturen und Bindungen bilden können, sogar mit mehr Reaktionsmöglichkeiten, die theoretisch mehr Funktionen in einem biologischen System ermöglichen.
Durch den hohen Sauerstoffgehalt der Luft ist heute kaum noch frei verfügbares Eisen vorhanden - so wie es vor drei Milliarden Jahren - vor dem steigenden Einsatz der Photosynthese und damit Sauerstoffproduktion nach Erkenntnissen der Forscher der Fall war. Das früher frei verfügbare Eisen verband sich mit Sauerstoff und wurde zu „rostigen“ Ablagerungen ohne Eignung für den Organismus, der nach Meinung der Wissenschaftler auf das weniger effiziente Magnesium ausweichen musste.[38]
Medizinische Bedeutung
Eisenbedarf und Eisenmangel
Vor allem Frauen vor den Wechseljahren leiden häufig an Eisenmangel, der Grund dafür ist die Menstruation. Sie sollten circa 15 Milligramm Eisen pro Tag zuführen, während der Tagesbedarf eines erwachsenen Mannes nur etwa 10 Milligramm beträgt. Außerdem verlieren Frauen zusätzlich bei der Geburt eines Kindes circa 1000 Milligramm Eisen. Durch die gleichzeitige Einnahme von Vitamin C wird die Resorptionsquote von Eisen deutlich erhöht. Besonders reichhaltig ist Eisen in Fleisch, Leber, Hülsenfrüchten und Vollkornbrot enthalten. Gleichzeitiger Verzehr von Milchprodukten, Kaffee oder schwarzem Tee hemmen jedoch die Eisenaufnahme.
Toxizität und Eisenüberladung
Obwohl Eisen ein wichtiges Spurenelement für den Menschen ist, kann zu viel Eisen für den Körper giftig wirken. Zu große Mengen an Fe2+-Ionen reagieren mit Peroxiden, wobei freie Radikale entstehen, die aber im Normalzustand durch körpereigene Prozesse entfernt werden.
Etwa 1 Gramm Eisen verursacht bei einem zweijährigen Kind ernste Vergiftungserscheinungen, 3 Gramm können bereits tödlich sein. Bei einem erwachsenen Mann treten ab etwa 2,5 Gramm nicht an Hämoglobin gebundenem Eisen im Blut ernstzunehmende Vergiftungserscheinungen auf. Eine Regulationsstörung der Eisenaufnahme im Darm kann zur Hämochromatose, einer Eisenspeicherkrankheit, führen. Das Eisen reichert sich in der Leber an und führt dort zu Siderose (Ablagerung von Eisensalzen) und Organschäden. Daher sind Eisenpräparate nur bei Eisenmangel zu empfehlen.[39]
Eisenüberschuss, sei es aufgrund der Ernährung oder aus genetischen oder therapeutischen Gründen, erhöht die Anfälligkeit für bestimmte Infektionskrankheiten, unter anderem für Yersiniose, Salmonellose, Tuberkulose und AIDS. Patienten mit Hämochromatose hatten überdurchschnittlich oft Salmonellose und Yersiniose. Klinische Studien, die die prophylaktische Einnahme von Eisenpräparaten untersuchten, zeigten eine direkte Korrelation zwischen der Einnahme und den genannten Infektionskrankheiten. Dass die Einnahme von Eisen das Risiko für Tuberkulose erhöht, ist seit dem 19. Jahrhundert bekannt, als Armand Trousseau ein anämisches Mädchen beschrieb, dessen latente Tuberkulose nach Einnahme von Eisen erneut ausbrach und den Tod verursachte. Kürzliche epidemiologische Studien in Afrika zeigen, dass ein Überschuss von Eisen in der Ernährung, beispielsweise durch Getreide, das auf vulkanischem Boden wuchs, oder Bier, das traditionell in Gefäßen aus Eisen gebraut wurde, ein Risiko für erhöhte Anfälligkeit für und Sterblichkeit durch Tuberkulose darstellte.[40]
Eisen ist ein Übergangsmetall; es gibt Hinweise, dass ein Überangebot, vor allem von seiner zweiwertigen Form (Fe2+), im Gehirn unter bestimmten Voraussetzungen zu neurodegenerativen Erkrankungen wie beispielsweise der Parkinson- oder auch der Alzheimer-Krankheit führen könnte. Jedoch ist noch nicht klar, ob die gefundenen Eisenablagerungen Ursache oder Folge der Erkrankung sind.[41]
Auch in pflanzlichen Organismen ist Eisen ein essentielles Spurenelement. Es beeinflusst die Photosynthese sowie die Bildung von Chlorophyll und Kohlenhydraten.[35] Eisenüberladung kann sich jedoch in Form von Eisentoxizität bemerkbar machen. In Böden liegt es bei normalen pH-Werten als Fe(OH)3 vor. Bei geringem Sauerstoffgehalt des Bodens wird Eisen(III) durch Reduktion zum Eisen(II) reduziert. Dadurch wird das Eisen in eine lösliche, für Pflanzen verfügbare Form gebracht. Nimmt diese Verfügbarkeit unter anaeroben Bedingungen, zum Beispiel durch Bodenverdichtung, zu stark zu, können Pflanzenschäden durch Eisentoxizität auftreten, eine Erscheinung, die besonders in Reisanbaugebieten bekannt ist.[42]
Nachweis
Bei der Nachweisreaktion für Eisen-Ionen werden zunächst die beiden Kationen Fe2+ und Fe3+ unterschieden.
Eisennachweis mit Thioglykolsäure
Mit Thioglykolsäure lassen sich Fe2+- und Fe3+-Ionen nachweisen:
- $ \mathrm {Fe^{2+}+2\ HS{-}CH_{2}{-}COOH\longrightarrow [Fe(SCH_{2}COO)_{2}]^{2-}+4\ H^{+}} $
Bei Anwesenheit von Fe2+- oder Fe3+-Ionen entsteht eine intensive Rotfärbung.
Eisennachweis mit Hexacyanoferraten
Die Fe2+-Ionen lassen sich mit rotem Blutlaugensalz nachweisen:
- $ \mathrm {3\ Fe^{2+}+2\ K_{3}[Fe(CN)_{6}]\longrightarrow Fe_{3}[Fe(CN)_{6}]_{2}+6\ K^{+}} $
Fe3+-Ionen lassen sich mit gelbem Blutlaugensalz nachweisen:
- $ \mathrm {4\ Fe^{3+}+3\ K_{4}[Fe(CN)_{6}]\longrightarrow Fe_{4}[Fe(CN)_{6}]_{3}+12\ K^{+}} $
Bei beiden Nachweisreaktionen entsteht tiefblaues Berliner Blau, ein wichtiger Farbstoff. Es läuft keine Komplexbildungsreaktion ab, sondern lediglich ein Kationenaustausch.
Beide Pigmente sind weitgehend identisch, da zwischen ihnen ein chemisches Gleichgewicht besteht. Dabei geht Fe3+ in Fe2+ über und umgekehrt:
Die besonders intensive blaue Farbe des Komplexes entsteht durch Metall-Metall-Charge-Transfers zwischen den Eisen-Ionen. Es ist bemerkenswert, dass dieses bekannte Eisennachweisreagenz selbst Eisen enthält, welches durch die Cyanidionen chemisch gut maskiert wird (Innerorbitalkomplex) und somit die Grenzen der chemischen Analytik aufzeigt.
Eisennachweis mit Thiocyanaten
Alternativ kann man Eisen(III)-salze mit Thiocyanaten (Rhodaniden) nachweisen. Diese reagieren mit Eisen(III)-Ionen zu Eisen(III)-thiocyanat:
- $ \mathrm {Fe^{3+}+3\ SCN^{-}\longrightarrow Fe(SCN)_{3}} $
Es bildet sich das tiefrote Fe(SCN)3, welches in Lösung bleibt. Allerdings stören einige Begleitionen diesen Nachweis (z. B. Co2+, Mo3+, Hg2+, Überschuss an Mineralsäuren), so dass u. U. ein Kationentrenngang durchgeführt werden muss.
Verbindungen
Wertigkeiten und Oxidationsstufen
- Fe2−, in [Fe(CO)4]2−, [Fe(CO)2(NO)2] hier ist das (NO)1+
- Fe1−, in [Fe2(CO)8]2−
- Fe0, als Fe(CO)5, Fe2(CO)9 sowie Fe3(CO)12
- Fe1+, äußerst ungewöhnlich, z. B. als [Fe(H2O)5NO]2+. (Ringprobe, Nachweis von NO3−)
- Fe2+, diese Salze sind zumeist blassgrün,
- Fe3+, diese Ionen sind fast farblos. Lösungen von Fe(III)-Salzen reagieren stark sauer und sind gelb gefärbt. Die Farbe entsteht durch Charge-transfer-Banden von Hydroxo-Ionen, wie bei [Fe(H2O)5OH]2+.
- Fe4+, kommt in Li2FeO3, BaFeO3 u. a. sowie in den Katalysezyklen einiger Enzyme vor (zum Beispiel Cytochrom-c-Oxidase, Cytochrom P450, Peroxidasen),
- Fe5+, FeO43−
- Fe6+, ist selten (beispielsweise K2FeO4, BaFeO4).
Oxide
Eisen bildet mit Sauerstoff zweiwertige und dreiwertige Oxide:
- Eisen(III)-oxid (Fe2O3) ist eine rote bis braune Substanz und entsteht durch Oxidation von Eisen im Sauerstoffüberschuss. In der Natur tritt es in Form der Minerale Hämatit und Maghemit auf.
- Eisen(II,III)-oxid (Fe3O4) entsteht auf natürlichem Wege durch vulkanische Vorgänge oder beim direkten Verbrennen von Eisen, z. B. mit dem Schneidbrenner als Eisenhammerschlag und wird als Mineral als Magnetit bezeichnet.
- Eisen(II)-oxid (FeO) entsteht nur bei der vorsichtigen Zersetzung von Eisen(II)-oxalat FeC2O4 im Vakuum. Es ist schwarz und bis 560 °C instabil. Als Mineral Wüstit entsteht es meist aus der Verwitterung von Magnetit.
Da diese Oxide keine feste Schutzschicht bilden, oxidiert ein der Atmosphäre ausgesetzter Eisenkörper vollständig. Die poröse Oxidschicht verlangsamt den Oxidationsvorgang, kann ihn jedoch nicht verhindern, weshalb das Brünieren als schwacher Schutz vor Korrosion dient.[46] Wenn Eisenkörper vor dem endgültigen Verrosten eingesammelt und dem Recycling zugeführt werden, sind verrostetes Eisen und verrosteter Stahl bei der Stahlproduktion im Elektro-Schmelzofen ein begehrter und wertvoller Sauerstoffträger. Dieser Sauerstoff im Eisenschrott wirkt beim „Stahlkochen“ als Oxidationsmittel, um ungewünschte qualitätsmindernde Beimengungen (z. B. Leichtmetalle) zu oxidieren (verbrennen).
Eisenoxide und Eisenhydroxide werden als Lebensmittelzusatzstoffe verwendet (E 172).
Salze
Eisen bildet zweiwertige und dreiwertige Salze:
- Eisen(II)-chlorid (FeCl2 · 6 H2O) wird angewendet zum Ausfällen von Sulfiden, Faulgasentschwefelung, Biogasentschwefelung, Chromatreduzierung und Phosphatelimination; dazu gehört die Simultanfällung.
- Eisen(II)-sulfat (FeSO4 · 7 H2O) wird wegen seiner Farbe auch Grünsalz genannt, als Mineral Melanterit. Anwendungen wie beim Eisen(II)-chlorid, sowie bei getrocknetem Eisen(II)-sulfat als Chromatreduzierer speziell im Zement gegen die Chromatallergie.
- Eisen(III)-chlorid (FeCl3 · 6 H2O) kann Kupfer oxidieren und lösen; deshalb kann man wässrige Eisen(III)-chlorid-Lösungen zum schonenden Ätzen von Leiterplatten verwenden. Reaktionsformel:
- $ \mathrm {Cu+2\ FeCl_{3}\longrightarrow CuCl_{2}+2\ FeCl_{2}} $
- Eisen(III)-chloridsulfat (FeClSO4)
Alle Eisensalze werden unter anderem verwendet als Flockungsmittel und zur Phosphatelimination, dazu gehören die Vorfällung, Simultanfällung, Nachfällung und Flockenfiltration sowie das Ausfällen von Sulfiden, Faulgasentschwefelung und Biogasentschwefelung.
Weitere Eisenverbindungen
Einzelne Eisenverbindungen:
- Fe3C, Eisencarbid.
- Fe(CO)5, Eisenpentacarbonyl, IPC (I für iron), entsteht unter Druck aus Eisen und Kohlenmonoxid und bildet nach seiner Zersetzung neben Kohlenmonoxid ein besonders reines Eisenpulver, das Carbonyleisen. Weitere Eisencarbonyle sind Fe2(CO)9 und Fe3(CO)12.
- Fe(SCN)3, Eisen(III)-thiocyanat, Eisenrhodanid, hat eine sehr intensive blutrote Färbung und dient zum Nachweis von Fe3+-Ionen.
- Ferrocen, ein Metallocen (Sandwichverbindung).
Anmerkungen
- ↑ das Wort scheint Germanen und Kelten gemeinsam gewesen zu sein, die Abstammung von einer gemeinsamen indogermanischen Wurzel ist jedoch nicht sicher geklärt.
Einzelnachweise
- ↑ 1,0 1,1 Harry H. Binder: Lexikon der chemischen Elemente, S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3.
- ↑ Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Eisen) entnommen.
- ↑ Ludwig Bergmann, Clemens Schaefer, Rainer Kassing: Lehrbuch der Experimentalphysik, Band 6: Festkörper. 2. Auflage, Walter de Gruyter, 2005, ISBN 3-11-017485-5, S. 361.
- ↑ 4,0 4,1 K. Schubert: Ein Modell für die Kristallstrukturen der chemischen Elemente. In: Acta Crystallographica. 1974, B30, S. 193–204; doi:10.1107/S0567740874002469.
- ↑ 5,0 5,1 Yiming Zhang, Julian R. G. Evans, Shoufeng Yang: Corrected Values for Boiling Points and Enthalpies of Vaporization of Elements in Handbooks. In: Journal of Chemical & Engineering Data. 56, 2011, S. 328–337, doi:10.1021/je1011086.
- ↑ Datenblatt Iron bei Sigma-Aldrich, abgerufen am 29. März 2011.
- ↑ Seit 1. Dezember 2012 ist für Stoffe ausschließlich die GHS-Gefahrstoffkennzeichnung zulässig. Bis zum 1. Juni 2015 dürfen noch die R-Sätze dieses Stoffes für die Einstufung von Zubereitungen herangezogen werden, anschließend ist die EU-Gefahrstoffkennzeichnung von rein historischem Interesse.
- ↑ Datenblatt Eisen bei Carl Roth, abgerufen am 14. Dezember 2010. Dies gilt nur für Pulver, kompaktes Eisen ist ohne Gefahrensymbole/R-/S-Sätze.
- ↑ Otto Johannsen: Geschichte des Eisens. 3. Auflage, Verlag Stahleisen, Düsseldorf, 1953, S. 6.
- ↑ 10,0 10,1 10,2 Otto Johannsen: Geschichte des Eisens. 3. Auflage, Verlag Stahleisen, Düsseldorf, 1953, S. 38.
- ↑ 11,0 11,1 Otto Johannsen: Geschichte des Eisens. 3. Auflage, Verlag Stahleisen, Düsseldorf, 1953, S. 40.
- ↑ Otto Johannsen: Geschichte des Eisens. 3. Auflage, Verlag Stahleisen, Düsseldorf, 1953, S. 44.
- ↑ Otto Johannsen: Geschichte des Eisens. 3. Auflage, Verlag Stahleisen, Düsseldorf, 1953, S. 39.
- ↑ Eine Analyse des Eisendolchs wurde bisher von der Verwaltung des Ägyptischen Museums verweigert, daher ist unbekannt, ob es sich um Meteoriteneisen oder irdisches Eisen handelt, siehe Bericht des PM-Magazins: 7 Dinge, die es nicht geben dürfte - oder?
- ↑ 15,0 15,1 15,2 Verein Deutscher Eisenhüttenleute: Gemeinfassliche Darstellung des Eisenhüttenwesens. 17. Auflage, Stahleisen, Düsseldorf 1970/71, S. 5.
- ↑ Otto Johannsen: Geschichte des Eisens. 3. Auflage, Verlag Stahleisen, Düsseldorf, 1953, S. 45.
- ↑ Mineralienatlas:Mineralienportrait/Eisen
- ↑ Otto Johannsen: Geschichte des Eisens. 3. Auflage, Verlag Stahleisen, Düsseldorf, 1953, S. 9-11.
- ↑ Handbook of Mineralogy - Iron (englisch, 57 kB)
- ↑ IMA/CNMNC List of Mineral Names - Iron (englisch, PDF 1,8 MB; S. 137)
- ↑ Mindat - Localities for Iron
- ↑ Martin Okrusch, Siegfried Matthes: Mineralogie: Eine Einführung in die spezielle Mineralogie, Petrologie und Lagerstättenkunde. 7. Auflage. Springer Verlag, Berlin, Heidelberg, New York 2005, ISBN 3-540-23812-3, S. 22.
- ↑ Stefan Weiß: Das große Lapis Mineralienverzeichnis. 5. Auflage. Christian Weise Verlag, München 2008, ISBN 978-3-921656-17-4.
- ↑ Mineralienatlas:Josephinit
- ↑ Webmineral – Mineral Species sorted by the element Fe (Iron)
- ↑ United States Geological Survey: World Production
- ↑ World Steel Association: Daten auf der Homepage abrufbar
- ↑ Verein Deutscher Eisenhüttenleute: Gemeinfassliche Darstellung des Eisenhüttenwesens. 17. Auflage, Stahleisen, Düsseldorf 1970/71, S. 103-118.
- ↑ M. P. Fewell: The atomic nuclide with the highest mean binding energy. In: American Journal of Physics. 63, Nr. 7, 1995, S. 653–658. doi:10.1119/1.17828.
- ↑ Reinhard Boehler: High-pressure experiments and the phase diagram of lower mantle and core materials. In: American Geophysical Union (Hrsg.): Review of Geophysics. 38, 2000, S. 221–245. doi:10.1029/1998RG000053.
- ↑ Properties of Rocks and Minerals – High-Pressure Melting. In: Mineral Physics, 2, S. 527–541, Elsevier 2007
- ↑ Thieme Chemistry (Hrsg.): Eintrag zu Eisen im Römpp Online. Version 3.29. Georg Thieme Verlag, Stuttgart 2012, abgerufen am 9. Januar 2012.
- ↑ Wissenschaft-Online-Lexika: Eintrag zu Eisen im Lexikon der Chemie, abgerufen am 9. Januar 2012.
- ↑ D. Glindemann, A. Dietrich, H.-J. Staerk und P. Kuschk Die zwei Gerüche des Eisens bei Berührung und unter Säureeinwirkung – (Haut)Carbonylverbindungen und Organophosphine, Angewandte Chemie, 118 (42), (2006), S. 7163–7166 doi:10.1002/ange.200602100.
- ↑ 35,0 35,1 J. Falbe, M. Regitz (Hrsg.): Römpp Chemie Lexikon, 9. Aufl., Georg Thieme Verlag, Stuttgart 1992.
- ↑ Ferritin. In: Römpp Chemie-Lexikon, Thieme Verlag, 2009 (online)
- ↑ F. Widdel, S. Schnell, S. Heising, A. Ehrenreich, B. Assmus, B. Schink: Ferrous iron oxidation by anoxygenic phototrophic bacteria. In: Nature Vol. 362, 1993, S. 834–836.
- ↑ Martin Vieweg: Eiserne Früh-Genetik. wissenschaft.de, abgerufen am 4. Juni 2012.
- ↑ P. Nielsen: Einteilung der Eisenüberladung
- ↑ Schaible UE, Kaufmann SH: Iron and microbial infection. In: Nat. Rev. Microbiol.. 2, Nr. 12, Dezember 2004, S. 946–953. doi:10.1038/nrmicro1046. PMID 15550940.
- ↑ DEGUM: „DEGUM: Parkinson-Erkrankung vor dem Ausbruch erkennen“ Informationsdienst Wissenschaft, 6. Juli 2006.
- ↑ Günter Fellenberg: Chemie der Umweltbelastung, 3. Aufl. Verlag B. G. Teubner, Stuttgart 1997, S. 158.
- ↑ Holleman, Wiberg: Lehrbuch der Anorganischen Chemie, 101. Auflage.
- ↑ Jander, Blasius: Lehrbuch der analytischen und präparativen anorganischen Chemie, 13. Auflage.
- ↑ Ehlers: Analytik I, 8. Auflage.
- ↑ Chemie für Ingenieure, Pearson Deutschland GmbH, 2008, ISBN 3827372674, S. 256, eingeschränkte Vorschau in der Google Buchsuche
Literatur
- Ludwig Beck: Die Geschichte des Eisens in technischer und kulturgeschichtlicher Beziehung. Band 1–5, Vieweg, Braunschweig 1884–1903.
- Harry H. Binder: Lexikon der chemischen Elemente - das Periodensystem in Fakten, Zahlen und Daten. S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3.
- Vagn Fabritius Buchwald: Iron and steel in ancient times. Kong. Danske Videnskab. Selskab, Kopenhagen 2005, ISBN 87-7304-308-7.
- Otto Johannsen (im Auftrag des Vereins Deutscher Eisenhüttenleute): Geschichte des Eisens. 3. Auflage, Verlag Stahleisen, Düsseldorf, 1953.
- Otto Johannsen: Geschichte des Eisens. Düsseldorf 1925 (Digitalisat)
- H. Schoppa: Was der Hochöfner von seiner Arbeit wissen muss. Verlag Stahleisen, Düsseldorf 1992, ISBN 3-514-00443-9.
- Verein Deutscher Eisenhüttenleute: Gemeinfassliche Darstellung des Eisenhüttenwesens. 17. Auflage, Stahleisen, Düsseldorf 1970/71.
Weblinks
- Mineralienatlas:Eisen im Mineralienatlas
- Mineralienatlas:Mineralienportrait/Eisen im Mineralienatlas
- Eisenherstellung in der Römerzeit bei die-roemer-online.de
- Eisengewinnung in vorgeschichtlicher Zeit auf der Internetpräsenz vom Landschaftsmuseum Obermain
| Alkalimetalle | Erdalkalimetalle | Lanthanoide | Actinoide | Übergangsmetalle | Metalle | Halbmetalle | Nichtmetalle | Halogene | Edelgase | unbekannt |