44. Ammoniak - eine Base
Gewinnung und Darstellung
Ammoniak ist eine Grundchemikalie, die großtechnisch produziert wird. So wurden im Jahr 2011 weltweit 136 Millionen Tonnen hergestellt, wobei die Hauptproduzenten die Volksrepublik China, Indien, Russland und die Vereinigten Staaten sind. Für die Ammoniakproduktion werden große Mengen fossiler Energieträger benötigt, deren Anteil an der Ammoniakproduktion am weltweiten Verbrauch fossiler Energieträgeretwa 1,4 % beträgt .
Über 90 % des produzierten Ammoniaks wird über das Haber-Bosch-Verfahren hergestellt. Dabei reagieren die Gase Stickstoff und Wasserstoff in großen Reaktoren miteinander.
Ammoniak (NH3) entweicht beim Erwärmen von Ammoniumhydroxid (Salmiakgeist). Ammoniak ist ein stark stechend riechendes, farbloses, wasserlösliches und giftiges Gas, das zu Tränen reizt und erstickend wirkt. Ammoniak ist ein amphoterer Stoff: Unter wässrigen Bedingungen wirkt es als Base. Das Ammoniakmolekül trägt am Stickstoff ein freies Elektronenpaar:
NH3
= Ammoniak
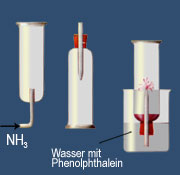
In Wasser ist Ammoniak sehr gut löslich. Bei 0 °C lösen sich 1176 Liter Ammoniak in einem Liter Wasser. Die Lösungen werden Ammoniumhydroxid, Salmiakgeist oder Ammoniakwasser genannt und reagieren laugenhaft (= alkalisch, d. h. Indikatoren nehmen eine charakteristische Farbe an).
Die Erklärung der Reaktion von Ammoniak mit Wasser
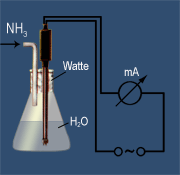
Die alkalische Reaktion, der Springbrunnenversuch und die elektrische Leitfähigkeit beim Einleiten von Ammoniak in Wasser lassen auf eine chemische Reaktion schließen. Sie erinnert an die Reaktion von Chlorwasserstoff mit Wasser - nur dass nun eine laugenhafte Reaktion beobachtet wird.
Wie das Wassermolekül ist auch das NH3 - Molekül ein Dipolmolekül. Treffen daher die Moleküle H2O und NH3 aufeinander, so ziehen sie sich mit den entgegengesetzt geladenen Polen an.
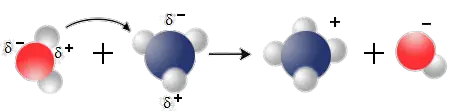
$ \mathrm { {\underbrace { \overset {\Large {H}} {\overset {\Large {\cdotp \cdotp }} {\underset {\Large {\cdotp \cdotp }} {O}}}:H}_{Wasser} + \underbrace {: {\overset {\Large {H}} {\overset {\Large {\cdotp \cdotp }} {\underset {\Large {H}} {\underset {\Large {\cdotp \cdotp }} {N}}}}}:H}_{\underset {\large NH_3} {Ammoniak} }} \longrightarrow \ \underbrace {\Biggl[ H: { \overset {\Large {H}} {\overset {\Large {\cdotp \cdotp }} { \underset {\Large {H}} {\underset {\Large {\cdotp \cdotp }} {N}}}}} :H \Biggr]^+}_{\underset {\large NH_4} {Ammonium-Ion}} + \underbrace {\Biggl[ :{\overset {\Large {\cdotp \cdotp }} {\underset {\Large {\cdotp \cdotp }} {O}}}:H \Biggr]^-}_{\underset {\large {OH^-}} {Hydroxid-Ion}} } $
Die enorme Anziehungskraft des freien Elektronenpaars am Stickstoffatom bewirkt, dass vom Wassermolekül ein Wasserstoff-Ion zum Ammoniak übergeht. Die dadurch entstehen Ionen sind für die elektrische Leitfähigkeit des Ammoniakwassers verantwortlich.
Aus dem Ammoniakmolekül wird durch Aufnahme eines Wasserstoff-Ions (= Proton) ein positiv geladenes Molekül-Ion, das man Ammonium-Ion nennt. Im Ammonium-Ion sind die vier Wasserstoffatome über gemeinsame Elektronenpaare an das Stickstoffatom gebunden. Die alkalische Reaktion wird von den bei der Reaktion entstandenen Hydroxid-Ionen verursacht. Das Wasser spielt hier die Rolle des Protonenspenders (Protonendonator), Säure und Ammoniak die Rolle der Protonenempfänger (Protonenakzeptor). Teilchen, die Protonen aufnehmen, heißen Basen.
Nach dieser im Jahre 1923 von Johannes Nicolaus BrØnsted gegebenen Definition sind Säuren Protonenspender und Basen Protonenempfänger. Nicht nur das Wasser ist imstande, Spender oder Empfänger von Protonen zu sein, auch andere Moleküle sind dazu in der Lage.
$\mathrm { {\underbrace {H: { \overset {\Large {\cdotp \cdotp }} { \underset {\Large {H}} {\underset {\Large {\cdotp \cdotp }} {N}}} :H}}_{\underset {\large(Base)} {Ammoniak }} + \underbrace {H: {\overset {\Large {\cdotp \cdotp }} {\underset {\Large {\cdotp \cdotp }} {Cl}}}:}_{\underset {\large (Säure)} {Chlorwasserstoff} }} \longrightarrow \underbrace {\Biggl[ H: { \overset {\Large {H}} {\overset {\Large {\cdotp \cdotp }} { \underset {\Large {H}} {\underset {\Large {\cdotp \cdotp }} {N}}}}} :H \Biggr]^+ + \Biggl[ :{\overset {\Large {\cdotp \cdotp }} {\underset {\Large {\cdotp \cdotp }}{Cl}}}: \Biggr]^-}_{\underset {(Salz)} {Ammoniumchlorid}} }$
Deshalb vereinigen sich die Gase Ammoniak und Chlorwasserstoff zu festem Ammoniumchlorid.
Säure-Base-Reaktionen sind gekoppelte Reaktionen: Eine Säure kann nur ein Proton abgeben, wenn gleichzeitig ein Protonenempfänger vorhanden ist.