2. Experimente zur eindeutigen Stoffbeschreibung
Erkennungsmerkmale von Stoffen: ihre Eigenschaften
Jeder Mensch besitzt Eigenschaften, die er mit anderen teilt, und solche, die ihn einzigartig machen: Augenfarbe, Haarfarbe, Hautfarbe, Form der Augen, des Kopfes und der Ohren, Größe, Gewicht, Blutgruppe, Geschlecht usw. Unter mittlerweile mehr als 8 Milliarden Menschen kann man anhand der Summe solcher Eigenschaften eine einzige bestimmte Person charakterisieren.
In der Chemie sind mittlerweile sehr viele Stoffe bekannt - eine Zahl in zweistelliger Millionenhöhe. Um die Stoffe voneinander unterscheiden zu können, bestimmt man ihre Eigenschaften. Wie in dem Beispiel mit den Menschen gibt es auch in der Chemie Stoffeigenschaften, die manche Stoffe mit anderen gemeinsam haben, und solche, die sie von anderen unterscheiden.
Aggregatzustände

Ein Festkörper hat eine bestimmte Form und ein bestimtes Volumen, eine Flüssigkeit hat ein bestimmtes Volumen, aber keine bestimmte Form. Die hängt nämlich von dem Behälter ab, in dem sie sich befindet. Ein Gas hat weder ein bestimmtes Volumen, noch eine bestimmte Form. Ein Gas füllt seinen Behälter immer vollständig aus und ist sehr viel leichter als eine Flüssigkeit oder ein Festkörper. Der Stoff H2O kann ein Festkörper sein (Eis), eine Flüssigkeit (Wasser) oder ein Gas (Dampf). Wasser ändert seinen Aggregatzustand, wenn man es erhitzt oder abkühlt.
Eins der wichtigsten Erkennungsmerkmale eines Stoffes ist daher sein Aggregatzustand bei Raumtemperatur und Normaldruck (1013 Hektopascal). Leben ist nur durch die Gase Sauerstoff und Kohlenstoffdioxid möglich, bei gleichzeitiger Anwesenheit von ausreichend viel flüssigem Wasser. Für die Stabilität des lebendigen Körpers ist die Existenz von Feststoffen unabdingbar. Was für Pflanzen die Zellulose, ist das Chitin für Insekten und die Knochen für Wirbeltiere.
Schmelz- und Siedepunkt
Der Aggregatzustand eines Stoffes hängt von der Temperatur ab, bei der er schmilzt oder erstarrt bzw. siedet oder kondensiert. Schmelz- und Siedepunkte hängen von den Teilchen ab, aus denen ein Stoff besteht. Das heißt, dass:
- keine zwei Substanzen die selben Schmelz- und Siedepunkte haben
- Schmelz- und Siedepunkt einer Substanz sich ändert, wenn man auch nur geringste Mengen einer anderen Substanz beimischt.
Daher kann man durch die Bestimmung von Schmelz- und Siedepunkt eine Menge über einen Stoff herausfinden:
- Man kann bestimmen, um welchen Stoff es sich handelt
- Man kann erkennen, ob es sich um einen Reinstoff oder um ein Gemisch handelt
| Stoff | Schmelzpunkt °C | Siedepunkt °C |
|---|---|---|
| Sauerstoff | -219 | -183 |
| Ethanol | -114 | 78 |
| Natrium | 98 | 890 |
| Schwefel | 119 | 445 |
| Eisen | 1450 | 2900 |
| Diamant | 3550 | 4832 |
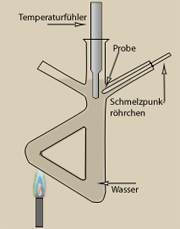
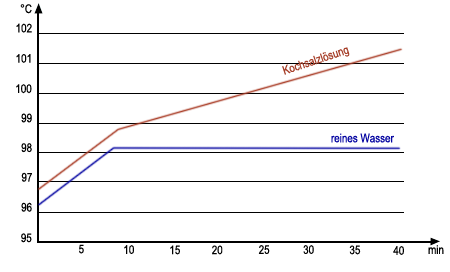
Wenn man Salz in Wasser löst, so hat das Salzwasser einen höheren Siedepunkt als Leitungswasser. Wenn Salzwasser siedet, dann verdampft laufend Wasser und man beobachtet ein langsames Ansteigen der Siedetemperatur (Siedebereich) (Versuch 1). Da das Wasser kontinuierlich verdampft, steigt der Anteil des Salzes im Wasser, daher hängt der Siedepunkt also von der Menge des gelösten Salzes im Salzwasser ab.
Mischungen haben einen Siedebereich. Reinstoffe haben einen festen Siedepunkt.
Nur Reinstoffe haben also einen festen Schmelzpunkt. Das Wasser des Meeres hat einen tieferen Gefrierpunkt als das Wasser eines Sees. Meerwasser hat einen tieferen Gefrierpunkt als reines Wasser. Der Gefrierpunkt einer Mischung hängt wie der Siedepunkt von den Anteilen der gemischten Stoffe ab. Bei der Bestimmung des Schmelz- und Siedepunktes von Stoffen werden Zahlen ermittelt, diese Art der Stoffbestimmung ist daher sehr zuverlässig. Die Bestimmung von Schmelz- und Siedepunkt reicht daher in vielen Fällen bereits aus, um einen Stoff eindeutig zu erkennen.
Will man nicht nur Messpunkte, sondern ganze Messbereiche aufzeichnen (beispielsweise die steigende Siedetemperatur von Salzwasser während des Kochens wie oben beschrieben) eignen sich sogenannte Datenlogger (von PCE Instruments) besonders gut dafür.
Die Löslichkeit
Wenn man zu Wasser eine geringe Menge Salz oder Zucker gibt, kann man sehen, dass sich die Feststoffe langsam auflösen. Demnach ist Wasser ein Lösungsmittel für Zucker und Salz. Im Lösungsmittel Benzin löst sich dagegen Salz nicht auf.
Daher muß das Lösungsmittel bei Aussagen wie «löslich» oder «unlöslich» immer angegeben werden.
Chemikerinnen und Chemiker bezeichnen Salz- oder Zuckerwasser als Salzlösung bzw. Zuckerlösung. Fett löst sich nicht in Wasser auf, in Benzin hingegen schon. Chemische Reinigungsbetriebe bedienen sich einer Vielzahl von Lösungsmitteln, mit denen Schmutz gelöst und so beseitigt werden kann.
| Schmelz- punkt °C |
Siede- punkt °C |
Löslichkeit in Wasser |
Brenn- barkeit |
Elektrische Leitfähigkeit |
|
| Ethanol | − 112 | 78,2 | |||
| Blei | 326,4 | 1750 | |||
| Schwefel | 119 | 444,6 |
Der Begriff Löslichkeit ist sehr genau definiert:
Die Löslichkeit eines Stoffes in einem Lösungsmittel bei einer bestimmten Temperatur ist die maximale Stoffmenge in Gramm, die sich in 100 g Lösungsmittel (bei dieser Temperatur) löst.
Die Löslichkeit wird in Gramm (g) Reinstoff pro 100 g Lösungsmittel angegeben. Sie hängt davon ab, aus welchen Stoffen eine chemische Verbindung zusammengesetzt ist, beispielsweise ist die Löslichkeit der beiden Metallverbindungen Silbernitrat und Silberchlorid in Wasser höchst unterschiedlich, wie die Tabelle unten zeigt.
| Verbindung | Masse in g, die sich in 100 g Wasser bei 25°C lösen | |
| Silbernitrat | 241,3 | Die Löslichkeit nimmt von oben nach unten ab! |
| Calciumnitrat | 102,1 | |
| Magnesiumchlorid | 53,0 | |
| Kalimnitrat | 37,9 | |
| Kaliumsulfat | 12,0 | |
| Calciumhydroxid | 0,113 | |
| Calciumcarbonat | 0,0013 | |
| Silberchlorid | 0,0002 | |
Wie man die Löslichkeit eines Stoffes bestimmt
Für den Versuch eignet sich Kaliumsulfat. Folgendes ist zu tun:
- Wiege 2 g Kaliumsulfat aus und bringe die Probe in ein Reagenzglas. Gib etwas Wasser aus einem Messzylinder hinzu.
- Erhitze das Reagenzglas über einer Brennerflamme, das Wasser soll aber nicht sieden. Falls nötig, gib soviel Wasser bis zu dem Punkt hinzu, an dem alles Kaliumsulfat gelöst ist.
- Laß die Lösung unter Umrühren mit einem Glasthermometer abkühlen. Notiere die Temperatur, bei der sich wieder die ersten Kristalle bilden.
Da du die Masse des gelösten Kaliumsulfats sowie das Volumen des benötigten Wassers kennst, kannst du die Löslichkeit berechnen. Schauen wir uns aber noch einmal den letzten Schritt an. Wenn du erneut etwas Wasser zugibst, erneut erhitzt und abkühlst, kannst du die Löslichkeit bei einer niedrigeren Temperatur bestimmen. So kannst du die Löslichkeit des Kaliumsulfats für einen ganzen Temperaturbereich bestimmen.
Berechnung der Löslichkeit
- 2 g Kaliumsulfat wurden in 12,5 cm³ Wasser gelöst.
- Bei der Abkühlung bildeten sich bei 60°C wieder die ersten Kristalle.
- 12,5 cm³ Wasser wiegen 12,5 g.
- In 12,5 g Wasser lösen sich 2 g Kaliumsulfat, so dass sich in 1 g Wasser $ \mathrm { \large \frac {2}{12,5} }$ g Kaliumsulfat und in 100 g Wasser $ \mathrm { \large \frac {2 \ \cdot \ 100} {12,5} }$ g Kaliumsulfat lösen.
- $ \mathrm { {\large \frac {2 \ \cdot \ 100} {12,5}} = 16 }$. Die Löslichkeit von Kaliumsulfat in Wasser bei 60°C ist 16 Gramm
Die Brennbarkeit
Die Einordnung von Stoffen anhand ihrer Brennbarkeit ist eine wichtige Aufgabe beim Brandschutz. Eine erste Einteilung erfolgt, ob der Stoff brennbar oder nicht brennbar ist.
Eine für den Alltag oder auch für Feuerwehren viel wichtigere Eigenschaft eines Stoffes ist seine Entflammbarkeit. Die meisten organischen Verbindungen sind brennbar, manche Kunststoffe sind jedoch schwer entflammbar und damit auch für den Brandschutz geeignet.
Unter den brennbaren Stoffen gibt es viele besonders feuergefährliche Stoffe. Sie können explosionsartig abbrennen, weshalb Behälter und Tanklastzüge mit brennbaren Stoffen besonders gekennzeichnet werden müssen (Bild 1, Kapitel 13). Beim Umfüllen brennbarer Flüssigkeiten ist äußerste Vorsicht geboten: kein offenes Feuer, kein elektrischer Zündfunke!
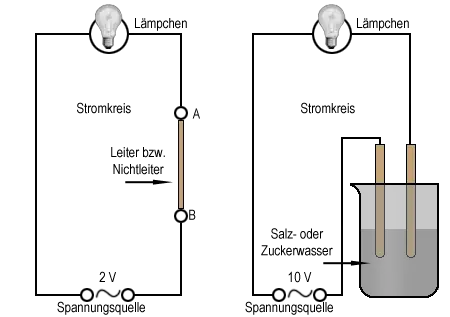
Die elektrische Leitfähigkeit
Besonders Metalle sind gute Leiter für den elektrischen Strom, Glas oder viele Kunststoffe dagegen nicht. Feststoffe kann man anhand dieser Eigenschaft also in Leiter und Nichtleiter einteilen.
Bei Versuch 4 können wir beobachten, dass auch bestimmte Lösungen den elektrischen Strom leiten. Die Einteilung in Leiter und Nichtleiter gilt also auch für Flüssigkeiten. Kommen Elektrogeräte mit Flüssigkeiten in Berührung, muß man äußerst vorsichtig sein. Beispielsweise kann man von tödlichen Unfällen durch einen Stromschlag immer wieder hören, die sich beispielsweise in Badezimmern ereignen.