56. Metalle
Metalle - Grundlage der menschlichen Technik

Menschen stellen schon seit vielen tausend Jahren aus Metallen so unterschiedliche Dinge wie Werkzeuge, Waffen, Schmuck und Münzen her. Nach dem Ende der letzten Eiszeit prägten Metalle die nachfolgenden Epochen der Menschheitsgeschichte. Kupferzeit, Bronzezeit und Eisenzeit sind bekannte Begriffe aus dem Geschichtsunterricht - mit diesen Epochen begann das Zeitalter der Metalle.
Seitdem haben Metalle als wichtige und unentbehrliche Werkstoffe drastisch an Bedeutung zugenommen. Heutige Gesellschaften sind ohne Metalle undenkbar: Es gäbe praktisch weder Maschinen noch Werkzeuge, weder Flugzeuge, Schiffe noch Fahrzeuge.
Vorteilhafte Eigenschaften der Metalle

- Metalle können mechanisch verformt werden, ohne zu bechen. Handwerk und Industrie nutzen diese Eigenschaft, indem sie Metalle schmieden, pressen, walzen oder ziehen.
- Metalle sind gute Leiter für den elektrischen Strom. Wie fast alle physikalischen Vorgänge ist auch die elektrische Leitfähigkeit der Metalle abhängig von der Temperatur. Sie sinkt mit steigender Temperatur während sie bei sehr niedrigen Temperaturen unendlich groß werden kann ("Supraleiter"). Ohne Metalle gäbe es keine Elektrotechnik, da Elektrokabel neben der Isolierung immer aus Metall bestehen.
- Metalle haben eine gute Wärmeleitfähigkeit. Daher konstruiert man aus Metallen Geräte, die Wärme übertragen sollen. Solche Geräte nennt man allgemein Wärmetauscher, dazu gehören beispielsweise Autokühler oder die Heizkörper in unseren Wohnungen. Auch Kochtöpfe werden aus Metallen hergestellt (nur die Griffe bestehen aus naheliegenden Gründen meist aus Kunststoff, früher aus Holz). Wenn man Metalle berührt, fühlen sie sich kalt an. Auch diese Eigenschaft ist auf die gute Wärmeleitfähigkeit der Metalle zurückzuführen. Sie nehmen die Wärme der Haut schnell auf und transportieren sie weiter.
- Bis auf eine Ausnahme (Quecksilber, Hg) sind Metalle bei Raumtemperatur Feststoffe, die erst bei hohen Temperaturen schmelzen oder sieden. Elementares Quecksilber ist eine silberhell glänzende, sehr giftige Flüssigkeit. Es erstarrt bei -39°C und verdampft bei Zimmertemperatur leicht. Trotzdem hat auch das flüssige Quecksilber alle Eigenschaften der Metalle.
- Metalle reflektieren das Licht, dadurch entsteht der charakteristische Glanz ihrer Oberflächen. Ihr Glanz macht Metalle interessand für das Kunsthandwerk, beispielsweise für die Herstellung von Schmuck. Außerdem nutzt man den Glanz der Metalle für die Herstellung von Spiegeln: Hinter dem Glas ist eine dünne Metallschicht aufgetragen. Die Farbe des Glanzes ist fast immer silbrig, bei Kupfer allerdings rötlich und bei Gold gelb. Der Glanz der Metalloberfläche geht allerdings mit der Zeit verloren, und zwar durch die Reaktion des Metalls mit dem Sauerstoff der Luft. Das "Anlaufen" von Silber geht dagegen auf die Reaktion mit dem in der Luft in geringen Mengen enthaltenen Schwefelwasserstoff (H2S) zurück.
Das Elektronengasmodell
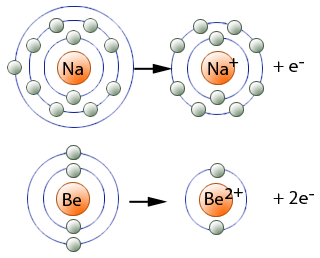
Metalle stehen im Periodensystem der Elemente sowohl in den Haupt- als auch in den Nebengruppen. Sie besitzen fast immer nur 1 oder 2 Außenelektronen, die nur schwach gebunden sind und daher leicht vom Atom abgetrennt werden können. Im Metall bildet sich deshalb wie bei den Salzen ein Gitter(Bild 1, Kapitel 31), in dem die Gitterplätze von Atomen besetzt sind, die so viele Elektronen abgegeben haben, dass ihre äußere Schale eine stabile Edelgaskonfiguration besitzt. Diese Metall-Ionen, die so genannten "Atomrümpfe", tragen dann - entsprechend der Zahl der abgegebenen Elektronen - eine positive Ladung. Die abgegebenen Außenelektronen können sich innerhalb des Gitters nahezu frei bewegen, da sie nun nicht mehr einem einzelnen Atom zugeordnet sind. Dies führt dazu, dass keine feste Bindung zwischen Atomrümpfen und Elektronen besteht und die Bindung daher ungerichtet ist. Nur die abgegebenen Elektronen bewirken wie ein Kitt den Zusammenhalt der positiv geladenen Metall-Ionen. Wegen der freien Beweglichkeit der Elektronen spricht man vom Elektronengas , das den Raum zwischen den Metall-Ionen ausfüllt.

Die metallische Bindung
Bei dieser Bindungsart - der "metallischen Bindung" - ist die Bindung der Atome durch gemeinsame Elektronenpaare nicht möglich, wie das Beispiel des Lithium-Gitters zeigt: ein Li -Atom ist von 14 Li -Atomen umgeben, jedes Li -Atom besitzt aber nur 3 Elektronen. Die Zahl der von einem Metallatom abgegebenen Elektronen entspricht der Wertigkeit des Metalls. Im Beispiel oben (Bild 3) ist Natrium einwertig und Beryllium zweiwertig.

Im Unterschied zur Ionenbindung werden die von den Metallatomen abgegebenen Elektronen nicht von anderen Atomen aufgenommen. Es können also keine negativ geladenen Ionen entstehen, denn die abgegebenen Elektronen verbleiben als Elektronengas zwischen den einzelnen Metall-Ionen. Eigentlich müssten sich die positiv geladenen Atomrümpfe gegenseitig abstoßen, doch zwischen ihnen halten sich die negativ geladenen Elektronen des Elektronengases auf. Da die Anziehung zwischen den Atomrümpfen und den Elektronen größer ist als die gegenseitige Abstoßung der Atomrümpfe, wirken in Metallen - festen und flüssigen - starke Bindungskräfte. Auch die Elektronen im Elektronengas stoßen sich wegen der gleichartigen Ladung ab. Da sie frei beweglich sind, sich aber gegenseitig ausweichen, verteilen sie sich gleichmäßig im Metallgitter.
Leitfähigkeit und Glanz der Metalle
Man kann sich den elektrischen Strom als ein Fließen (»Strömen«) von Elektronen vorstellen. Für die Leitfähigkeit fester und flüssiger Metalle ist das Elektronengas verantwortlich. Wird an einen Draht eine äußere Spannung angelegt, wandern die frei und regellos beweglichen Elektronen in eine bestimmte Vorzugsrichtung, nämlich hin zum positiven Pol. Mit Anlegen der Spannung geht also das Elektronengas im Metall von einer regellosen in eine gerichtete Bewegung über (Bild 7).
Wird ein Metall stark erhitzt, werden die Bewegungen der Elektronen durch die nun stärkeren Schwingungen der Atome gestört - der elektrische Widerstand des Metalls nimmt zu und die Leitfähigkeit nimmt ab. Im Gegensatz zur sehr schnellen Eigenbewegung der Elektronen ist die gerichtete Fortbewegung der Elektronen im Stromkreis aber sehr langsam. Bei Kupfer liegt der Wert bei ungefähr 0,5 cm pro Sekunde. Allerdings setzen sich alle freien Elektronen gleichzeitig in Bewegung, so dass sich die Wirkung des Elektronenstroms ungefähr mit Lichtgeschwindigkeit fortsetzt. Fließt ein Strom von 1 Ampere durch einen Draht, so bewegen sich pro Sekunde 6,25 Trillionen Elektronen durch den Drahtquerschnitt.

Solange der Strom eingeschaltet ist, werden die abfließenden Elektronen ständig durch neue ersetzt. In Versuch 2 wurde durch Temperaturerhöhung der Elektronenbewegung im Eisendraht - wie oben beschrieben - ein Widerstand entgegengesetzt (beim Erhitzen gerieten die Metall-Ionen in starke Bewegung). Der Widerstand stellte sich dem Elektronenstrom also wie ein Hindernis in den Weg.
Der Metallglanz und die gute Wärmeleitfähigkeit sind weitere typische Eigenschaften der Metalle. Sie hängen ebenfalls mit dem Elektronengas der Metalle zusammen.
Kristallstruktur und Verformbarkeit
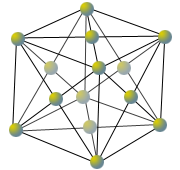
Metalle sind aus gleichen Atomen aufgebaut, daher ist ein Metallgitter einfacher als ein Ionengitter (beispielsweise Kochsalzgitter) aufgebaut. Außerdem weisen Metallgitter eine hohe Symmetrie auf (Bild 9). Da die Gitter der Metalle aus gleichen Bausteinen bestehen, wirken die Bindungskräfte in alle Raumrichtungen gleich, damit gibt es keine bevorzugte Bindung zu einem bestimmten Nachbarn. Deshalb können durch Druck einzelne Bereiche gegeneinander verschoben werden, ohne dass der Atomverband dabei in die Brüche geht. Durch Verschiebungen der Gitterebenen gegeneinander können Metalle also bleibend verformt werden, z. B. durch Walzen, Schmieden, Pressen oder Ziehen.
Die Redoxreihe der Metalle
Manche Metalle geben leichter Elektronen ab, als andere. So gibt Magnesium leichter Elektronen an Wasserstoff-Ionen ab als Zink. Diese Tendenz der Elektronenabgabe gilt ganz allgemein, beispielsweise können Eisenatome an Kupfer-Ionen Elektronen abgeben, die dadurch zu elementarem Kupfer reduziert werden (Versuch 3,Video oben).
Reduktion: $ \ \qquad \mathrm { Cu^{2+} + 2 \ e^{2+} \quad \longrightarrow \quad Cu } $
Oxidation: $ \ \ \qquad \mathrm { Fe \quad \longrightarrow \quad Fe^{2+} \ + \ 2 \ e^{2+} } $
Redoxreaktion: $ \ \ \mathrm { Cu^{2+}_{(aq)} + Fe \longrightarrow \; Cu + Fe^{2+}_{(aq)} } $
Bringt man allerdings Kupfer in Eisensulfatlösung, dann findet keine Reaktion statt und man könnte zu dem Schluß gelangen, dass Kupfer überhaupt nicht in der Lage ist, Elektronen abzugeben. Dem widerspricht aber die Reaktion zwischen Kupfer und Silbernitratlösung, denn auf dem Kupfer scheidet sich elementares Silber ab und das Kupfer geht dabei in Lösung (Versuch 3, Video mitte).
$ \mathrm { 2 \ Ag^{+}_{(aq)} + Cu \xrightarrow{H_{2}O} \; 2 \ Ag \downarrow + Cu^{2+}_{(aq)} } $
Versuch 3 zeigt, dass Metalle ein unterschiedliches Bestreben haben, Elektronen abzugeben oder anders ausgedrückt, in den Ionenzustand überzugehen. Das heißt, dass dementsprechend unterschiedlich auch das Bestreben der Metall-Ionen ist, Elektronen aufzunehmen.
Oxidation
$ \mathrm { Me \qquad \rightleftharpoons \qquad Me^{+} + e^{-} } $
Reduktion
Ordnet man die Metalle nach diesem Verhalten, dann ergibt sich folgende Reihe:
$ \mathrm { K \; Ca \; Al \; Mn \; Zn \; Fe \; Cd \; Co \; Ni \; Sn \; Pb \; { \color{red}[} H {\color{red}]} \; Cu \; Hg \; Ag \; Au } $
In dieser Reihe reduziert jedes einzelne Metall alle rechts von ihm stehenden Elemente aus ihrem Ionenzustand. In diese Reihe ist der Wasserstoff aus folgendem Grund dabei: nur mit Metallen, die links von ihm stehen, kann er aus Säuren abgespalten werden. Sie werden unedle Metalle genannt; rechts davon stehen in dieser Reihe die Edelmetalle.
