23. Energie und Stabilität
Exotherme und endotherme Reaktionen
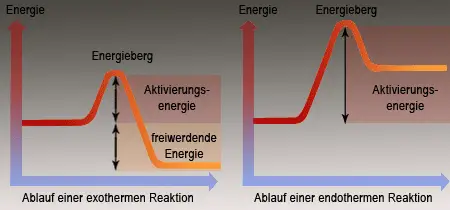
Als exotherm bezeichnet man in der Chemie solche Reaktionen, bei denen von den reagierenden Ausgangsstoffen (Edukten) Energie in Form von Wärme und/oder Licht, kinetischer Energie etc. an die Umgebung abgegeben wird. Diese Energiefreisetzung beruht auf dem Übergang der an der exothermen Reaktion beteiligten Stoffe von einem energiereicheren in einen energieärmeren Zustand. Wenn Stoffe bei einer Reaktion viel Energie abgeben, dann sind sie nicht sehr stabil. Stabil bedeutet im chemischen Sinn, dass ein Stoff kein ausgeprägtes Bestreben hat, sich zu verändern.
Wenn sich die Elemente Sauerstoff und Wasserstoff zu Wasser verbinden, werden pro Mol des entstandenen Wassers 286,6 kJ frei. Die bei der Synthese einer Verbindung aus den Elementen frei werdende oder verbrauchte Energie nennt man Bildungswärme (Enthalpie).
$ \mathrm { 2 \ H_{2}+O_{2} \longrightarrow 2 \ H_{2}O + 286,6 \ kJ } $
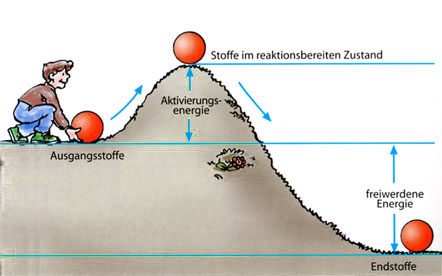
So kann man sich die Aktivierungsenergie anschaulich machen.
Ein Gemisch aus Wasserstoff und Sauerstoff gibt bei der Bildung von Wasser Energie in Form von Wärme ab, Wasser ist somit energieärmer als das Gemisch aus Wasserstoff und Sauerstoff. Dieses Gemisch erscheint stabil, obwohl die Synthese des Wassers aus den Elementen stark exotherm verläuft (Knallgasexplosion). Erst nach der Entzündung des Gasgemisches (Energiezufuhr), startet die Reaktion augenblicklich und verläuft manchmal sogar. Die für den »Reaktionsstart« notwendige Energie bezeichnet man als Aktivierungsenergie. Sie versetzt die Stoffe in einen reaktionsbereiten (»aktiven«) Zustand. Auch die exotherme Synthese von Eisensulfid und Zinksulfid (Kapitel 7) setzt erst nach der »Zündung« ein.
Bilden sich bei einer chemischen Reaktion Produkte, die energiereicher als die Ausgangsstoffe sind, muß zum Ablauf der Reaktion fortlaufend Energie zugeführt werden. Hier spricht man von einer endothermen Reaktion - ein gutes Beispiel dafür ist die Analyse (Zersetzung) von Quecksilberoxid (Kapitel 8).
Die Beschleunigung einer chemischen Reaktion
Wasserstoff und Sauerstoff können also miteinander reagieren, wenn man eine genügend hohe Aktivierungsenergie zuführt. Die Aktivierungsenergie lockert bzw. spaltet die Moleküle der beiden Ausgangstoffe. Im weiteren Verlauf setzt sich die Reaktion selbstständig fort, da die Bildung von Wasser aus seinen Elementen genügend Energie liefert, um weitere Moleküle zu aktivieren. Bei Zimmertemperatur läuft die Reaktion mit kaum meßbarer Geschwindigkeit ab, da die Elemente Sauerstoff und Wasserstoff praktisch nicht miteinander in Reaktion treten. Man sagt, das Gemisch ist »stabil«. Mit Hilfe des Elements Platin kann man jedoch eine Reaktion in Gang bringen, wie sonst nur nach einer Zündung (Versuch 2).
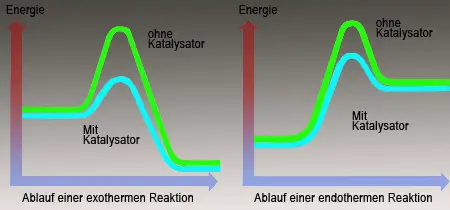
Folglich wird durch das Platin die Aktivierungsenergie herabgesetzt. Das Metall Platin wird bei diesem Phänomen selbst nicht verändert. Solche Stoffe bezeichnet man als Katalysatoren, da sie die Geschwindigkeit, mit der eine chemische Reaktion abläuft beeinflussen und am Ende der Reaktion unverändert bleiben. Bei unzähligen Produktionsverfahren in der technischen Chemie spielen Katalysatoren eine bedeutende Rolle, weil sie sehr langsam verlaufende Prozesse deutlich beschleunigen.
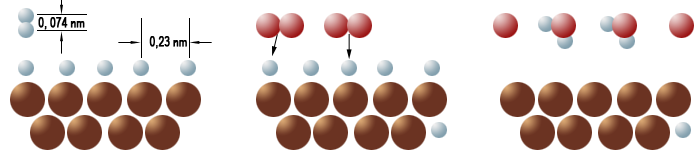
Links:An der Oberfläche des Platins zerbrechen die Wasserstoffmoleküle zu Wasserstoffatomen. Mitte: Sauerstoffmoleküle nähern sich den Wasserstoffatomen. Rechts: Wasserstoff- und Sauerstoffatome haben sich teilweise zu Wassermolekülen verbunden.
Wasserstoffperoxid $ \mathrm { H_{2}O_{2} } $
Wasserstoffperoxid zerfällt in einer exothermen Reaktion sehr leicht in Sauerstoff und Wasser:
$ \mathrm { H_{2}O_{2} \longrightarrow H_{2}O + \frac {1} {2} \ O_{2} \uparrow \ + 93,37 \ kJ/mol } $
Da sich der Sauerstoff sehr leicht abspaltet, ist Wasserstoffperoxid ein starkes Oxidationsmittel. Der Zerfall des Wasserstoffperoxids wird durch Katalysatoren stark beschleunigt. In Versuch 3 zeigt sich die katalytische Wirkung von Braunstein MnO2. Wie Versuch Versuch 4 zeigt, sind in pflanzlichen und tierischen Zellen auch Katalysatoren enthalten, die den Zerfall von Wasserstoffperoxid begünstigen. Diese Katalysatoren nennt man Biokatalysatoren oder Enzyme und spielen eine lebenswichtige Rolle in allen Zellen. Wasserstoffperoxid zerfällt auch unter dem dem Einfluß von Licht sehr leicht und wird deshalb in braunen Flaschen gelagert. Wegen seiner oxidierenden Wirkung findet es als Bleichmittel und als Desinfektionsmittel Verwendung.
Wasserstoffperoxid wirkt stark ätzend, besonders als Dampf. Falls man Wasserstoffperoxid auf die Haut bekommt, sollte man die Stelle mit Wasser gut spülen (Verdünnung), oder zumindest sofort von der Haut entfernen. Dringt es in die Haut ein, so zersetzt es sich dort rasch und die entstehenden Sauerstoffbläschen lassen die Haut weiß erscheinen.