2. Die Gewinnung der Schwefelsäure
Rohstoffe für die Gewinnung der Schwefelsäure
Grundstoff für die Schwefelsäureherstellung ist häufig elementarer Schwefel, der in großen Mengen (2007: 66 Millionen Tonnen) bei der Entschwefelung von Erdgas und Rohöl anfällt und nach dem Claus-Prozess aufgearbeitet wird oder nach dem Frasch-Verfahren abgebaut wird. Dieser wird an der Luft verbrannt, um Schwefeldioxid als Ausgangsstoff für die eigentliche Darstellung zu gewinnen.

Eine weitere Quelle, bei der in großen Mengen Schwefeldioxid anfällt, ist die Verhüttung schwefelhaltiger Erze. Beispiele hierfür sind die Kupfer-, Zink- oder Bleigewinnung aus den entsprechenden Sulfiden. Das Schwefeldioxid bildet sich beim Rösten mit Luftsauerstoff:
$ \mathrm { 2 \ ZnS + 3 \ O_{2} \quad \longrightarrow \quad 2 \ ZnO \; + \; 2 \ SO_{2} } $
Reaktion beim Rösten von Zinksulfid
Im Jahr 1999 wurden in Europa nur noch ca. 3 Mio. Tonnen Schwefelkies (Pyrit, FeS2) zur Schwefelsäuregewinnung geröstet. In Asien liegt der Anteil von Pyrit jedoch höher. Bei der Verarbeitung von Pyrit zu Schwefeldioxid fällt als Rückstand der so genannte Abbrand an.

Für rohstoffarme Staaten, die weder über Schwefel noch über sulfidische Erze verfügen, kommt das Müller-Kühne-Verfahren in Frage. Hierbei wird aus Gips und Kohle im Drehrohrofen Schwefeldioxid gewonnen. Der energieaufwendige Prozess kann rentabler gestaltet werden, wenn durch Zusatz von Sand und Ton als Nebenprodukt Zement anfällt. In der ehemaligen DDR wurde das Verfahren in großem Maßstab durchgeführt.
Für die weitere Produktion muss aus dem Schwefeldioxid Schwefeltrioxid gewonnen werden. Die direkte Reaktion von Schwefel und Sauerstoff zu Schwefeltrioxid findet nicht statt, da das Gleichgewicht in der Reaktion von Schwefeldioxid zu Schwefeltrioxid nur bei niedrigen Temperaturen auf der Seite des Schwefeltrioxids liegt. Bei diesen Temperaturen ist jedoch die Reaktionsgeschwindigkeit zu gering. Daher muss mit Hilfe geeigneter Katalysatoren die Reaktionsführung so gesteuert werden, dass eine ausreichend schnelle Reaktion bei nicht zu hohen Temperaturen gewährleistet ist.
$ \mathrm { 2 \ SO_{2} + O_{2} \quad \rightleftharpoons \quad 2 \ SO_{3} } $
Reaktion von Schwefeldioxid zu Schwefeltrioxid
Das Kontaktverfahren
Beim heutzutage ausschließlich angewendeten Kontaktverfahren wird Vanadiumpentoxid als sauerstoffübertragender Katalysator verwendet. Dabei wird bei der Reaktion von Schwefeldioxid zu Schwefeltrioxid zunächst das Vanadiumpentoxid zu Vanadium(IV)-oxid reduziert. Dieses wird in einem zweiten Reaktionsschritt durch Sauerstoff wieder oxidiert:
$ \mathrm { V_{2}O_{5} + SO_{2} \quad \longrightarrow \quad 2 \ VO_{2} + SO_{3} } $
Umsetzung von Schwefeldioxid zu Schwefeltrioxid
$ \mathrm { 4 \ VO_{2} + O_{2} \quad \longrightarrow \quad 2 \ V_{2}O_{5} } $
Rückgewinnung des Katalysators
Stoffe, die die Katalysatorwirkung unterdrücken
dynamisches Gleichgewicht. Hinreaktion steht mit Rückreaktion im Gleichgewicht
SO2 - Gewinnung, Oxidation SO2 zu SO3 unter Zuhilfenahme von Vanadiumpentoxid, Umsetzen von SO3 zu H2SO4
Die Temperatur während der Reaktion muss zwischen 420 und 620 °C liegen, da bei tieferen Temperaturen der Katalysator inaktiv ist und er sich bei höheren Temperaturen zersetzt. Die Umsetzung wird in sogenannten Hordenkontaktöfen durchgeführt, bei denen der Katalysator in insgesamt vier Schichten (den „Horden“) übereinander angeordnet wird und das durchströmende Gas zwischen den Horden auf die passende Temperatur gekühlt wird.
Im sogenannten Doppelkontaktverfahren wird vor der letzten Horde das vorhandene Schwefeltrioxid mit konzentrierter Schwefelsäure ausgewaschen. Dies ermöglicht eine Erhöhung der Ausbeute auf 99,5 %.
Nach Bildung des Schwefeltrioxids wird dieses zu Schwefelsäure umgesetzt. Dazu muss zunächst verbliebenes Schwefeldioxid mit Ammoniak oder Natriumthiosulfat entfernt werden. Da die direkte Reaktion von Schwefeltrioxid mit Wasser zu langsam ist, wird das Gas in konzentrierte Schwefelsäure geleitet. Dabei bildet sich schnell Dischwefelsäure H2S2O7. Wird diese mit Wasser verdünnt, zerfällt sie zu zwei Molekülen Schwefelsäure:
$ \mathrm { SO_{3} + H_{2}SO_{4} \quad \longrightarrow \quad 2 \ H_{2}S_{3}O_{7} } $
Umsetzung von Schwefeltrioxid mit Schwefelsäure
$ \mathrm { H_{2}S_{3}O_{7} + H_{2}O \quad \longrightarrow \quad 2 \ H_{2}SO_{4} } $
Bildung Schwefelsäure
Bei diesem Verfahren entsteht keine reine Schwefelsäure, sondern konzentrierte Säure mit 98 % Säuregehalt. Um reine Schwefelsäure zu erzeugen, muss die Menge Schwefeltrioxid in die konzentrierte Säure eingeleitet werden, die der Stoffmenge des überschüssigen Wassers der konzentrierten Säure entspricht.
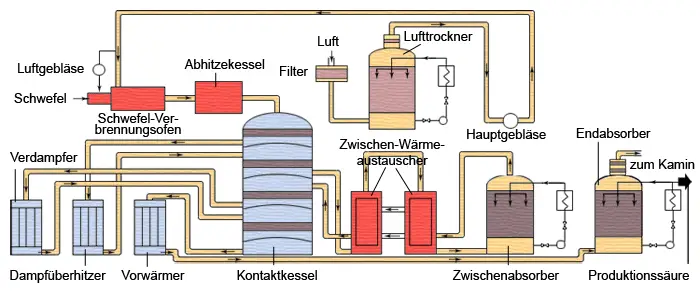
Herstellung von Schwefelsäure aus dem Rohstoff Pyrit
$ \mathrm { \underbrace {4 \ FeS + 11 \ O_{2}}_{Pyrit \ und \ Sauerstoff} \longrightarrow \underbrace {Fe_{2}O_{3} + 8 \ SO_{2}}_{Eisentrioxid \ und \ Schwefeldioxid} + \ 3444 \ kJ} $
Wirtschaftlich wurde Pyrit zur Gewinnung von Schwefelsäure abgebaut, gelegentlich auch zur Eisengewinnung. Der bei der Schwefelsäuregewinnung übrigbleibende Rückstand, das sogenannte Purpurerz (Fe2O3) oder auch Kiesabbrand, wird in Hochöfen zu Eisen verarbeitet. Des Weiteren findet Kiesabbrand auch als Poliermittel und Farbengrundstoff Verwendung. Im Jahr 1999 wurden in Europa nur noch ca. 3 Mio. Tonnen Pyrit zur Schwefelsäuregewinnung geröstet, der größere Anteil Schwefelsäure wird inzwischen aus der Entschwefelung fossiler Brennstoffe und anderer Abgase erhalten.
Modell-Versuch zum Kontaktverfahren
Versuch 3 stellt einen Modellversuch zum Kontaktverfahren dar.
