30. Die Ionenbindung
Die Ionenbindung wurde um 1916 von Walter Kossel formuliert. Sie ist eine ungerichtete Bindung mit großer Reichweite, die in allen Raumrichtungen gleich stark wirkt. Sie ist die vorherrschende Bindungsart bei Salzen, also Verbindungen von Metallen und Nichtmetallen, die periodisch in Gittern angeordnet sind.
Eine Ionenbindung kommt zwischen Elementen zustande, die links im Periodensystem (PSE) stehen (also Metallen), und Elementen, die rechts im PSE stehen (Nichtmetallen). Schaut man sich den Ionenbindungsanteil zum Beispiel von Natriumchlorid an, welches oft als klassischer Fall der Ionenbindung angesehen wird, so stellt man einen Wert von etwa 75 Prozent fest. Ein anderes Beispiel wäre Cäsiumfluorid mit etwa 92 Prozent. Ionenbindungen haben also in allen Fällen auch einen Anteil an kovalenter Bindung. Umgekehrt gilt dies nicht, denn innerhalb sogenannter Elementmoleküle existiert die 100-prozentige kovalente Bindung.
Die Natriumchlorid-Synthese
Erhitzt man Natrium, ein Alkalimetall, und bringt es in eine Chloratmosphäre, dann startet eine chemischen Reaktion, die von einer starken Feuererscheinung begleitet wird. Das Reaktionsprodukt hat nun neue Eigenschaften und wird als Natriumchlorid bezeichnet - unser Speisesalz.
$ \mathrm { 2 \ Na + Cl_{2} \; \longrightarrow \; 2 \ NaCl + 411,58 \ kJ } $
Natrium + Chlor $\longrightarrow$ Natriumchlorid + Wärme
Die Synthese von Natriumchlorid und die Vorgänge in der Atomhülle
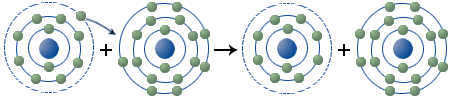
Schaut man sich einmal die Atomhülle der beiden Elemente Chlor und Natrium an, dann sind die Vorgänge bei der Synthese von NaCl besser zu verstehen.
| Hauptschalen: K L M | Hauptschalen: K L M | |||
| Natrium: | Chlor: | |||
Durch die Abgabe des Elektrons in der M-Schale erhält das Natrium die Elektronenanordnung des Edelgases Neon. Hat die Atomhülle den Zustand einer Edelgasschale erreicht, so ist sie sehr stabil. Das Chloratom, das in der M-Schale 7 Elektronen besitzt, erreicht durch die Aufnahme eines weiteren Elektrons die stabile Elektronenanordnung des Edelgases Argon.
Bei der Synthese von Natriumchlorid vollzieht sich genau diese Aufnahme und Abgabe von Elektronen. Aus den elektrisch neutralen Atomen entstehen Teilchen mit einer positiven bzw. negativen elektrischen Ladung. Solche Ladungsträger bezeichnet man als Ionen, die sich aufgrund ihrer Ladung anziehen und dadurch verbunden werden. Man bezeichnet eine solche chemische Bindung als Ionische Bindung (oder Ionenbindung). Die Vorgänge, die sich bei der Synthese von NaCl in der Atomhülle abspielen, kann man nun folgendermaßen darstellen:
| $ \mathrm {Na \; \longrightarrow \; Na^{+} + e^{-} } $ | $\mathrm {Natrium \; \longrightarrow Natriumion + Elektron} $ |
| $ \mathrm { Cl + e^{-} } $ | $ \mathrm { Chlor + Elektron \longrightarrow Chloridion} $ |
$ \mathrm { \ Na \cdotp \; + \; \cdotp {\overset {\Large {\cdotp \ \cdotp }} {\underset {\Large {\cdotp \ \cdotp }} {Cl}}}: \ \longrightarrow \ \biggl[ Na \biggr]^+ \;\; + \;\; \biggl[ :{\overset {\Large {\cdotp \ \cdotp }} {\underset {\Large {\cdotp \ \cdotp }} {Cl}}}: \biggr]^-} $
$ \mathrm { \ Na \;\;\; + \;\; Cl \ \; \longrightarrow \ \;\; {Na}^+ \;\;\;\;\; + \;\;\;\; {Cl}^-} $
Die positive Kernladung wirkt sich infolge der Elektronenabgabe stärker auf die übrigen Elektronen in der Atomhülle aus, wodurch der Radius positiv geladener Ionen kleiner ist als bei den ursprünglichen Atomen. Bei negativ geladenen Ionen ist es umgekehrt - hier ist der Ionenradius größer als bei den urprünglichen Atomen.
Nicht nur Atome, auch Moleküle können durch Elektronenaufnahme bzw. Elektronenabgabe zu Ionen werden. Deshalb unterscheidet man zwischen Atomionen und Molekülionen.
| Ion | Ionen- wertigkeit |
stöchiometr. Wertigkeit |
|
|---|---|---|---|
| Calcium-Ion | Ca2+ | 2+ | 2 |
| Aluminium-Ion | Al3+ | 3+ | 3 |
| Oxid-Ion | O2- | 2- | 2 |
| Sulfid-Ion | S2- | 2- | 2 |
Die Ionenwertigkeit oder Ladungszahl
Die Ladung der Ionen entsteht durch Abgabe oder Aufnahme von Elektronen. Sie wird auch Ionenwertigkeit oder Ladungszahl genannt. Aus einem Atom, das ein Elektron aufnimmt, wird ein einwertig negatives Ion. Entsprechend erhalten wir ein einwertig positives Ion, wenn ein Atom ein Elektron abgibt, da dann die positive Kernladung um ein Proton überwiegt. Die Ionenwertigkeit unterscheidet sich von der stöchiometrischen Wertigkeit des Ions nur durch die positive oder negative Ladung.
Beim Formulieren einer Ionenverbindung gilt, dass die Summe der negativen Ladungen gleich der Summe der positiven Ladung sein muß.
Beispiele:
$ \mathrm { K \; \longrightarrow \; K^+ \ + \ e^-} $
$ \mathrm { KCl \ + \ e^- \; \longrightarrow \; Cl^-} $
$ \mathrm {\underbrace {K \ + \ Cl}_{Kalium \ + \ Chlor} \; \longrightarrow \; \underbrace {KCl}_{Kaliumchlorid} } $
$ \mathrm { Ca \; \longrightarrow \; Ca^{2+} \ + \ 2 e^-} $
$ \mathrm { 2 Cl \ + \ e^- \; \longrightarrow \; 2 Cl^-} $
$ \mathrm {\underbrace {Ca \ + \ Cl_2}_{Calcium \ + \ Clor} \; \longrightarrow \; \underbrace {CaCl_2}_{Calciumchlorid} } $
$ \mathrm { Mg \; \longrightarrow \; Mg^{2+} \ + \ 2 e^-} $
$ \mathrm { O \ + \ 2 e^- \; \longrightarrow \; O^{2-}} $
$ \mathrm {\underbrace {Mg \ + \ O}_{Magnesium \ + \ Sauerstoff} \; \longrightarrow \; \underbrace {MgO}_{Magnesiumoxid} } $
Da es bei der Ionenbindung auf die Abgabe und Aufnahme von Elektronen ankommt, ist sie die typische Bindungsart zwischen Metallen und Nichtmetallen. Verbindungen mit Ionenbindung werden Salze genannt.
- $ \mathrm { KI } $
- $ \mathrm { CaO } $
- $ \mathrm { Na_{2}S } $
- $ \mathrm { Al_{2}O_{3} } $
- $ \mathrm { Mg_{3}N_{2} } $
- $ \mathrm { NaF } $
- $ \mathrm { CF_{4} } $
- $ \mathrm { NH_{3} } $
- $ \mathrm { K_{3} } $
- $ \mathrm { K_{2}O } $
- $ \mathrm { BaCl_{2} } $
- $ \mathrm { SiCl_{4} } $