Neon
| Eigenschaften | |||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemein | |||||||||||||||||||||||||||||||||||||||||||||||||
| Name, Symbol, Ordnungszahl | Neon, Ne, 10 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Serie | Edelgase | ||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppe, Periode, Block | 18, 2, p | ||||||||||||||||||||||||||||||||||||||||||||||||
| Aussehen | Farbloses Gas | ||||||||||||||||||||||||||||||||||||||||||||||||
| CAS-Nummer | 7440-01-9 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Massenanteil an der Erdhülle | 0,005 ppm[1] | ||||||||||||||||||||||||||||||||||||||||||||||||
| Atomar [2] | |||||||||||||||||||||||||||||||||||||||||||||||||
| Atommasse | 20,1797(6)[3] u | ||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalenter Radius | 58 pm | ||||||||||||||||||||||||||||||||||||||||||||||||
| Van-der-Waals-Radius | 154 pm | ||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronenkonfiguration | [He] 2s2 2p6 | ||||||||||||||||||||||||||||||||||||||||||||||||
| 1. Ionisierungsenergie | 2080,7 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||
| 2. Ionisierungsenergie | 3952,3 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||
| 3. Ionisierungsenergie | 6122 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||
| 4. Ionisierungsenergie | 9371 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||
| Physikalisch [2] | |||||||||||||||||||||||||||||||||||||||||||||||||
| Aggregatzustand | gasförmig | ||||||||||||||||||||||||||||||||||||||||||||||||
| Kristallstruktur | kubisch flächenzentriert | ||||||||||||||||||||||||||||||||||||||||||||||||
| Dichte | 0,900 kg · m−3[4] bei 273 K | ||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetismus | diamagnetisch ( = −3,8 · 10−9)[5] | ||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzpunkt | 24,56 K (−248,59 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Siedepunkt | 27,15 K[6] (−246 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Molares Volumen | (fest) 13,23 · 10−6 m3/mol | ||||||||||||||||||||||||||||||||||||||||||||||||
| Verdampfungswärme | 1,9 kJ/mol[6] | ||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzwärme | 0,34 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||
| Schallgeschwindigkeit | 435[7] m/s | ||||||||||||||||||||||||||||||||||||||||||||||||
| Wärmeleitfähigkeit | 0,0491 W/(m · K) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Isotope | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Weitere Isotope siehe Liste der Isotope | |||||||||||||||||||||||||||||||||||||||||||||||||
| NMR-Eigenschaften | |||||||||||||||||||||||||||||||||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||||||||||||||||||||||||||||||||
Neon (griechisch νέος neos „neu“) ist ein chemisches Element mit dem Symbol Ne und der Ordnungszahl 10.
Im Periodensystem steht es in der 8. Hauptgruppe (Gruppe 18) und zählt daher zu den Edelgasen. Wie die anderen Edelgase ist es ein farbloses, äußerst reaktionsträges, einatomiges Gas. In vielen Eigenschaften wie Schmelz- und Siedepunkt oder Dichte steht es zwischen dem leichteren Helium und dem schwereren Argon.
Im Universum gehört Neon zu den häufigsten Elementen, auf der Erde ist es dagegen relativ selten, da wie bei Helium ein großer Teil des Gases in das Weltall entwichen ist. Vorwiegend ist es in der Erdatmosphäre zu finden, nur geringe Mengen sind in Gesteinen eingeschlossen.
Wie Krypton und Xenon wurde auch Neon 1898 von William Ramsay und Morris William Travers durch fraktionierte Destillation von flüssiger Luft entdeckt. Die bekannteste Anwendung sind die Leuchtröhren oder Neonlampen, in denen Neon durch Gasentladungen in einer typischen orangeroten Farbe zum Leuchten angeregt wird.
Geschichte

1894 war von Lord Rayleigh und William Ramsay als erstes Edelgas das Argon entdeckt worden. Ramsay isolierte 1895 auch das zuvor nur aus dem Sonnenspektrum bekannte Helium aus Uranerzen. Aus den Gesetzen des Periodensystems erkannte er, dass es zwischen Helium und Argon ein weiteres Element mit einer Atommasse von etwa 20 u geben müsste.
Er untersuchte daher ab 1896 zunächst verschiedene Minerale und Meteoriten und die von diesen beim Erhitzen oder Lösen abgegebenen Gase. Ramsay und sein Mitarbeiter Morris William Travers waren dabei jedoch nicht erfolgreich, es wurden Helium und seltener Argon gefunden. Auch die Untersuchung heißer Gase aus Cauterets in Frankreich und aus Island brachten keine Ergebnisse.[8]
Schließlich begannen sie, 15 Liter Rohargon, das aus flüssiger Luft isoliert wurde, zu untersuchen und durch Verflüssigen und fraktionierte Destillation zu trennen. Das erste dadurch abgetrennte und am Flammenspektrum nachgewiesene Element war dabei das Krypton, am 13. Juni 1898 gelang schließlich die Isolierung eines leichteren Elementes aus der niedriger siedenden Fraktion des Rohargons. Dieses nannten Ramsay und Travers Neon, nach dem griechischen νέος neos „neu“. Kurze Zeit später konnten sie aus der Krypton enthaltenden Fraktion ein weiteres Element, das Xenon gewinnen.[8]
Die erste Anwendung des neu entdeckten Gases war die 1910 von dem Franzosen Georges Claude entwickelte Neonlampe: In eine Glasröhre gefülltes Neon wird durch hohe Spannungen zum Leuchten angeregt.[9]
Nukleosynthese
Neon, vor allem das Isotop 20Ne, ist ein wichtiges Zwischenprodukt in der Nukleosynthese in Sternen, entsteht aber erst beim Kohlenstoffbrennen. Während des Heliumbrennens bei etwa 200 · 108 K entsteht 20Ne auf Grund des geringen Einfangquerschnitts von 16O für α-Teilchen nicht, lediglich die Isotope 21Ne und 22Ne können aus dem schwereren 18O entstehen. Steigen die Temperatur und die Dichte eines Sterns nach Verbrauch des Heliums deutlich an, so kommt es zum Kohlenstoffbrennen, bei dem zwei Kohlenstoffatome zu einem angeregten Magnesiumisotop 24Mg* fusionieren. Aus diesem bildet sich durch α-Zerfall 20Ne.
Bei weiterem Temperatur- und Druckanstieg kommt es zum Neonbrennen, bei dem 20Ne im α-Zerfall zu 16O reagiert beziehungsweise mit den entstandenen Heliumkernen zu 24Mg fusioniert.
Dieses findet auf Grund der höheren Empfindlichkeit von 20Ne im Vergleich zu 16O gegenüber Gammastrahlung vor den eigentlich zu erwartenden Reaktionen des leichteren Sauerstoffkerns statt. Erst nach Ende des Neonbrennens findet das Sauerstoffbrennen statt, bei dem aus 16O schwerere Elemente wie Silicium, Phosphor und Schwefel gebildet werden.[10][11]
Vorkommen
Neon zählt im Universum zu den häufigsten Elementen, lediglich Wasserstoff, Helium, Sauerstoff, Kohlenstoff und Stickstoff sind häufiger. Auf der Erde ist es dagegen – wie Helium – relativ selten, der Gesamtanteil an der Erdhülle beträgt etwa 0,005 ppm[1]. Der Großteil des Neons befindet sich dabei in der Atmosphäre, mit einem durchschnittlichen Gehalt von 18,18 ppm ist es nach Argon das häufigste Edelgas.[12] Aus der unterschiedlichen Verteilung der leichten und schweren Isotope des Neons auf der Erde und Sonne kann geschlossen werden, dass seit Entstehung der Erde ein Großteil des Neons aus der Atmosphäre entwichen ist und bevorzugt die schwereren Isotope 21Ne und 22Ne zurückgeblieben sind.
In kleinen Mengen kommt Neon auch in Gesteinen der Erde vor. Nachgewiesen wurde es in Granit, Basaltgesteinen, Diamanten und vulkanischen Gasen. Auf Grund verschiedener Isotopenzusammensetzungen wird vermutet, dass dieses Neon drei verschiedene Ursprünge hat: Primordiales Neon, dessen Zusammensetzung derjenigen der Sonne entspricht und das ohne Kontakt zur Atmosphäre in Diamanten oder im Erdmantel eingeschlossen ist; atmosphärisches Neon und durch Spallationsreaktionen mit kosmischer Strahlung entstandenes Neon.[13]
Auf Gasplaneten wie Jupiter kann auf Grund der hohen Gravitation das Neon nicht entweichen, die Isotopenzusammensetzung entspricht daher derjenigen bei der Bildung des Planeten. Wie von der Raumsonde Galileo festgestellt, entspricht das Verhältnis von 20Ne zu 22Ne demjenigen der Sonne, was Rückschlüsse auf die Entstehungsbedingungen, etwa die Temperatur, bei der Bildung der Gasplaneten zulässt.[14]
Gewinnung und Darstellung
Neon lässt sich als Nebenprodukt bei der Luftzerlegung nach dem Linde-Verfahren gewinnen. Nach Abtrennung von Wasser, Kohlenstoffdioxid, Sauerstoff, den bei höheren Temperaturen siedenden Edelgasen und dem Großteil an Stickstoff bleibt ein Gasgemisch zurück, das zu 35 % aus Neon, daneben aus Helium, Wasserstoff und etwa 50 % Stickstoff besteht (jeweils Stoffmengenanteile). Dieses kann auf verschiedene Weisen getrennt werden, so dass am Ende die reinen Gase Neon und Helium gewonnen werden. Eine Möglichkeit ist es, die Gase über Kondensation bei unterschiedlichen Siedepunkten und die Ausnutzung des Joule-Thomson-Effektes zu trennen. Nach Abtrennung des Wasserstoffes über katalytische Reaktion mit zugegebenem Sauerstoff und Entfernung des Wassers wird dabei zunächst bei 30 bar und 66 K der Stickstoff verflüssigt und abgetrennt. Nach der Entfernung des restlichen Stickstoffes durch Adsorption an Silicagel bleibt ein Gasgemisch von etwa 76 % Neon und 24 % Helium zurück. Dieses wird bei Raumtemperatur zunächst auf 180 bar verdichtet und stufenweise auf 50 K abgekühlt. Bei der Expansion auf 25 bar und anschließend auf 1,5 bar kondensiert das Neon, während Helium gasförmig bleibt. Eine genauere Trennung erfolgt danach über eine Kolonne.[15]
Eine Alternative ist die Adsorption. Dazu wird nach der Abtrennung des Stickstoffes das Neon bei 5 bar und 67 K an ein Trägermaterial adsorbiert. Dieses gibt bei 3 bar das Neon wieder ab, so dass es vom Helium getrennt werden kann. Um eine größere Reinheit zu erreichen, wird das Neon zweimal nacheinander adsorbiert.[15]
Eigenschaften
Physikalische Eigenschaften
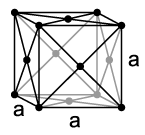

Neon ist ein bei Normalbedingungen einatomiges, farbloses und geruchloses Gas, das bei 27 K (−246 °C) kondensiert und bei 24,57 K (−248,59 °C) erstarrt. Es besitzt damit den kleinsten Temperaturbereich aller Elemente, in dem es flüssig ist. Wie die anderen Edelgase außer dem Helium kristallisiert Neon in einer kubisch dichtesten Kugelpackung mit dem Gitterparameter a = 443 pm.[16]
Wie alle Edelgase besitzt Neon nur abgeschlossene Schalen (Edelgaskonfiguration). Dadurch lässt sich erklären, dass das Gas stets einatomig vorliegt und die Reaktivität gering ist.
Mit einer Dichte von 0,9 kg/m3 bei 0 °C und 1013 hPa ist Neon etwas leichter als Luft, steigt also auf. Im Phasendiagramm liegt der Tripelpunkt bei 24,56 K und 43,37 kPa[17], der kritische Punkt bei 44,4 K, 265,4 kPa sowie einer kritischen Dichte von 0,483 g/cm3.[18]
In Wasser ist Neon schlecht löslich, in einem Liter Wasser können sich bei 20 °C maximal 10,5 ml Neon lösen.[18]
Wie andere Edelgase zeigt Neon bei Gasentladungen ein charakteristisches Linienspektrum. Da die Linien im sichtbaren Spektralbereich vorwiegend im roten bis gelben Bereich sind, erscheint das Gas bei einer Entladung in einer typischen roten Farbe.
Chemische Eigenschaften
Als typisches Edelgas ist Neon äußerst reaktionsträge, es sind wie beim Helium bislang keine Verbindungen des Elementes bekannt. Sogar Clathrate, bei denen andere Edelgase in anderen Verbindungen physikalisch eingeschlossen sind, sind unbekannt. Nach theoretischen Berechnungen ist Neon das am wenigsten reaktive Element. So ist die berechnete Dissoziationsenthalpie für Verbindungen des Typs NgBeO (Ng: Edelgas) bei der Neonverbindung am geringsten. Es zeigte sich, dass selbst das Neonanalogon der einzig bekannten, nach Rechnungen stabilen Heliumverbindung HHeF nicht stabil sein sollte. Mögliche Erklärungen für diese Ergebnisse sind die größeren Fluor-Wasserstoff-Abstände und damit schwächere Anziehungskräfte im HNe+-Ion im Vergleich zur Helium-Spezies oder abstoßende p-π-Wechselwirkungen in Neon-Kationen.[19]
Es sind lediglich aus massenspektrometrischen Untersuchungen einige Ionen bekannt, in denen Neon beteiligt ist. Zu diesen zählen das Ne+-Ion und einige Element-Neon-Ionen wie ArNe+, HeNe+ und HNe+.[20]
Isotope
Es sind insgesamt 18 Isotope des Neons zwischen 16Ne und 34Ne bekannt. Von diesen sind drei, 20Ne, 21Ne und 22Ne stabil und kommen auch in der Natur vor. 20Ne kommt mit 90,48 % Anteil mit Abstand am häufigsten vor. 21Ne ist mit 0,27 % Anteil auf der Erde am seltensten und 22Ne kommt mit einer Häufigkeit von 9,25 % in der natürlichen Isotopenverteilung auf der Erde vor. Alle anderen Isotope haben kurze Halbwertszeiten von maximal 3,38 Minuten bei 24Ne.[21]
Bedingt durch den Verlust von Neon in das Weltall und die Bildung in Kernreaktionen ist das Verhältnis von 20Ne/22Ne und 21Ne/22Ne von Neon, das in Gesteinen eingeschlossen ist und keinen Kontakt zur Atmosphäre besitzt, nicht immer gleich. Daher lassen sich aus den Isotopenverhältnissen Rückschlüsse auf die Entstehung schließen. So ist in Gesteinen, in denen Neon durch Spallationsreaktionen entstanden ist, der Gehalt an 21Ne erhöht. Primordiales Neon, das vor dem Verlust eines großen Teils des Neons in Gesteinen und Diamanten eingeschlossen wurde, besitzt dagegen einen höheren Anteil an 20Ne.[13]
Biologische Bedeutung
Wie die anderen Edelgase hat Neon auf Grund der Reaktionsträgheit keine biologische Bedeutung und ist auch nicht toxisch. In höheren Konzentrationen wirkt es durch Verdrängung des Sauerstoffs erstickend.[22] Bei Drücken von mehr als 110 bar wirkt es narkotisierend.[23]
Verwendung


Auf Grund der Seltenheit und komplizierten Herstellung und dem damit einhergehenden höheren Preis im Vergleich zum ähnlichen Argon wird Neon nur in kleineren Mengen verwendet. Neon ist Füllgas von Leuchtröhren und Glimmlampen, in denen es durch Gasentladungen zum Leuchten in einer typischen orangeroten Farbe angeregt wird. Auch in Blitz- und Stroboskoplampen wird Neon als Füllgas genutzt.[18]
Helium-Neon-Laser, in denen ein Gemisch an Helium und Neon eingesetzt wird, zählen zu den wichtigeren Lasern. Die notwendige Besetzungsinversion des Laser wird dabei durch die Anregung des Heliums und strahlungslosen Übergang von Elektronen zum Neon erreicht. Die stimulierte Emission erfolgt am Neon bei Wellenlängen von 632,8 nm (rot) sowie 1152,3 nm und 3391 nm (infrarot). Weitere Laserübergänge, etwa im grünen Spektralbereich bei 543,3 nm sind möglich.[24]
Flüssiges Neon kann als Kältemittel eingesetzt werden. Im Vergleich zu Helium und Wasserstoff hat es den Vorteil einer 40 mal höheren Kühlleistung als flüssiges Helium und dreimal höhere als Wasserstoff.[15]
Neon kann im Gemisch mit Sauerstoff als Atemgas für das Tauchen in großer Tiefe genutzt werden. Es wird jedoch nur selten eingesetzt, da es im Vergleich zum ähnlich verwendbaren Helium einen höheren Preis besitzt und auch einen größeren Atemwiderstand aufweist.[25][26]
Einzelnachweise
- ↑ 1,0 1,1 Harry H. Binder: Lexikon der chemischen Elemente, S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3.
- ↑ Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Neon) entnommen.
- ↑ Michael E. Wieser und Tyler B. Coplen: Atomic weights of the elements (IUPAC Technical Report) In: Pure and Applied Chemistry Vol. 83, No. 2, 2011, S. 359–396.
- ↑ 4,0 4,1 4,2 Eintrag zu Neon in der GESTIS-Stoffdatenbank des IFA, abgerufen am 12. März 2011 (JavaScript erforderlich).
- ↑ Weast, Robert C. (ed. in chief): CRC Handbook of Chemistry and Physics. CRC (Chemical Rubber Publishing Company), Boca Raton 1990. Seiten E-129 bis E-145. ISBN 0-8493-0470-9. Werte dort sind auf g/mol bezogen und in cgs-Einheiten angegeben. Der hier angegebene Wert ist der daraus berechnete maßeinheitslose SI-Wert.
- ↑ 6,0 6,1 Yiming Zhang, Julian R. G. Evans, Shoufeng Yang: Corrected Values for Boiling Points and Enthalpies of Vaporization of Elements in Handbooks. In: Journal of Chemical & Engineering Data. 56, 2011, S. 328–337, doi:10.1021/je1011086.
- ↑ CRC Handbook of Chemistry and Physics, 90. Auflage, CRC Press, Boca Raton, Florida, 2009, ISBN 978-1-4200-9084-0, p. 14-49: bei 0 °C.
- ↑ 8,0 8,1 William Ramsay: The Rare Gases of the Atmosphere. Nobelpreisrede, 12. Dezember 1904.
- ↑ Patentanmeldung US1125476 System of illuminating by luminescent tubes. Angemeldet am 8. Oktober 1911, veröffentlicht am 19. Januar 1915, Anmelder: Georges Claude.
- ↑ L. R. Buchmann, C. A. Barnes: Nuclear reactions in stellar helium burning and later hydrostatic burning stages. In: Nuclear Physics A. 2006, 777, S. 254–290, doi:10.1016/j.nuclphysa.2005.01.005.
- ↑ S. E. Woosley, A. Heger: The evolution and explosion of massive stars. In: Rev. Mod. Phys. 2002, 74, S. 1015–1071, doi:10.1103/RevModPhys.74.1015.
- ↑ David R. Williams: Earth Fact Sheet. NASA, Greenbelt, Stand 20. Mai 2009.
- ↑ 13,0 13,1 Alan P. Dickin: Radiogenic isotope geology. 2. Auflage, Cambridge University Press, 2005, ISBN 978-0-521-82316-6, S. 303–307.
- ↑ P. R. Mahaffy, H. B. Niemann, A. Alpert, S. K. Atreya, J. Demick, T. M. Donahue, D. N. Harpold, T. C. Owen: Noble gas abundance and isotope ratios in the atmosphere of Jupiter from the Galileo Probe Mass Spectrometer. In: J. Geophys. Res. 2000, 105, S. 15061–15071 (Abstract).
- ↑ 15,0 15,1 15,2 P. Häussinger, R. Glatthaar, W. Rhode, H. Kick, C. Benkmann, J. Weber, H.-J. Wunschel, V. Stenke, E. Leicht, H. Stenger: Noble Gases. In: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2006, doi:10.1002/14356007.a17_485.
- ↑ K. Schubert: Ein Modell für die Kristallstrukturen der chemischen Elemente. In: Acta Crystallographica. 1974, 30, S. 193–204.
- ↑ J. Ancsin: Vapor Pressure and Triple Point of Neon and the Influence of Impurities on these Properties. In: Metrologica. 1978, 4, 1, S. 1 (NIST webbook).
- ↑ 18,0 18,1 18,2 Helmut Sitzmann: Neon. In: Römpp Chemie-Lexikon. Thieme Verlag, Stand Dezember 2006.
- ↑ Errol G. Lewars: Modeling Marvels: Computational Anticipation of Novel Molecules. Springer Verlag, 2008, ISBN 978-1-4020-6972-7, S. 69–80.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics: a ready-reference book of chemical and physical data – 4. The Elements. 90. Auflage, CRC Press, 2009, ISBN 978-1-4200-9084-0, S. 4-23.
- ↑ G. Audi, O. Bersillon, J. Blachot, A. H. Wapstra: The NUBASE evaluation of nuclear and decay properties. In: Nuclear Physics. 2003, Bd. A 729, S. 3–128.
- ↑ Sicherheitsdatenblatt (Neon), Linde AG, Stand 4. August 2006.
- ↑ Walter J. Moore, Dieter O. Hummel: Physikalische Chemie. 4. Auflage, de Gruyter, 1986, ISBN 978-3-11-010979-5, S. 284.
- ↑ Helium-Neon-Laser. In: Römpp Chemie-Lexikon, Thieme Verlag, Stand März 2002.
- ↑ Alfred A. Bove, Jefferson Carroll Davis: Bove and Davis' diving medicine. 4. Auflage, Elsevier, 2004, ISBN 978-0-7216-9424-5, S. 121.
- ↑ Patent US3815591: Diving gas mixtures and methods of deep diving. Veröffentlicht am 28. April 1972, Anmelder: Union Carbide Co., Erfinder: Heinz Schreiner, Robert Hamilton, Arthur Francis.
Literatur
- P. Häussinger, R. Glatthaar, W. Rhode, H. Kick, C. Benkmann, J. Weber, H.-J. Wunschel, V. Stenke, E. Leicht, H. Stenger: Noble Gases. In: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2006 (doi:10.1002/14356007.a17_485).
- Helmut Sitzmann: Neon. In: Römpp Chemie Lexikon. Thieme Verlag, Stand Dezember 2006.
- Arnold F. Holleman, Nils Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage, de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 417–429.
Weblinks
| Alkalimetalle | Erdalkalimetalle | Lanthanoide | Actinoide | Übergangsmetalle | Metalle | Halbmetalle | Nichtmetalle | Halogene | Edelgase | unbekannt |
| Dieser Artikel wurde am 31. Januar 2010 in dieser Version in die Liste der lesenswerten Artikel aufgenommen. |