Edelgase
|
Lage im Periodensystem
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppe | 18 |
| Hauptgruppe | 8 |
| Periode | |
| 1 | 2 He |
| 2 | 10 Ne |
| 3 | 18 Ar |
| 4 | 36 Kr |
| 5 | 54 Xe |
| 6 | 86 Rn |
| 7 | 118 Uuo |
Die Edelgase bilden eine Gruppe im Periodensystem der Elemente, die insgesamt sieben Elemente umfasst: Helium, Neon, Argon, Krypton, Xenon, das radioaktive Radon sowie das künstlich erzeugte, ebenfalls radioaktive Ununoctium. Die Gruppe wird systematisch auch 8. Hauptgruppe oder nach der neueren Einteilung des Periodensystems Gruppe 18 genannt und am rechten Rand des Periodensystems neben den Halogenen dargestellt.
Edelgase besitzen im Vergleich zu anderen Gruppen untereinander relativ einheitliche Eigenschaften. Sie sind einatomige, unreaktive Gase. Diese Eigenschaften ergeben sich aus ihrem Aufbau: Jedes Edelgasatom besitzt nur vollständig gefüllte Orbitale (Edelgaskonfiguration). Ihrer geringen Reaktivität verdanken sie auch den Gruppennamen, der sich an die ebenfalls nur wenig reaktiven Edelmetalle anlehnt.
Als Gase sind sie Bestandteile der Luft; in der Erde findet man sie mit Ausnahme des Heliums, das in Erdgas gefunden wird, nur in sehr geringen Mengen. Argon ist das mit Abstand häufigste Edelgas; die anderen Edelgase zählen zu den seltenen Bestandteilen der Erde. Entdeckt wurden sie – mit Ausnahme des erst 2006 hergestellten Ununoctiums – kurz nacheinander in den Jahren 1868 (Helium) bis 1900 (Radon). Die meisten Edelgase wurden erstmals vom britischen Chemiker William Ramsay isoliert.
Verwendung finden Edelgase vor allem als Schutzgas und als Füllgas von Lampen, insbesondere Gasentladungslampen, in denen sie in der für jedes Gas charakteristischen Farbe leuchten. Trotz der geringen Reaktivität sind von den schwereren Edelgasen, insbesondere Xenon, chemische Verbindungen bekannt. Deren wichtigste ist das starke Oxidationsmittel Xenon(II)-fluorid.
Geschichte

Einen ersten Hinweis, dass in der Luft ein unreaktives Gas enthalten ist, fand 1783 Henry Cavendish. Er mischte Luft und Sauerstoff derart, dass die darin enthaltenen Elemente Stickstoff und Sauerstoff mit Hilfe von Reibungselektrizität komplett zu Stickoxiden reagierten. Dabei blieb ein nicht reagierender Rest zurück. Er erkannte jedoch nicht, dass es sich dabei um ein neues Gas - eine Mischung aus Argon und anderer Edelgase - handelte, und setzte seine Experimente nicht fort.[1]
Als erstes Edelgas entdeckten 1868 Jules Janssen und Norman Lockyer das Helium unabhängig voneinander. Die beiden Astronomen beobachteten – Janssen in Indien, Lockyer in England – das Sonnenspektrum und entdeckten darin eine bislang unbekannte gelbe Spektrallinie bei einer Wellenlänge von 587,49 nm.[2] Das neue Element wurde von Edward Frankland nach griechisch ἥλιος hélios für die Sonne Helium genannt. Der erste Nachweis von Helium auf der Erde gelang 1892 Luigi Palmieri durch Spektralanalyse von Vesuv-Lava.[3]
Cavendishs Experimente zur Untersuchung der Luft wurden ab 1888 von Lord Rayleigh fortgesetzt. Er bemerkte, dass „Stickstoff”, der aus der Luft gewonnen wurde, eine andere Dichte besitzt als aus der Zersetzung von Ammoniak gewonnener. Rayleigh vermutete daher, dass es einen noch unbekannten, reaktionsträgen Bestandteil der Luft geben müsse. Daher versuchten er und William Ramsay, durch Reaktion mit Magnesium den Stickstoff aus einer Luftprobe vollständig zu entfernen und dieses unbekannte Gas zu isolieren. Schließlich gelang ihnen 1894 spektroskopisch der Nachweis eines neues Elementes, das sie nach dem griechischen ἀργός, argos, „träge“ Argon benannten.[1]
Nachdem die wichtigsten Eigenschaften von Helium und Argon bestimmt worden waren, konnte festgestellt werden, dass diese Gase im Gegensatz zu den anderen atmosphärischen Gasen einatomig sind. Dies wurde dadurch erkannt, dass das Verhältnis der molaren Wärmekapazität Cp bei konstantem Druck im Verhältnis zur Wärmekapazität CV bei konstantem Volumen bei Edelgasen einen sehr hohen Wert von 1,67 ( = Cp/CV) aufweist, während zwei- und mehratomige Gase deutlich kleinere Werte aufweisen.[4] Daraufhin vermutete William Ramsay, dass es eine ganze Gruppe derartiger Gase geben müsse, die eine eigene Gruppe im Periodensystem bilden und er begann nach diesen zu suchen. 1898 gelang es ihm und Morris William Travers, durch fraktionierte Destillation von Luft, Neon, Krypton und Xenon zu isolieren.[1]
Als letztes der natürlich vorkommenden Edelgase wurde 1900 von Friedrich Ernst Dorn als Radium-Emanation (Ausdünstung von Radium) das Radon entdeckt und mit dem Symbol Em bezeichnet. Dabei handelte es sich um das Isotop 222Rn. Weitere Radon-Isotope wurden von Ernest Rutherford und André-Louis Debierne gefunden und zunächst für eigene Elemente gehalten. Erst nachdem William Ramsay 1910 das Spektrum und weitere Eigenschaften bestimmte, erkannte er, dass es sich um ein einziges Element handelt. Er nannte dies zunächst Niton (Nt), seit 1934 wird der Name Radon verwendet.[5] Ununoctium, das letzte Element der Gruppe, konnte nach mehreren nicht erfolgreichen Versuchen erstmals 2002–2005 am Vereinigten Institut für Kernforschung in Dubna erzeugt werden.[6]
Es wurden schon bald nach der Entdeckung Versuche unternommen, Verbindungen der Edelgase zu synthetisieren. 1894 versuchte Henri Moissan, eine Reaktion von Argon mit Fluor zu erreichen, scheiterte jedoch.[1] Im Jahr 1924 behauptete A. von Antropoff, eine erste Kryptonverbindung in Form eines roten stabilen Feststoffes aus Krypton und Chlor synthetisiert zu haben. Später stellte sich jedoch heraus, dass in dieser Verbindung kein Krypton, sondern Stickstoffmonoxid und Chlorwasserstoff enthalten waren.[7]
Mit Xenonhexafluoroplatinat wurde 1962 durch Neil Bartlett erstmals eine Xenonverbindung und damit die erste Edelgasverbindung überhaupt entdeckt.[8] Nur wenige Monate nach dieser Entdeckung folgten im August 1962 nahezu zeitgleich die Synthese des Xenon(II)-fluorids durch Rudolf Hoppe und die des Xenon(IV)-fluorids durch eine Gruppe um die amerikanischen Chemiker C. L. Chernick und H. H. Claassen.[9] Bald darauf konnte durch A. V. Grosse die erste Kryptonverbindung dargestellt werden, die er zunächst für Kryptontetrafluorid hielt, die jedoch nach weiteren Versuchen als Kryptondifluorid identifiziert wurde.[7] Im Jahr 2000 wurde die erste Argonverbindung, das sehr instabile Argonfluorohydrid synthetisiert.[10]
Vorkommen
| Element | Sonnensystem[11] (Atome rel. zu Si (Si = 1 · 106)) |
Erdatmosphäre[12] (Volumen, ppm) |
Erdkruste[13] (Masse, ppm) |
|---|---|---|---|
| He | 2,21 · 109 | 5,24 | 0,008 |
| Ne | 3,44 · 106 | 18,18 | 0,005 |
| Ar | 1,172 · 105 | 9340 | 3,5 |
| Kr | 46,8 | 1,14 | 0,0001 |
| Xe | 5,38 | 0,09[14] | 3 · 10−5 |
| Rn | 0,06…18 · 10−19[14] | 4 · 10−13 |
Als Gase kommen die Edelgase vorwiegend in der Erdatmosphäre vor; in geringem Maße findet man sie aber auch in der Erdkruste, ihre Häufigkeiten sind jedoch sehr unterschiedlich. Das mit Abstand häufigste ist Argon, das mit einem Volumenanteil von 0,934 % (9340 ppm) einen nennenswerten Anteil der gesamten Atmosphäre ausmacht. Alle anderen sind mit Anteilen unter 20 ppm sehr viel seltener, sie zählen daher zu den Spurengasen. Krypton, Xenon und Radon zählen zu den seltensten Elementen auf der Erde überhaupt.[12]
Die unterschiedlichen Häufigkeiten hängen damit zusammen, dass Edelgase auf Grund ihrer geringen Reaktivität nicht über längere Zeit in der Atmosphäre gehalten werden, sondern in den Weltraum entweichen. Daher bestimmen die Möglichkeiten, mit denen Edelgase auf der Erde neu gebildet werden, maßgeblich die Häufigkeiten und auch die Isotopenverhältnisse der Gase. Argon, vor allem das Isotop 40Ar, wird dabei in größeren Mengen durch Zerfall des Kaliumisotops 40K gebildet. Helium entsteht beim Alpha-Zerfall von schweren Elementen wie Uran oder Thorium (Alpha-Teilchen), Xenon beim seltenen Spontanzerfall von Uran. Radon ist kurzlebig: Das Isotop 222Rn mit einer Halbwertszeit von 3,8 Tagen ist das häufigste und ein Zwischenprodukt in der Zerfallsreihe von 238U. Andere, noch kurzlebigere Isotope sind ebenfalls Mitglieder der Zerfallsreihen von Uran-, Thorium- oder Neptuniumisotopen. Auf Grund dieser Zerfallsprozesse findet man die Edelgase auch in Gesteinen eingeschlossen. So wird Argon im Basalt der ozeanischen Kruste gefunden, da es beim Schmelzen aus dem umgebenden Gestein ausgast.[15] Helium findet sich in vielen Uranerzen wie Uraninit, vor allem aber im Erdgas, an dem es einen Anteil von bis zu 16 % am Volumen haben kann.[16]
Die Häufigkeitsverteilung der Edelgase im Universum lässt sich großteils durch die Nukleosynthesewege erklären. Je schwerer ein Edelgas, desto seltener ist es. Helium, das sowohl durch primordiale Nukleosynthese gebildet wird, als auch durch stellare Nukleosynthese aus Wasserstoff entsteht, ist dabei nach Wasserstoff das zweithäufigste Element überhaupt. Auch Neon und Argon zählen zu den häufigsten Elementen im Universum. Krypton und Xenon, die nicht durch stellare Nukleosynthese entstehen und sich nur in seltenen Ereignissen wie Supernovae bilden, sind deutlich seltener. Bedingt durch ihren regelmäßigen Aufbau mit gerader Protonenzahl sind Edelgase gemäß der Harkinsschen Regel häufiger als viele ähnlich schwere Elemente.
Gewinnung
Mit Ausnahme eines Großteils des Heliums und der radioaktiven Elemente erfolgt die Gewinnung der Edelgase ausschließlich aus der Luft. Sie fallen als Nebenprodukte bei der Gewinnung von Stickstoff und Sauerstoff im Linde-Verfahren an. In der Haupt-Rektifikationskolonne, in der Sauerstoff und Stickstoff getrennt werden, reichern sich die verschiedenen Edelgase an unterschiedlichen Stellen an. Sie können aber in eine eigene Kolonne überführt und dort von allen anderen Gasen getrennt werden. Während Argon leicht abgetrennt werden kann und nur von Stickstoff und Sauerstoff befreit werden muss, besteht bei Helium und Neon, aber auch bei Krypton und Xenon das Problem, dass diese sich zunächst zusammen anreichern und anschließend getrennt werden müssen. Dies kann über eine weitere Rektifikationskolonne oder auch durch unterschiedliche Adsorption der Gase an geeigneten Speichermedien erfolgen.[14]
Helium kann außer aus der Luft auch aus Erdgas gewonnen werden. Dieses ist, vor allem in den Vereinigten Staaten, die wichtigste Helium-Quelle. Von den anderen Bestandteilen des Erdgases kann es als Rohhelium entweder durch Ausfrieren aller anderen Gase oder durch Permeation an geeigneten Membranen getrennt werden. Anschließend muss das Helium noch durch Druckwechsel-Adsorption, chemische oder kryotechnische Verfahren von restlichen störenden Gasen wie Stickstoff oder Wasserstoff befreit werden.[14]
Radon lässt sich auf Grund der kurzen Halbwertszeit nicht in größeren Mengen gewinnen. In kleinerem Maßstab dient Radium als Quelle, Radon entsteht beim Zerfall dieses Elements und gast aus einem entsprechenden Präparat aus.[5] Ununoctium konnte als künstliches Element in wenigen Atomen durch Beschuss von Californium mit Calcium-Atomen erzeugt werden.[6]
Eigenschaften
Physikalische Eigenschaften
Alle Edelgase sind unter Normalbedingungen einatomige, farb- und geruchslose Gase. Sie kondensieren und erstarren erst bei sehr niedrigen Temperaturen, wobei die Schmelz- und Siedepunkte umso höher liegen, je größer die Atommasse ist. Der Siedepunkt des Heliums liegt mit 4,224 K (−268,926 °C) nur knapp über dem absoluten Nullpunkt, das schwerste Edelgas Radon siedet bei 211,9 K (−61,25 °C).
Helium besitzt die Besonderheit, dass es als einziges Element unter Atmosphärendruck und auch deutlich darüber nicht erstarrt. Stattdessen geht es bei 2,17 K in einen speziellen Aggregatzustand, die Suprafluidität, über. In diesem verliert die Flüssigkeit die innere Reibung und kann so beispielsweise über höhere Gefäßwände kriechen (Onnes-Effekt). Erst bei Drücken über 25,316 bar erstarrt Helium bei 0,775 K. Diese Temperaturen und Drücke sind nur für das häufige Isotop 4He gültig, das seltene zweite stabile Isotop 3He hat dagegen deutlich andere Eigenschaften. Es wird erst bei Temperaturen unter 2,6 · 10−3 K suprafluid. Auch Schmelz-, Siede- und kritischer Punkt liegen bei anderen Temperaturen und Drücken.
Mit Ausnahme des Heliums, das im hexagonalen Kristallsystem kristallisiert, besitzen alle Edelgase eine kubisch-flächenzentrierte Kristallstruktur. Wie durch die steigenden Atomradien zu erwarten, wird der Gitterparameter a von Neon zu Radon immer größer.
Auch die Dichten der Edelgase korrelieren wie zu erwarten mit der Atommasse. Helium ist nach Wasserstoff das Gas mit der geringsten Dichte. Als einziges weiteres Edelgas hat Neon eine geringere Dichte als Luft, während Argon, Krypton, Xenon und Radon dichter sind. Radon ist mit einer Dichte von 9,73 kg/m3 eines der dichtesten Gase überhaupt.
| Element | Helium (3He und 4He) | Neon | Argon | Krypton | Xenon | Radon | |
|---|---|---|---|---|---|---|---|
| Farbe Gasentladung |  |
 |
 |
 |
 |
Rot[17] | |
| Schmelzpunkt (1013 hPa)[14] | 0,319 K (−272,831 °C) (29,315 bar) |
0,775 K (−272,375 °C) (25,316 bar) |
24,57 K (−248,58 °C) |
84,0 K (−189,2 °C) |
116,2 K (−157,0 °C) |
161,4 K (−111,8 °C) |
ca. 202 K (ca. −71 °C) |
| Siedepunkt (1013 hPa)[14] | 3,1905 K (−269,9595 °C) |
4,224 K (−268,926 °C) |
27,09 K (−246,06 °C) |
87,295 K (−185,855 °C) |
119,79 K (−153,36 °C) |
165,03 K (−108,12 °C) |
211,9 K[18] (−61,3 °C) |
| Kritischer Punkt[14] |
|
|
|
|
|
|
|
| Tripelpunkt[14] | nicht vorhanden |
|
|
|
|
||
| Dichte (0 °C, 1013 hPa)[14] | 0,13448 kg/m3 | 0,17847 kg/m3 | 0,9000 kg/m3 | 1,7839 kg/m3 | 3,7493 kg/m3 | 5,8971 kg/m3 | 9,73 kg/m3 |
| Struktur | 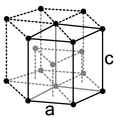 |
 |
 |
 |
 |

| |
| Kristallsystem | hexagonal | kubisch | kubisch | kubisch | kubisch | kubisch | |
| Gitterparameter[19] |
|
a = 4,43 Å |
a = 5,26 Å |
a = 5,72 Å |
a = 6,20 Å |
a = 6,55 Å (berechnet)[20] | |
Die Eigenschaften des Ununoctiums sind auf Grund der kurzen Halbwertszeit nicht experimentell ermittelbar. Nach theoretischen Überlegungen ist durch relativistische Effekte und die hohe Polarisierbarkeit des Ununoctium-Atoms anzunehmen, dass Ununoctium deutlich reaktiver ist als Radon. Auch ist es unwahrscheinlich, dass es bei Standardbedingungen gasförmig ist, durch Extrapolation kann ein Siedepunkt zwischen 320 und 380 K angenommen werden.[21]
Atomare Eigenschaften
Bei Edelgasen sind alle Elektronenschalen entweder vollständig mit Elektronen besetzt oder leer. Deshalb wird dieser Zustand auch Edelgaskonfiguration genannt. Helium ist dabei das einzige Edelgas, bei dem lediglich ein s-Orbital vollständig besetzt ist (da es kein 1p-Orbital gibt), bei allen anderen ist das äußerste besetze Orbital ein p-Orbital. Nach den Gesetzen der Quantenmechanik ist dieser Zustand der Orbitale energetisch besonders günstig. Darum tendieren auch Atome anderer Elemente dazu, Edelgaskonfiguration zu erreichen, indem sie Elektronen abgeben oder aufnehmen (Edelgasregel).
Die Eigenschaften der Edelgase sind deutlich davon bestimmt, dass sie Edelgaskonfiguration nicht durch Abgabe oder Aufnahme von Elektronen, sondern bereits im neutralen, nicht-ionisierten Zustand erreichen. Edelgase liegen daher einatomig vor, besitzen eine hohe Ionisierungsenergie und reagieren fast nicht mit anderen Elementen oder Verbindungen.
Chemische Eigenschaften
Trotz des Aufbaus der Edelgasatome sind die schweren Edelgase nicht völlig unreaktiv und können einige Verbindungen bilden. Verantwortlich hierfür sind der größere Abstand der Valenzelektronen vom Kern, wodurch die Ionisierungsenergie sinkt, sowie relativistische Effekte. Die größte Vielfalt an Verbindungen ist vom Xenon und nicht wie zu erwarten vom Radon bekannt, da bei diesem die starke Radioaktivität und kurze Halbwertszeit die Bildung von Verbindungen und deren Untersuchung erschwert.
Das einzige Element, das in der Lage ist, direkt mit Xenon, Radon und unter bestimmten Bedingungen auch Krypton zu reagieren, ist Fluor. Während das bei der Reaktion von Krypton und Fluor gebildete Krypton(II)-fluorid thermodynamisch instabil und daher nur bei tiefen Temperaturen synthetisierbar ist, sind die Xenon- und auch Radonfluoride auch bei Raumtemperatur stabil. Andere Elemente reagieren nicht mit Edelgasen, dennoch sind verschiedene weitere Verbindungen bekannt, die durch Reaktionen der Fluoride zugänglich sind.
Die Reaktivität und Stabilität von Verbindungen der leichten Edelgase Helium, Neon und Argon konnte mit Ausnahme einer bekannten Argonverbindung, HArF, nur theoretisch untersucht werden. Demnach gilt Neon als das am wenigsten reaktive Edelgas. So zeigte sich in Rechnungen, dass das Neonanalogon der einzigen in der Theorie stabilen Heliumverbindung HHeF nicht stabil sein sollte.[22]
Aufgrund des Fehlens chemischer Verbindungen der Edelgase gab es lange Zeit auch keine Zahlenwerte ihrer Elektronegativitäten – bestimmt werden konnten davon bis jetzt nur die Werte der Pauling-Skala für die beiden Elemente Xenon (2,6) und Krypton (3,0), die damit in etwa denen der Halogene entsprechen. In den neueren Elektronegativitätsskalen nach Mulliken und Allred und Rochow dagegen lassen sich auch Zahlenwerte für die übrigen Edelgase berechnen, die in diesem Fall über die der Halogene hinausreichen. Bei Helium betragen sie beispielsweise 5,50 nach Allred-Rochow und 4,86 nach Mullikan.[23]
Verwendung


Edelgase werden auf Grund ihrer geringen Reaktivität, der niedrigen Schmelzpunkte und der charakteristischen Farben bei Gasentladungen genutzt. Vor allem Argon und Helium werden in größerem Maßstab verwendet, die anderen Edelgase können nur in geringeren Mengen produziert werden und sind daher teuer. Die geringe Reaktivität wird in der Verwendung als Inert- bzw. Schutzgas beispielsweise beim Schutzgasschweißen und in der Produktion von bestimmten Metallen wie Titan oder Tantal ausgenutzt. Dafür wird vorwiegend das Argon immer dann eingesetzt, wenn der billigere, aber reaktivere Stickstoff nicht verwendet werden kann.
Bei Gasentladungen gibt jedes Edelgas Licht einer charakteristischen Farbe ab. Bei Neon beispielsweise ist das emittierte Licht rot, bei Argon violett und bei Krypton oder Xenon blau. Dies wird in Gasentladungslampen ausgenutzt. Von besonderer Bedeutung ist dabei das Xenon, da das Spektrum einer Xenon-Gasentladungslampe annähernd dem des Tageslichtes entspricht. Es wird darum auch in Autoscheinwerfern als „Xenonlicht“ verwendet.[24] Auch Leuchtröhren basieren auf diesem Prinzip, nach dem ersten verwendeten Leuchtgas Neon werden sie auch Neonlampen genannt. Dagegen nutzen die umgangssprachlich „Neonröhren“ genannten Leuchtstofflampen kein Edelgas, sondern Quecksilberdampf als Leuchtmittel. Auch Glühlampen werden mit Edelgasen, häufig Krypton oder Argon, gefüllt. Dadurch ist die effektive Abdampfrate des Glühfadens geringer, was eine höhere Temperatur und damit bessere Lichtausbeute ermöglicht.[14]
Auf Grund der niedrigen Schmelz- und Siedepunkte sind Edelgase als Kühlmittel von Bedeutung. Hier spielt vor allem flüssiges Helium eine Rolle, da durch dieses besonders niedrige Temperaturen erreicht werden können. Dies ist beispielsweise für supraleitende Magnete wichtig, die etwa in der Kernspinresonanzspektroskopie eingesetzt werden. Müssen für eine Anwendung keine so niedrigen Temperaturen erreicht werden, wie sie flüssiges Helium bietet, können auch die höher siedenden Edelgase wie Neon verwendet werden.[14]
Wie alle Gase wirken auch die Edelgase abhängig vom Druck durch Blockierung von Membranen in Nervenzellen narkotisierend. Die nötigen Drücke liegen aber bei Helium und Neon so hoch, dass sie nur im Labor erreicht werden können; für Neon liegt der notwendige Druck bei 110 bar.[25] Da sie daher keinen Tiefenrausch verursachen können, werden diese beiden Gase gemischt mit Sauerstoff („Heliox“ und „Neox“), auch mit Sauerstoff und Stickstoff („Trimix“) als Atemgase beim Tauchen verwendet. Mit diesen ist es möglich, größere Tiefen zu erreichen als bei der Nutzung von Luft.[26] Xenon wirkt dagegen schon bei Umgebungsdruck narkotisierend und kann daher anstelle von Distickstoffmonoxid als Inhalationsanästhetikum verwendet werden. Wegen des hohen Preises und der geringen Verfügbarkeit wird es jedoch nur selten verwendet.[27]
Helium ist Füll- und Traggas für Gasballone und Zeppeline. Neben Helium kann auch Wasserstoff verwendet werden. Dieser ist zwar leichter und ermöglicht mehr Nutzlast, jedoch kann er mit dem Sauerstoff der Luft reagieren und brennen. Beim unreaktiven Helium besteht diese Gefahr nicht.
Entsprechend ihrer Häufigkeit und Verfügbarkeit werden Edelgase in unterschiedlichen Mengen produziert. So betrug 1998 die Menge des hergestellten Argons etwa 2 Milliarden m3, Helium wurde in einer Menge von rund 130 Millionen m3 isoliert. Die Weltjahresproduktion an Xenon wird dagegen für 1998 auf nur 5.000–7.000 m3 geschätzt (jeweils Normkubikmeter). Entsprechend unterschiedlich sind die Preise der Gase: Argon kostet etwa 15 Euro pro Kubikmeter (unter Standardbedingungen, Laborqualität), Xenon 10.000 Euro pro Kubikmeter (Stand 1999).[14]
Verbindungen
Xenonverbindungen

Die größte Vielfalt an Edelgasverbindungen gibt es mit dem Xenon. Die wichtigsten und stabilsten sind dabei die Xenonfluoride Xenon(II)-fluorid, Xenon(IV)-fluorid und Xenon(VI)-fluorid, die durch Reaktion von Xenon und Fluor in unterschiedlichen Verhältnissen synthetisiert werden. Xenon(II)-fluorid ist die einzige Edelgasverbindung, die in geringen Mengen technisch genutzt wird, sie dient als starkes Oxidations- und Fluorierungsmittel in der organischen Chemie.[28]
Mit Sauerstoff erreicht Xenon die höchste mögliche Oxidationsstufe +8. Diese wird in Xenon(VIII)-oxid und dem Oxifluorid Xenondifluoridtrioxid XeO3F2 sowie in Perxenaten der Form XeO4− erreicht. Weiterhin sind Xenon(VI)-oxid und die Oxifluoride XeO2F2 und XeOF4 in der Oxidationsstufe +6 sowie das Oxifluorid XeOF2 mit vierwertigem Xenon bekannt. Alle Xenonoxide und -oxifluoride sind instabil und vielfach explosiv. Auch Verbindungen des Xenons mit Stickstoff, Chlor und Kohlenstoff sind bekannt. Unter supersauren Bedingungen konnten auch Komplexe mit Metallen wie Gold oder Quecksilber synthetisiert werden.
Verbindungen anderer Edelgase
Von den anderen Edelgasen sind Verbindungen nur in geringer Zahl bekannt. So sollten Radonverbindungen zwar thermodynamisch ähnlich stabil wie Xenonverbindungen sein, aufgrund der starken Radioaktivität und kurzen Halbwertszeit der Radon-Isotope ist ihre Synthese und exakte Charakterisierung aber außerordentlich schwierig. Vermutet wird die Existenz eines stabilen Radon(II)-fluorids, da Radon nach dem Durchleiten durch flüssiges Chlortrifluorid nicht mehr nachweisbar ist, somit reagiert haben muss. Löst man die Rückstände dieser Lösung in Wasser oder Säuren, bilden sich als Zersetzungsprodukte Sauerstoff und Fluorwasserstoff im gleichen Verhältnis wie bei Krypton- oder Xenondifluorid.[29]
Alle bekannten Verbindungen leichterer Edelgase sind thermodynamisch instabil, zersetzen sich leicht und lassen sich deshalb, wenn überhaupt, nur bei tiefen Temperaturen synthetisieren. Die wichtigste und stabilste Kryptonverbindung ist Krypton(II)-fluorid, das zu den stärksten bekannten Oxidations- und Fluorierungsmitteln zählt. Krypton(II)-fluorid ist direkt aus den Elementen herstellbar und Ausgangsprodukt einer Reihe weiterer Kryptonverbindungen.[30]
Während Helium- und Neonverbindungen weiterhin allein Gegenstand theoretischer Untersuchungen sind und Rechnungen ergaben, dass allenfalls eine Heliumverbindung (HHeF), dagegen keine einzige Neonverbindung stabil sein sollte[22], konnte eine erste Argonverbindung inzwischen tatsächlich synthetisiert werden: Durch Photolyse von Fluorwasserstoff in einer auf 7,5 K heruntergekühlten Argonmatrix konnte das sehr instabile Argonfluorohydrid gebildet werden, das schon bei Berührung zweier Moleküle oder Erwärmung über 27 K wieder in seine Bestandteile zerfällt.[10]
Clathrate
Argon, Krypton und Xenon bilden Clathrate, Einschlussverbindungen, bei denen das Edelgas physikalisch in einen umgebenden Feststoff eingeschlossen ist. Typische Beispiele hierfür sind Edelgas-Hydrate, bei denen die Gase in Eis eingeschlossen sind. Ein Argon-Hydrat bildet sich langsam erst bei −183 °C, Hydrate des Kryptons und Xenons schon bei −78 °C.[31] Auch mit anderen Stoffen wie Hydrochinon sind Edelgas-Clathrate bekannt.[32]
Einzelnachweise
- ↑ 1,0 1,1 1,2 1,3 William H. Brock: Viewegs Geschichte der Chemie. Vieweg, Braunschweig 1997, ISBN 3-540-67033-5, S. 211–216.
- ↑ R. K. Kochhar: French astronomers in India during the 17th–19th centuries. In: Journal of the British Astronomical Association. 1991, 101, S. 95–100 (Artikel).
- ↑ Helmut Sitzmann: Helium. In: Römpp Lexikon Chemie. Thieme Verlag, Stand Dezember 2006.
- ↑ Günther Bugge: Das Buch der großen Chemiker, Verlag Chemie, Weinheim 1974, ISBN 3-527-25021-2, S. 255.
- ↑ 5,0 5,1 Ulrich Abram, Felix Geldsetzer, Helmut Sitzmann: Radon. In: Römpp Lexikon Chemie. Thieme Verlag, Stand Dezember 2007.
- ↑ 6,0 6,1 Yu. Ts. Oganessian, V. K. Utyonkov, Yu. V. Lobanov, F. Sh. Abdullin, A. N. Polyakov, R. N. Sagaidak, I. V. Shirokovsky, Yu. S. Tsyganov, A. A. Voinov, G. G. Gulbekian, S. L. Bogomolov, B. N. Gikal, A. N. Mezentsev, S. Iliev, V. G. Subbotin, A. M. Sukhov, K. Subotic, V. I. Zagrebaev, G. K. Vostokin, M. G. Itkis: Synthesis of the isotopes of elements 118 and 116 in the 249Cf and 245Cm+48Ca fusion reactions. In: Phys. Rev. C. 2006, 74, 4, S. 044602-1–044602-1, doi:10.1103/PhysRevC.74.044602.
- ↑ 7,0 7,1 John F. Lehmann, Hélène P. A. Mercier, Gary J. Schrobilgen: The chemistry of krypton. In: Coordination Chemistry Reviews. 2002, 233/234, S. 1–39, doi:10.1016/S0010-8545(02)00202-3.
- ↑ Neil Bartlett: Xenon Hexafluoroplatinate(V) Xe+[PtF]−. In: Proceedings of the Chemical Society. 1962, S. 218, doi:10.1039/PS9620000197.
- ↑ R. Hoppe: Die Valenzverbindungen der Edelgase. In: Angewandte Chemie. 1964, 76, 11, S. 455–463, doi:10.1002/ange.19640761103.
- ↑ 10,0 10,1 Leonid Khriachtchev, Mika Pettersson, Nino Runeberg, Jan Lundell, Markku Räsänen: A stable argon compound. In: Nature. 2000, 406, S. 874–876, doi:10.1038/35022551.
- ↑ A. G. W. Cameron: Abundances of the elements in the solar system. In: Space Science Reviews, 1970, 15, S. 121–146 (PDF).
- ↑ 12,0 12,1 David R. Williams: Earth Fact Sheet. NASA, Greenbelt, Stand 20. Mai 2009.
- ↑ David R. Lide (ed.): CRC Handbook of Chemistry and Physics, 90. Auflage, CRC Press, Boca Raton, Florida, 2009, ISBN 978-1-4200-9084-0, Section 14, Geophysics, Astronomy, and Acoustics; Abundance of Elements in the Earth's Crust and in the Sea, p. 14-18.
- ↑ 14,00 14,01 14,02 14,03 14,04 14,05 14,06 14,07 14,08 14,09 14,10 14,11 P. Häussinger, R. Glatthaar, W. Rhode, H. Kick, C. Benkmann, J. Weber, H.-J. Wunschel, V. Stenke, E. Leicht, H. Stenger: Noble Gases. In: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2006 (doi:10.1002/14356007.a17_485).
- ↑ Chris J. Ballentine: Geochemistry: Earth holds its breath. In: Nature. 2007, 449, S. 294–296, doi:10.1038/449294a.
- ↑ Helmut Sitzmann: Helium. In: Römpp Lexikon Chemie. Thieme Verlag, Stand Dezember 2006.
- ↑ Klaus Hoffmann: Kann man Gold machen? Gauner, Gaukler und Gelehrte. Aus der Geschichte der chemischen Elemente. Urania-Verlag, Leipzig · Jena · Berlin 1979, keine ISBN, S. 67.
- ↑ 18,0 18,1 18,2 18,3 18,4 A. G. M. Ferreira, L. Q. Lobo: On the vapour pressure of radon. In: The Journal of Chemical Thermodynamics. 2007, 39, 10, S. 1404–1406, doi:10.1016/j.jct.2007.03.017
- ↑ K. Schubert: Ein Modell für die Kristallstrukturen der chemischen Elemente. In: Acta Crystallographica. 1974, 30, S. 193–204, doi:10.1107/S0567740874002469.
- ↑ A. V. Grosse: Some physical and chemical properties of element 118 (Eka-Em) and element 86 (Em). In: Journal of Inorganic and Nuclear Chemistry. 1965, 27, 3, S. 509–519, doi:10.1016/0022-1902(65)80255-X.
- ↑ Clinton S. Nash: Atomic and Molecular Properties of Elements 112, 114, and 118. In: J. Phys. Chem. A. 2005, 109, 15, S. 3493–3500, doi:10.1021/jp050736o.
- ↑ 22,0 22,1 Errol G. Lewars: Modeling Marvels: Computational Anticipation of Novel Molecules. Springer Verlag, 2008, ISBN 978-1-4020-6972-7, S. 69–80.
- ↑ L. C. Allen, J. E. Huheey: The definition of electronegativity and the chemistry of the noble gases. In: Journal of Inorganic and Nuclear Chemistry. 1980, 42, S. 1523–1524, doi:10.1016/0022-1902(80)80132-1.
- ↑ Hans-Hermann Braess, Ulrich Seiffert: Vieweg Handbuch Kraftfahrzeugtechnik. 5. Auflage, Vieweg+Teubner Verlag, 2007, ISBN 978-3-8348-0222-4, S. 674–676.
- ↑ Walter J. Moore, Dieter O. Hummel: Physikalische Chemie. 4. Auflage, de Gruyter, 1986, ISBN 978-3-11-010979-5, S. 284.
- ↑ Alfred A. Bove, Jefferson Carroll Davis: Bove and Davis' diving medicine. 4. Auflage, Elsevier, 2004, ISBN 978-0-7216-9424-5, S. 119–121.
- ↑ T. Marx, M. Schmidt, U. Schirmer, H. Reinelt: Xenon anaesthesia. In: Journal of the Royal Society of Medicine. 2000, 93, 10, S. 513–517 (PDF).
- ↑ Helmut Sitzmann: Xenon-Verbindungen. In: Römpp Lexikon Chemie., Thieme Verlag, Stand Mai 2005.
- ↑ Lawrence Stein: Ionic Radon Solutions. In: Science. 1970, 168, S. 362–364, doi:10.1126/science.168.3929.362.
- ↑ Leonid Khriachtchev, Hanna Tanskanen, Arik Cohen, R. Benny Gerber, Jan Lundell, Mika Pettersson, Harri Kiljunen, Markku Räsänen: A Gate to Organokrypton Chemistry: HKrCCH. In: Journal of the American Chemical Society. 2003, 125, 23, S. 6876–6877, doi:10.1021/ja0355269.
- ↑ R. M. Barrer, D. J. Ruzicka: Non-stoichiometric clathrate compounds of water. Part 4. – Kinetics of formation of clathrate phases. In: Transactions of the Faraday Society. 1962, 58, S. 2262–2271, doi:10.1039/TF9625802262.
- ↑ David R. Lide (ed.): CRC Handbook of Chemistry and Physics, 90. Auflage, CRC Press, Boca Raton, Florida, 2009, ISBN 978-1-4200-9084-0, Section 4, Properties of the Elements an Inorganic Compounds; The Elements, p. 4-4.
Literatur
- P. Häussinger, R. Glatthaar, W. Rhode, H. Kick, C. Benkmann, J. Weber, H.-J. Wunschel, V. Stenke, E. Leicht, H. Stenger: Noble Gases. In: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2006 (doi:10.1002/14356007.a17_485).
- Edelgase. In: Römpp Chemie Lexikon. Thieme Verlag, Stand März 2002.
- Arnold F. Holleman, Nils Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage, de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 417–429.
Weblinks
| Dieser Artikel wurde am 21. Mai 2010 in dieser Version in die Liste der exzellenten Artikel aufgenommen. |