32. Schmelzen und Lösungen von Salzen
Ionenverbindungen haben bestimmte Eigenschaften
Durch die allseitig wirkenden Anziehungskräfte sind die Ionen in den Ionengittern recht fest gebunden. Sie führen lediglich Schwingungen um die Gitterpunkte aus, die sie im Ionengitter besetzen. Folglich sind Ionenverbindungen bei Raumtemperatur fest. Erst durch große Zufuhr von Hitze kann man die Bewegungsenergie der Ionen soweit erhöhen, dass die Gitterkräfte überwunden werden und das Ionengitter zerfällt. In diesem Moment hat die Ionenverbindung die Schmelztemperatur erreicht, die bei diesen Substanzen relativ hoch ist. Wesentlich höher noch liegt die Siedetemperatur.
| Salz | Schmelzpunkt | Siedepunkt | |
|---|---|---|---|
| Natriumchlorid | NaCl | 800 °C | 1440 °C |
| Kaliumbromid | KBr | 728 °C | 1376 °C |
Einige Salze, besonders Salze organischer Säuren, zersetzten sich beim Erhitzen noch bevor die Siedetemperatur erreicht wird, manche sogar noch vor Erreichen der Schmelztemperatur.
Elektrische Leitfähigkeit von Schmelzen
Wie der Name schon sagt, kann man sich den elektrischen Strom als einen Fluß (Fließen, Strömen) von freibeweglichen Ladungsträgern vorstellen.
Hält man die freien Enden eines Leitfähigkeitsprüfers in das feste Salz Kaliumnitrat, so stellt man fest, dass es keine Leitfähigkeit besitzt. Führt man nun in der Schmelze von Kaliumnitrat (Ionenverbindung) eine Leitfähigkeitsprüfung durch, so beobachtet man plötzlich eine Leitfähigkeit, während in der Schmelze von Naphthalin (Molekülverbindung) die Leitfähigkeit ausbleibt. Bei Naphthalin handelt es sich um einen Feststoff aus Molekülen mit der Zusammensetzung C10H8.
Im festen Zustand sind die Ionen an die Gitterplätze gebunden. Beim Schmelzen der Ionenverbindung wird der Zusammenhalt der Ionen gelockert. Sie verlassen Ihre Gitterplätze und können sich nun frei in der flüssigen Schmelze bewegen. Da zuerst die Gitterenergie überwunden werden muß, bevor sich Ionen frei bewegen können, haben Salze einen hohen Schmelzpunkt. Festes Naphthalin kann man sehr leicht schmelzen, denn der Zusammenhalt seiner Moleküle ist nicht sehr groß. In dieser Schmelze bewegen sich nun die Moleküle des Naphthalins, diese sind aber keine Ladungsträger.
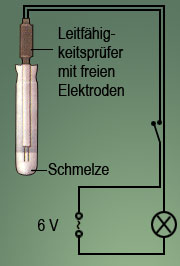
Findet in einer Schmelze ein Stromtransport statt, weist dies auf bewegliche Ionen hin. Im Gegensatz zu nicht geladenen Molekülen (beispielsweise des Naphthalins) haben sie eine positive oder negative elektrische Ladung.
Elektrische Leitfähigkeit von Lösungen
Auch eine Salzlösung leitet den elektrischen Strom, denn beim Lösen eines Salzkristalls werden die im Gitter gebundenen Ionen frei. Sie können sich nun als Ladungsträger im Lösungsmittel frei bewegen und leiten den elektrischen Strom. Anders verhält es sich mit einer Zuckerlösung: Da die Zuckermoleküle im Wasser keine Ladungsträger sind, kann die Lösung den Strom nicht leiten.
Zusammenfassend haben Salze also meist hohe Schmelz- und Siedepunkte und Ihre Schmelzen leiten den elektrischen Strom. Chemische Verbindungen, die auf einer Atombindung beruhen, haben in der Regel niedrige Schmelz- und Siedepunkte und sie gehören zu den Nichtleitern. In Schmelzen und Lösungen kann man Ionen nachweisen, indem man eine Leitfähigkeitsprüfung durchführt. Salze im festen Zustand sind – trotz ihres Ionenaufbaus – meist Nichtleiter. Die Bindungskräfte zwischen den Ionen sind zu groß, als dass sich einzelne Ionen frei bewegen könnten. Werden Salze geschmolzen, ändert sich das. Die Ionen sind nun nicht mehr so fest an ihren Nachbarionen gebunden und so können Salzschmelzen den elektrischen Strom durch Ionenleitung transportieren.