17. Das Element Sauerstoff
Vorkommen
Sauerstoff ist das am weitesten verbreitete Element auf der Erde. Reine Luft enthält 20,95 Vol.-% elementaren Sauerstoff, der in der Luft aus zweiatomigen Sauerstoffmolekülen (O2) besteht. Wasser besteht zu 88,81 Gewichtsprozent aus Sauerstoff, der hier an Wasserstoff gebunden ist. Am Aufbau der Erdrinde ist er bis in eine Tiefe von 16 km (einschließlich Hydro- und Atmosphäre) in Form von Oxiden und anderen sauerstoffhaltigen Verbindungen mit 50,5 Gewichtsprozent beteiligt.
Darstellung und Nachweis von Sauerstoff
Technisch wird Sauerstoff heute fast ausschließlich durch Rektifikation von Luft gewonnen. Das Verfahren wurde 1902 zunächst von Carl von Linde entwickelt (Linde-Verfahren) und von Georges Claude wirtschaftlich rentabel gestaltet. (vgl. Abb. 15.3, Kapitel 15).
Um kleinere Mengen Sauerstoff zu produzieren, kann Sauerstoff aus der Luft durch Adsorption von anderen Gasen getrennt werden. Dazu strömt Luft durch Molekularsiebe. Dabei werden Stickstoff und Kohlenstoffdioxid adsorbiert und nur Sauerstoff und Argon gelangen hindurch.


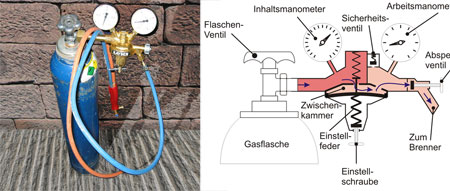
Der technisch hergestellte Sauerstoff wird in blauen Stahlflaschen unter hohem Druck abgefüllt. Um mit unterschiedlichen Drücken arbeiten zu können, bedient man sich eines Druckreduzierventils an der Stahlflasche. Im Labor kann Sauerstoff leicht aus Sauerstoffverbindungen dargestellt werden (Versuch 1 und 2). Die Grlimmspanprobe, bei der ein glühender Holzspan entflammt, gilt als Nachweis für elementaren Sauerstoff (1).
Eigenschaften und Verwendung
Alle Tiere und die meisten Pflanzen benötigen Sauerstoff zum Leben. Sie entnehmen ihn meistens durch Atmung aus der Luft oder durch Resorption aus in Wasser gelöstem Sauerstoff. In hohen Konzentrationen dagegen ist er für die meisten Lebewesen giftig. Der Sauerstoffverbrauch eines Erwachsenen beträgt in Ruhe etwa 250 ml/min.
| Alter | Atemzüge pro Minute |
|---|---|
| Erwachsene | 12-15 |
| Jugendliche | 16-19 |
| Schulkind | 20 |
| Kleinkind | 25 |
| Säugling | 30 |
| Neugeborene | 40-50 |
Verletzungen und viele Erkrankungen der Lunge können zu einem Sauerstoffmangel in den Schlagadern (Arterien) und im Gewebe lebenswichtiger Organe führen. Beispielsweise kann unser Gehirn eine Unterbrechung der Sauerstoffversorgung höchstens 4 Minuten ohne bleibende Schädigung überstehen. Aus diesem Grund wird Patienten in der Notfall- und Intensivmedizin sehr häufig zusätzlicher Sauerstoff verabreicht. Bei selbstständig atmenden Patienten wird die Umgebungsluft mit Hilfe verschiedener Sonden und Masken mit Sauerstoff angereichert, bei künstlich beatmeten Patienten wird der Sauerstoff im Beatmungsgerät zugemischt.
erscheinungen
Eine wichtige Eigenschaft des Elements Sauerstoff ist, dass in reinem Sauerstoff Verbrennungsvorgänge viel heftiger als an Luft ablaufen, das zeigt uns die Glimmspanprobe. Die Stahlindustrie ist in Deutschland der größte Sauerstoffverbraucher. Beim »Sauerstoffaufblas-Verfahren« wird reiner Sauerstoff zur Verbrennung der Verunreinigungen in die Eisenschmelze geblasen (Kapitel 58).

Die heftige Verbrennung in reinem Sauerstoff nutzt man natürlich technisch aus, nicht nur bei Raketenstarts. Beim autogenen Brennschneiden erwärmt eine ringförmige Brenngas-Sauerstoff-Flamme (Heizflamme) das Werkstück (beispielsweise Eisen) lokal bis auf Zündtemperatur. In der Mitte der Brennerdüse tritt Sauerstoff unter hohem Druck aus, verbrennt das Eisen und bläst die Schneidschlacke (Oxide und Schmelze) weg. In der Industrie werden Brennschneidmaschinen oder auch Roboter zum automatisierten, autogenen Brennschneiden verwendet.
Beim Autogenschweißen wird im Schweißbrenner Sauerstoff mit Acetylen (Ethin, gelbe Flaschen) vermischt und verbrannt. Es entstehen dann so hohe Temperaturen, dass Eisen schmilzt und mit einem anderen Eisenteil verbunden werden kann.
Bei allen Verbrennungsvorgängen gilt: Sauerstoff unterhält die Verbrennung; er selbst brennt aber nicht.
Salpeter ist ein Oxidationsmittel
Erhitzt man Salpeter, dann spaltet sich Sauerstoff ab und verbindet sich mit Kohlenstoff (Holzkohle) bzw. Schwefel in einer stark exothermen Reaktion zu den entsprechenden Oxiden, die als gasförmige Verbindungen entweichen (Versuch Versuch 5); Stoffe, die andere oxidieren können, nennt man Oxidationsmittel.
Folgende Gleichung gibt wieder, was bei der Sauerstoffabspaltung aus Kaliumnitrat vor sich geht:
$ \mathrm { 2 \ KNO_{3} \quad \xrightarrow { Hitze } \quad 2 \ KNO_{2} + O_{2} \uparrow } $
Wenn man Holzkohle (Kohlenstoff C, vierwertig) auf die Schmelze gibt, so verbinden sich Kohlenstoff und Sauerstoff zu Kohlenstoffdioxid:
$ \mathrm { C + O_{2} \ \longrightarrow \ CO_{2} \uparrow } $
Die Gesamtgleichung für Versuch 5 läßt sich also jetzt so formulieren:
$ \mathrm { 2 \ KNO_{3} + C \; \longrightarrow \; 2 \ KNO_{3} + CO_{2} \ \uparrow } $
Kaliumnitrat + Kohlenstoff $\longrightarrow$ Kaliumnitrit + Kohlenstoffdioxid