27. Von den Atomen zu Molekülen - Atombindung
Stabile Atome
Im Gegensatz zu anderen gasförmigen Elementen kommen die Edelgase bei Normalbedingungen einatomig vor. Edelgase sind kaum bestrebt, sich mit anderen Elementen zu verbinden, daher sind sie chemisch sehr stabil. Chemische Reaktionen gehen auf Vorgänge in der äußeren Elektronenhülle der Atome zurück, daher muß davon ausgegangen werden, dass die Atome der Edelgase eine äußerst stabile Elektronenkonfiguration besitzen (»Edelgasregel«).
Die folgende Tabelle zeigt, dass die Außenschale des Heliums 2 Elektronen aufweist, alle übrigen Edelgase besitzen 8 Elektronen.
| Element | OZ | K | L | M | N | O | P |
| Helium He | 2 | 2 | |||||
| Neon Ne | 10 | 2 | 8 | ||||
| Argon Ar | 18 | 2 | 8 | 8 | |||
| Krypton Kr | 36 | 2 | 8 | 18 | 8 | ||
| Xenon Xe | 54 | 2 | 8 | 18 | 18 | 8 | |
| Radon Rn | 86 | 2 | 8 | 18 | 32 | 18 | 8 |
Die Bildung des Wasserstoffmoleküls
Bekanntlich bestehen Moleküle aus Atomen, die fest miteinander verbundenen sind. Das Wasserstoffmolekül H2 ist ein einfaches Molekül aus zwei Atomen.
Energie zur Trennung einer Atombindung
Wenn sich zwei Wasserstoffatome zu einem Molekül verbinden, durchdringen sich ihre Elektronenhüllen in der Weise, dass eine einzige Schale entsteht. In ihr bewegen sich jetzt 2 Elektronen.
Mit dieser Verbindung zweier Wasserstoffatome zu einem Wasserstoffmolekül hat sich nun die Elektronenschale des Edelgases Helium gebildet, die als äußerst besonders stabil bekannt ist. In der Chemie bezieht sich Stabilität auf die Energie eines Teilchens. Wird bei der Bildung einer Verbindung oder allgemein von Teilchen Energie abgegeben, so sind die Produkte energieärmer, d. h. stabiler als die Ausgangsstoffe.
Bei der Bildung des Wasserstoffmoleküls ist es so:
$ \mathrm { H + H \; \rightleftharpoons \; H_{2} \ + 435,76 \ kJ / mol } $
Bei der Bildung eines Wasserstoffmoleküls wird Energie frei, die man Bildungswärme nennt. Will man das Molekül wieder in seine Atome zerlegen, muß die bei der Verbindung freigewordene Energie wieder aufgewendet werden. Diese aufzuwendende Energie nennt man Bindungsenergie. Sie ist ein Maß dafür, wie fest die beiden Atome zusammenhalten.
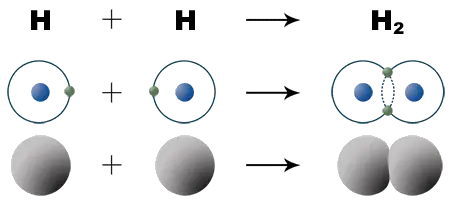
Die Verbindung von zwei Wasserstoffatomen zu einem Molekül beruht also auf einem gemeinsamen Elektronenpaar. Es führt zu einer chemischen Bindung. Die Art der Bindung, die auf gemeinsamen Elektronenpaaren beruht, wird Elektronenpaarbindung oder Atombindung genannt. Die Ausbildung einer chemischen Bindung zielt demnach auf das Erreichen einer stabilen Edelgasschale ab.
Die Symbolisierung der Atombindung
Die Atombindung wird mit Hilfe von Elektronenformeln schematisch dargestellt. Dabei werden die Außenelektronen durch Punkte angegeben.
$ \quad \mathrm {H \cdot + \cdot H \ \rightleftharpoons \ H:H} $
$ \mathrm { :{\overset { \Large \cdotp \ \cdotp } {\underset { \Large \cdotp \ \cdotp } {Cl}}} \ \cdotp + \cdotp \ {\overset { \Large \cdotp \ \cdotp } {\underset { \Large \cdotp \ \cdotp } {Cl}}}: \ \leftrightharpoons \ :{ \overset {\Large {\cdotp \ \cdotp }} {\underset {\Large {\cdotp \ \cdotp }} {Cl}}} : {\overset {\Large {\cdotp \ \cdotp }} {\underset {\Large {\cdotp \ \cdotp }} {Cl}}}:} $
Das Beispiel des Chlormoleküls zeigt, dass durch das gemeinsame Elektronenpaar jedes Chloratom von 8 Elektronen (»Achterschale«) umgeben ist und damit eine Edelgasschale erhalten hat. An Stelle von Punkten kann ein Elektronenpaar auch durch einen Strich symbolisiert werden.
$ \mathrm { :{\overset {\Large {\cdotp \ \cdotp }} {\underset {\Large {\cdotp \ \cdotp }} {Cl}}} : {\overset {\Large {\cdotp \ \cdotp }} {\underset {\Large {\cdotp \ \cdotp }} {Cl}}}: \quad oder \quad | \ {\underline {\overline {Cl}}} - \ {\underline {\overline {Cl }}} | } $
Die Atombindung in Molekülen von Verbindungen
Elektronenpaarbindungen können auch zwischen verschiedenen Atomen ausgebildet werden. Wenn sich ein Wasserstoffatom mit einem Chloratom verbindet, erhält durch das gemeinsame Elektronenpaar sowohl das Wasserstoffatom als auch das Chloratom eine stabile Edelgaskonfiguration. Es entsteht ein Molekül der Verbindung Chlorwasserstoff.
$ \mathrm { H \cdotp + \cdotp \ {\overset { \Large \cdotp \ \cdotp } {\underset { \Large \cdotp \ \cdotp } {Cl}}}: \ \longrightarrow \ H : {\overset { \Large \cdotp \ \cdotp } {\underset { \Large \cdotp \ \cdotp } {Cl}}}:} $
Das Sauerstoffatom benötigt zur Ausbildung einer Edelgasschale (»Achterschale«) zwei Elektronen. So entsteht aus einem Sauerstoffatom und zwei Wasserstoffatomen das Wassermolekül.
$ \mathrm { \cdotp \ {\overset { \Large \cdotp \ \cdotp } {\underset { \Large \cdotp \ \cdotp } {O}}} \cdotp + 2 \ \cdotp H \ \longrightarrow \ H : {\overset { \Large \cdotp \ \cdotp } {\underset { \Large \cdotp \ \cdotp } {O}}}:H} $
Mit Hilfe des Periodensystems ist es möglich, vorauszusagen, welche Moleküle sich zwischen verschiedenen Atomen bilden können.
- $ \mathrm { F_{2} } $
- $ \mathrm { Br_{2} } $
- $ \mathrm { S_{8} } $
- $ \mathrm { CH_{4} } $
- $ \mathrm { SiF_{4} } $
- $ \mathrm { HI } $
- $ \mathrm { Cl_{2}O } $
- $ \mathrm { CCl_{4} } $