25. Atomhülle und Periodensystem
Die gesetzmäßige Anordnung der Elektronen in der Atomhülle
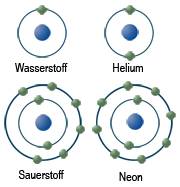
Das »Kern-Hülle-Modell« des britischen Physikers Ernest Rutherford (1871-1937) erfuhr im Jahre 1913 durch den dänischen Physiker Niels Bohr (1885-1962) eine entscheidende Verbesserung. Die Annahme Bohrs war, dass sich die Elektronen nur auf ganz bestimmten Bahnen (»Elektronenschalen«) um den Atomkern bewegen können. Dabei entspricht jeder dieser Bahnen ein ganz bestimmter Energiezustand des Atoms. Soll ein Elektron von einem inneren Bereich auf einen äußeren gebracht werden, muß Energie aufgebracht werden. Wenn es von einem äußeren Bereich auf einen näher um den Kern liegenden Bereich fällt, dann wird Energie abgegeben, beispielsweise in Form von Licht.
Bezeichnung der Elektronenschalen
1911 führte Charles Glover Barkla, Professor für Physik am King´s College der University of London, die Bezeichnungen K und L für die inneren Elektronenschalen ein, weil man die Bezeichnungen A, B etc. schon für die Absorptionslinien des Sonnenlichts verwendete. Weil Barkla dachte, dass man noch viele Absorptionslinien finden würde, fing er mit der Bezeichnung der Elektronenschalen in der Mitte des Alphabets, bei K, an. Die Elektronenschalen (Hauptenergiestufen) werden also mit den Buchstaben K, L, M, N usw. oder mit den Ziffern 1, 2, 3, 4 usw. bezeichnet. Je weiter eine Schale vom Atomkern entfernt ist, desto mehr Elektronen können sich in ihr aufhalten (siehe Tabelle).
| Schale | max. besetzt |
|---|---|
| 1 2 3 4 7 n |
2 8 18 32 98 2 ⋅ n2 |
Das Periodensystem der Elemente
Der deutsche Chemiker Lothar Meyer (1830-1895) und der russische Chemiker Dimitri Mendelejew (1834-1907) ordneten unabhängig voneinander die Elemente nach ihren Atommassen, und zwar unter Berücksichtigung der Wertigkeiten. Dieses Ordnungsprinzip wurde im Laufe der Zeit immer weiter verfeinert und führte schließlich zum heutigen Periodensystem der Elemente (PSE). Die im PSE in den senkrechten Spalten untereinander stehenden Elemente bilden eine Gruppe, nebeneinander stehende Elemente gehören zu einer Periode.

Kern-Hülle-Modell und Periodensystem
Im PSE sind die Elemente nach ihrer Ordnungszahl und damit nach ihrer Elektronenzahl in der Atomhülle geordnet. Die Elektronenschalen sind nach folgenden Regeln besetzt:
- Jede Elektronenschale kann nur eine bestimmte Höchstzahl an Elektronen aufnehmen (siehe Tabelle)
- Auf der äußeren Schale eines Atoms können sich höchstens 8 Elektronen befinden.
Wie aus Bild 3 hervorgeht, wird die M-Schale (maximale Besetzung 18 Elektronen) nicht fortlaufend mit Elektronen aufgefüllt, sonst dürften bei den Elementen Kalium und Calcium nicht bereits Elektronen in die N-Schale eingebaut werden. Die weitere Auffüllung der M-Schale erfolgt erst bei den Elementen Scandium (Ordnungszahl 21) bis Zink (Ordnungszahl 30). Beim Element Gallium (Ordnungszahl 31) wird der Ausbau der N-Schale fortgesetzt, bis sich dort 8 Elektronen befinden. Dies ist beim Edelgas Krypton (Ordnungszahl 36) der Fall.
Jene Elemente, in denen innere Schalen aufgefüllt werden, bezeichnet man als Übergangselemente. Alle Übergangselemente sind auschließlich Metalle. Im PSE stellen die Übergangselemente die Nebengruppen dar, während die Elemente, bei denen Elektronen in die äußerste Schale eingebaut werden, die Hauptgruppen bilden. Aus seiner Position im Periodensystem kann der Atombau eines Hauptgruppenelements folgendermaßen abgeleitet werden:
Periode des Elements ≡ Zahl der Elektronenschalen
Gruppennummer ≡ Zahl der Außenelektronen (Valenzelektronen)
Demnach haben alle Atome von Elementen in einer Hauptgruppen die gleiche Anzahl von Valenzelektronen, unterscheiden sich jedoch in der Anzahl ihrer Elektronenschalen. Die Atome von Elementen einer Periode besitzen die gleiche Anzahl von Elektronenschalen, aber unterschiedlich viele Valenzelektronen.
Übergangselemente besitzen alle in ihrer äußersten Schale 1 oder 2 Elektronen.
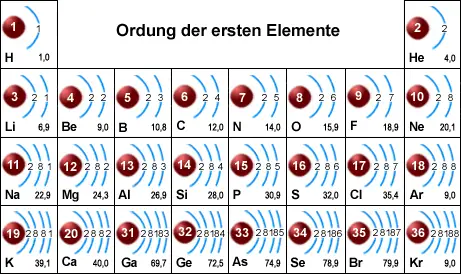
Die Elektronen werden in die K- und L-Schale bis zur vollen Auffüllung eingebaut.
In die M-Schale werden zunächst 8 Elektronen eingebaut (Element 18), dann wird bereits die Auffüllung der N-Schale begonnen.
Die restlichen Elektronen erhält die M-Schale bei den Elementen 21 bis 30.
Dann werden weitere Elektronen in die N-Schale eingebaut.
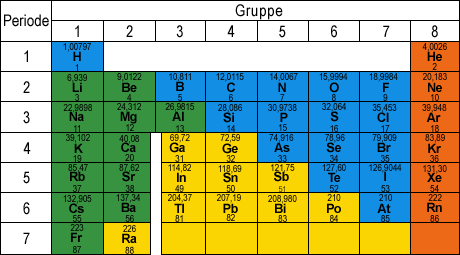
Die Hauptgruppen des Periodensystems der Elemente.
Die Periodennummer gibt die Zahl der Schalen und die Nummer der Schale an, in die gerade Elektronen eingebaut wercen.
Gie Gruppennummer entspricht der Elektronenzahl in der äußersten Schale