48. Eigenschaften der konzentrierten Schwefelsäure - Verwendung
Eigenschaften
Reine Schwefelsäure ist eine schwere, ölige Flüssigkeit mit einem Siedepunkt von 338°C. Neben den allgemeinen Säureeigenschaften, die wir bereits kennengelernt haben, zeigt die Schwefelsäure einige hervorstechende Eigenschaften.
Auf viele organische Stoffe wirkt konz. Schwefelsäure verkohlend und zersetzend, indem sie daraus Wasser abspaltet:
$ \mathrm {\underbrace {C_{6}H_{12}O_{6}}_{Traubenzucker} \quad \xrightarrow{H_{2}SO_{4}} \quad \underbrace {6 \ C + 6 \ H_2O}_{Kohlenstoff + Wasser} } $
Schwefelsäure reißt begierig Wassermoleküle an sich. Wegen der damit verbundenen Wärmeentwicklung kommt es auch beim Verdünnen mit Wasser zu einer beträchtlichen Temperatursteigerung. Achte also darauf:
Nie das Wasser in die Säure schüttensonst kann die Flüssigkeit zu sieden anfangen und herausspritzen (unter Umständen springt sogar das Glas!)
Die wasserentziehende (= hygroskopische) Wirkung der konz. Schwefelsäure wird im Labor zum Trocknen von Gasen in Waschflaschen und von feuchten Präparaten in Exsikkatoren ausgenutzt.
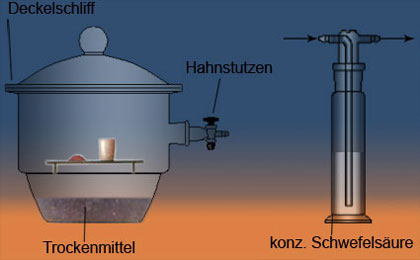
Exsikkator.
Als wasserentziehendes Mittel werden neben konz. Schwefelsäure eine Reihe anderer Verbindungen benützt
Waschflasche.
Beim durchleiten eines Gases wird diesem Wasserdampf entzogen.
Konzentrierte Schwefelsäure und Edelmetalle
Bei der Einwirkung von konz. Schwefelsäure auf Kupfer entsteht Schwefeldioxid und schwarzes Kupferoxid, das sich beim Verdünnen in Wasser mit blauer Farbe löst. Dabei spielt sich ein Redoxvorgang ab.
Der gesamte chemische Vorgang ist also eine Redoxreaktion:
Reduktion: $ \ \qquad \mathrm { H_{2}SO_{4} \; \longrightarrow \; H_{2}O + SO_{2} \ \uparrow + < O> } $
Oxidation: $ \ \qquad \mathrm { Cu + < O> \; \longrightarrow \; CuO \ \scriptsize Kupferoxid (schwarz) } $
Redoxreaktion: $ \ \ \mathrm { CuO + \ 2 \ H^{+}_{(aq)} + SO^{2-}_{4 (aq)} \longrightarrow {\underbrace {Cu^{2+}_{(aq)} + SO^{2-}_{4 (aq)}}_{Kupfersulfat \ (in \ Wasser \ blau)}} + H_{2}O } $
Im Gegensatz zu verd. Schwefelsäure und konz. Salzsäure wirkt die konz. Schwefelsäure oxidierend. Aufgrund dieser Eigenschaften löst sie die meisten Edelmetalle (ausgenommen Gold und Platin) auf.
Verwendung
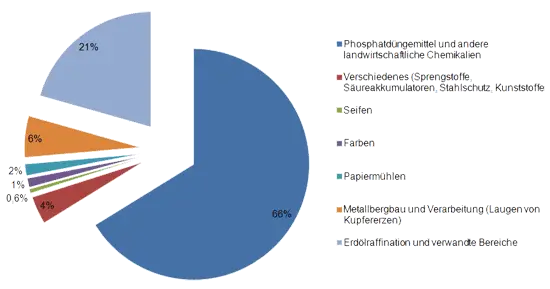
Die große Bedeutung der Schwefelsäure, die aus den Produktionszahlen hervorgeht, beruht auf ihrer vielseitigen Verwendung. Sie dient zur Herstellung von Düngemitteln und Beizmitteln, wird in der Textilindustrie, bei der Mineralölraffination und für Akkumulatoren gebraucht und dient zur Herstellung von Sulfaten. Die Schwefelsäure war lange Zeit ein Maßstab für die wirtschaftliche Bedeutung der Chemieproduktion eines Landes. Sie ist darin heute teilweise von der Chlorerzeugung abgelöst worden.