57. Eisen
Eisen ist das zwar das zweithäufigste Metall in der Erdkruste, allerdings kommt es fast nur in Form seiner Verbindungen vor. In der Natur findet man gediegenes Eisen nur selten, und wenn doch, dann meist in Form kleiner Bläschen oder Verdickungen im umgebenden Gestein.
- Magneteisenstein (Magnetit)
- Roteisenstein (Hämatit)
- Brauneisenstein (Limonit)
- Spateisenstein (Siderit)
- Eisenkies (Pyrit)
Eisen gehört mit einem Anteil von 4,7 % zu den häufigsten Metallen der Erdkruste. Die chemischen Verbindungen des Eisens sind im Wesentlichen Eisenoxide, das heißt chemische Verbindungen des Eisens mit Sauerstoff, oder Eisencarbonate.
Neben den Metalloxiden liegen Metalle auch als Sulfide vor, denn sie sind Verbindungen mit Schwefel eingegangen. So werden in geringen Mengen auch Eisenerze verhüttet, in denen das Eisen mit Schwefel (Pyrit) oder einigen anderen Elementen verbunden ist. In desem Fall spricht man von sulfidischen Erzen. Die wichtigsten Eisenerze sind Magnetit (bis 72 % Eisengehalt), Hämatit (bis 70 % Eisengehalt) und Siderit (bis 48 % Eisengehalt).
 |
 |
|
|
|
 |
 |
|
|
|
Verwendung
Eisen ist der Hauptbestandteil von Stahl. Stähle sind Legierungen des Eisens, die beim Vermischen (Legieren) mit anderen Metallen und auch Nichtmetallen (insbesondere Kohlenstoff) entstehen. Eisen ist mit 95 Prozent Gewichtsanteil das weltweit meistverwendete Metall. Der Grund dafür liegt in seiner weiten Verfügbarkeit, welche es recht preiswert macht, und darin, dass es hervorragende Festigkeit und Zähigkeit beim Eingehen von Legierungen mit anderen Metallen wie Chrom, Molybdän und Nickel, erreicht, die es für viele Bereiche in der Technik zu einem Grundwerkstoff machen. Es wird bei der Herstellung von Landfahrzeugen, Schiffen und im gesamten Baubereich (Stahlbeton) eingesetzt.
| Mineral | Formel | Vorkommen |
|---|---|---|
| Magneteisenstein (Magnetit) | $ \mathrm {Fe_{3}O_{4}} $ | Skandinavien, Rußland |
| Roteisenstein, Blutstein (Hämatit) | $ \mathrm {Fe_{2}O_{3}} $ | Lahn-Dill-Gebiet, Spanien, USA, Afrika |
| Brauneisenstein (Limonit) | $ \mathrm {Fe_{2}O_{3} \cdot H_{2}O} $ | Salzgitter-Peine-Gebiet, Lothringen |
| Spateisenstein (Siderit) | $ \mathrm {FeCO_{3}} $ | Erzberg (Steiermark), Hüttenberg (Kärnten) |
| Eisenkies (Pyrit) | $ \mathrm {FeS_{2}} $ | verbreitet, für Deutschland aus Spanien eingeführt |
Eisen ist neben Cobalt und Nickel eines der drei ferromagnetischen Metalle, die mit dieser Eigenschaft den großtechnischen Einsatz des Elektromagnetismus ermöglichen, beispielsweise in Generatoren, Transformatoren, Drosseln, Relais und Elektromotoren. Eisen wird rein oder mit Silicium, Aluminium, Cobalt oder Nickel (Mu-Metall) legiert und dient als magnetisches Kernmaterial zur Führung von Magnetfeldern oder zur Abschirmung von Magnetfeldern. Hierfür wird Eisen in großem Umfang in Form von Blechen und Pulvern produziert.
Rostvorgang

Chemisch reines Eisen ist ein verhältnismäßig weiches, unedles Metall, das von verd. Säuren leicht zerstört wird und in feuchter Luft rostet. Die Verwitterung von Eisenwerkstoffen an Luft und Wasser zu Rost verursacht weltweit jährlich Schäden in Milliardenhöhe. Anhand dieser Eigenschaften werden die Metalle in die Gruppen Eisenmetalle (rosten) und Nichteisenmetalle (rosten nicht) unterschieden.
Chemisch gesehen setzt sich Rost allgemein aus Eisen(II)-oxid, Eisen(III)-oxid und Kristallwasser zusammen. Rost ist somit ein wasserhaltiges Oxid des Eisens, eine chemische Verbindung, die zu den Oxiden gehört und zusätzlich Wasser und Hydroxidionen enthält (Oxidhydrat). Rost entsteht durch die Oxidation des Eisens, ohne dass höhere Temperaturen erforderlich wären. Da Säuredämpfe das Rosten begünstigen sind in Labors, aber auch in Industriebetrieben Geräte und Konstruktionen aus Eisen besonders rostgefährdet.
Gegen das Rosten schützen geeignete Überzüge oder Beschichtungen des Eisens. Beispiele für Beschichtungsstoffe (flüssig, pastös oder pulverförmig aufgetragene Stoffe) sind Kunstharze (z. B. EP oder PU), Kunststoffe (z. B. PVC oder Kunststofffolien), Öle, Lack, Gummi oder Hartparaffine. Beispiele für anorganische oder metallische Überzüge sind eine Eloxalschicht, eine Harteloxalschicht, eine Chromatierung sowie Feuerverzinkung.
Große und lange Pipelines aus Stahl für den Wassertransport werden bevorzugt zum Korrosionsschutz mit einer Innenbeschichtung aus Zementmörtel ausgekleidet. Durch die Zumischung geeigneter Kunststoffe kann die Korrosionsfestigkeit weiter verbessert werden.
Der Hochofenprozess
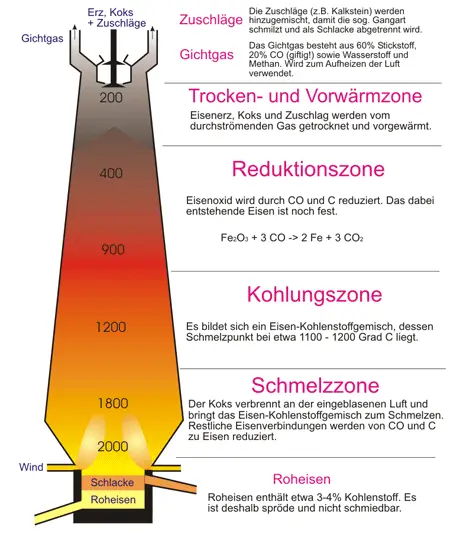
Ein Hochofen ist eine großtechnische Anlage, mit der aus aufbereiteten Eisenerzen (meist Oxiden) in einem kontinuierlichen Reduktions- und Schmelzprozess flüssiges Roheisen erzeugt wird. Siderit und Pyrit werden vor der Verarbeitung zu Eisen (s. Kapitel 49) in Oxide umgewandelt (Rösten). Die Darstellung des Eisens erfordert dann im Prinzip die Reduktion der Eisenoxide. Sie erfolgt mit Koks im Hochofen. Den Bau eines Hochofens zeigt Bild 5.
Die meist per Bahn oder Schiff angelieferten Einsatzstoffe wie Eisenerze, Koks und Zuschläge (z. B. Kalk, Sand und Dolomit) werden zunächst in eine Bunkeranlage gebracht. Von der Bunkeranlage aus werden Möller (= Erze und Zuschlagstoffe) und Koks zum oberen Ende des Schachtes, der so genannten „Gicht“, transportiert. Die Zuführung des Materials wird auch als Beschickung oder Begichtung bezeichnet und erfolgt je nach Platzangebot entweder über Bandstraßen, Setzkübel oder kleine Schüttwaggons, sogenannte Loren. Die Zuschläge dienen zur Beseitigung von Begleitmineralien, der Gangart. Die wichtigsten Gangart-Mineralien sind Quarz, Calcit, Dolomit, Baryt und Fluorit. Die Zuschläge verbinden sich mit der Gangart zu Schlacke.
Die für den Hochofen notwendige Luft (»Wind«) wird in Winderhitzern - das sind etwa 15 m hohe Türme - auf 600 - 800°C erhitzt. Die heiße Luft entzündet den Koks, der zu Kohlenstoffmonoxid verbrennt:
$ \mathrm {2 \ C + \ O_{2} \quad \longrightarrow \quad 2 \ CO + 110,5 \ kJ} $
Das aufsteigende Kohlenstoffmonoxid reduziert in der darüberliegenden Erzschicht die Oxide zu Eisen:
$ \mathrm {25{,}5 \ kJ + Fe_{2}O_{3} \quad \leftrightharpoons \quad 3 \ CO + 2 \ Fe + 3 \ CO_{2} } $
Das entstandene Kohlenstoffdioxid wird in der folgenden Koksschicht wieder reduziert. Durch die hohen Temperaturen kommt es zur Gleichgewichtsverschiebung:
$ \mathrm {173 \ kJ + CO_{2} + C \quad \leftrightharpoons \quad 2 \ CO } $
In den oberen, kühleren Bereichen des Hochofens oder unter dem katalytischen Einfluß des Eisens entsteht auch im unteren Teil Kohlenstoff in fein verteilter Form, der eine ausgezeichnete Reduktionswirkung hat:
$ \mathrm {497,35 \ kJ + Fe_{2}CO_{2} + 3 \ C \quad \leftrightharpoons \quad 2Fe + 3 \ CO } $
Ein Teil dieses Kohlenstoffs löst sich im Eisen auf und bewirkt eine Herabsetzung des Schmelzpunktes von 1539°C auf knapp 1200°C. Das Gichtgas (das den Hochofen verlassende Gas) hat wegen seines hohen Gehaltes an CO einen großen Heizwert (3300-4600 kJ/m3). Es wird im Hochofenbetrieb weiter verwendet und dient vor allem zum Aufheizen der Winderhitzer. Die beim Hochofenprozess anfallende Schlacke besteht aus etwa 38–41 % Calciumoxid, 7–10 % Magnesiumoxid, 34–36 % Siliciumdioxid, 10–12 % Aluminiumoxid, 1,0–1,5 % Schwefel, 1,0 % Titandioxid, 0,16–0,2 % Eisenoxid sowie verschiedenen weiteren Oxiden und Sulfiden. Sie wird nach dem Abstich je nach Zusammensetzung und Eigenschaft als wertvoller Rohstoff für verschiedenste Zwecke weitergenutzt. Neben der Erzeugung von Hüttensand, Hüttensteinen bzw. -bims und Schlackenwolle, wird sie auch zu Straßen- und Gleisschotter, Schlackensteinen, Portlandzement und Hochofenzement verarbeitet.
Das den Hochofen beim »Abstich« verlassende Eisen, das Roheisen, hat einen sehr hohen Kohlenstoffgehalt von etwa 4 bis 5 %. Außerdem enthält es bis zu 3 % Silicium und bis zu 6 % Mangan sowie geringe Mengen von Schwefel und Phosphor. Diese Begleitelemente machen Roheisen in kaltem Zustand sehr spröde, man kann es daher weder Schmieden, Walzen oder Schweißen.
Gusseisen kann eine graue oder weiße Bruchfläche besitzen. Überwiegt der Siliciumgehalt, wird sich nach dem Erkalten Grauguss ergeben, der eine graue Bruchfläche aufweist. Überwiegt Mangan, verbindet sich bei der Abkühlung im Roheisen der Kohlenstoff mit dem Eisen zu Eisencarbid (Fe3C). Es ergibt sich eine strahlige, weiße Bruchfläche (Weißes Roheisen). Das Produkt nach dem Erstarren ist Temperguss. Dieser wird nach dem Erstarren als Ledeburit nochmals einer Glühbehandlung (Tempern) unterzogen. Beim weißen Temperguss glüht man in einer Sauerstoff abgebenden Atmosphäre, wodurch den Gussstücken (zumindest im Randbereich) der Kohlenstoff entzogen wird. Dadurch nähern sich die Eigenschaften des Eisens denen des Stahls an.