31. Ionenverbindungen - Salze
Die Ionenbindung ist charakteristisch für Salze
Reagiert ein elektropositives Metall mit einem elektronegativen Nichtmetall, so entsteht unter Abgabe bzw. Aufnahme von Elektronen ein Salz. Beispielsweise:
- $ \mathrm { 2 \ Na + Cl_{2} \; \longrightarrow \; 2 \ NaCl } $ (Natriumchlorid)
- $ \mathrm { Fe + S \; \longrightarrow \; FeS } $ (Eisen(II)sulfid)
Zwischen den entgegengesetzt geladenen Ionen eines Salzes bestehen elektrostatische Anziehungskräfte, die man Coulombkräfte nennt. Sie wirken nach allen Seiten gleichmäßig, was zur Folge hat, dass sich die Ionen in bestimmter Weise räumlich anordnen. Diese räumliche Anordnung bezeichnet man im Allgemeinen als Kristallgitter. Bei den beiden Fällen oben handelt es sich um eine Ionengitter, da die Gitterpunkte von Ionen besetzt sind. Kristallgitter gibt es in sehr unterschiedlichen Erscheinungsformen. Die Lehre der Kristalle nennt man Kristallographie.
Erklärung anhand des Kochsalzgitters (ein Ionengitter)
Kochsalz (Natriumchlorid) besteht aus Natriumionen (Na+ positiv geladen) und Chloridionen (Cl–, negativ geladen). Zwischen ihnen bestehen elektrische Anziehungskräfte, da die Ionen eine entgegengesetzte Ladung besizten.
Die Anziehungskraft eines Natriumions wirkt gleichmäßig in alle Richtungen, es ist also nicht nur auf ein einzelnes Chloridion gerichtet. Umgekehrt verhält es sich genauso, auch das Chloridion wirkt in alle Richtungen. Na+ und Cl– schließen sich also nicht zu einzelnen Molekülen zusammen, sondern bilden riesige Verbände von Ionen, bei denen eine strenge Gesetzmäßigkeit vorherrscht. Man spricht von einem Ionengitter, in dem jedes Ion von einer bestimmten Anzahl entgegengesetzt geladener Ionen umgeben ist.
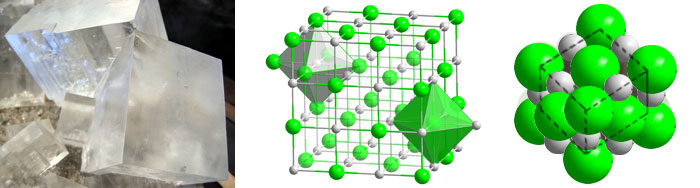
In einem Natriumchloridgitter ist ein Chloridion von 6 Natriumionen und ein Natriumion von 6 Chloridionen umgeben. Durch diese Regelmäßigkiet der Ionenanordnung entsteht ein Kristall. Beispielsweise bildet unser Speisealz Kristalle in Würfelform aus.
Die Formel von Ionischen Bindungen
Eine Ionenbindung liegt nicht in Form von Molekülen vor. Man schreibt zwar NaCl, doch damit meint man kein Molekül. In diesem Fall gibt diese Schreibweise an, dass sich im Ionengitter des Natriumchlorids Na+ und Cl– im gleichen Zahlenverhältnis verbunden haben. In einer chemischen Gleichung bedeutet die Formel NaCl 1mol Natriumchlorid, also 58,4 g Natriumchlorid, die aus 6,023 · 1023 Na+ und 6,023 · 1023 Cl– bestehen.
Auch Magnesiumoxid MgO bildet ein Ionengitter, das aus der gleichen Anzahl Mg2+ und O2– besteht. Im Ionengitter des Aluminiumoxid, Al2O3, liegen Al3+ und O2– im Zahlenverhältnis 2:3 vor.
Bei chemischen Verbindungen mit Atombindung (beispielsweise bei CH4 oder CO2) liegen aber im Unterschied zur Ionenbindung tatsächlich Moleküle vor. Die Formel CH4 drückt hier aus, dass das Methanmolekül aus einem Kohlenstoffatom und 4 Wasserstoffatomen besteht. Formeln für Molekülverbindungen drücken also aus, welche und wieviele Atome in einem Molekül einer Verbindung miteinander verbunden sind.
Die Gitterenergie
Entstehen freie Natrium- und Chloridionen, dann wirken zwischen den Ionen mit gleicher Ladung Abstoßungskräfte und zwischen den Ionen mit entgegengesetzter Ladung Anziehungskräfte.
Wenn aber nun die vormals freien Ionen gemäß ihrer Ladung und Größe ihre Plätze im Ionengitter eingenommen haben, so erreichen die Kräfte der Abstoßung und die Kräfte der Anziehung ein Minimum und es wird Energie frei.
| KCl | 687,16 | CaO | 3448,37 |
| CaCl2 | 2149,47 | MgS | 3310,10 |
| NaCl | 254,20 | MgO | 3825,47 |
Diese Energie, die beim Aufbau des Ionengitters abgegeben wird, nennt man Gitterenergie. Diese muß wieder aufgebracht werden, wenn man ein Ionengitter wieder in freie Ionen aufspalten will. Eine hohe Gitterenergie bedeutet also, dass zwischen Ionen große Anziehungskräfte bestehen. Wie die nachfolgende Tabelle über die Energiebilanz zeigt, wird bei der Bildung des Ionengitters aus Ca2+ und O2– sehr viel mehr Gitterenergie frei, als bei der Ausbildung des Kochsalzgitters. Im CaO - Kristall werden die Ionen also viel stärker zusammengehalten als im NaCl - Kristall. Allgemein gibt also die Gitterenergie Auskunft darüber, wie hoch das Bestreben ist, ein Ionengitter auszubilden.
Die Energiebilanz bei der NaCl-Synthese
Bei der Synthese von NaCl aus den Elementen laufen Vorgänge ab, die sowohl Energie verbrauchen, als auch Energie liefern.
| Vorgang (Reaktionsschritt) | Energieverbrauch in kJ/mol | Energiegewinn in kJ/mol |
|---|---|---|
| $ \mathrm {Na_{\mathsf \ fest} \; \longrightarrow \; Na_{\mathsf \ Dampf}} $ | 108,9 | — |
| $ \mathrm {Cl_2 \; \longrightarrow \; 2 Cl} $ | 113,1 | — |
| $ \mathrm {Na \; \longrightarrow \; Na^+ + e^–} $ | 494,4 | — |
| Natriumatom $ \longrightarrow $ Natriumion | ||
| $ \mathrm {Cl + e^– \; \longrightarrow \; Cl^–}$ | — | 364,5 |
| Chloratom $ \longrightarrow $ Chloridion | ||
| $ \mathrm {Na^+ + Cl^– \; \longrightarrow \; NaCl} $ | — | 754,2 |
| freie Ionen$ \longrightarrow $ Ionengitter | (Gitterenergie) | |
| Summe | 716,4 | 1118,7 |