73. Organische Chemie
Anorganische und Organische Chemie
Was sind organische Verbindungen? Der große schwedische Wissenschaftler J. J. Berzelius unterteilte am Anfang des 19. Jahrhunderts das gesamte Stoffgebiet der Chemie in den Bereich der Anorganischen Chemie und den Bereich der Organischen Chemie ("Lebewesenstoffe" der belebten Natur). Berzelius ging dabei nicht willkürlich vor, sondern untersuchte und verglich Stoffe aus der unbelebten Natur (Metalle, Salze, Mineralsäuren) und organische Verbindungen (Zucker, Essig, Alkohol).
Zu Lebzeiten Berzelius' glaubte man, dass organische Stoffe Naturstoffe seien, also von Organismen produzierte Verbindungen. Obwohl damals schon einige natürlich vorkommende, anorganische Stoffe durch Synthese künstlich erzeugt worden waren, dachte man, dass ein Aufbau organischer Verbindungen außerhalb des lebenden Organismus nicht möglich wäre. Es herrschte nämlich die Ansicht vor, nur durch das Wirken einer geheimnisvollen "Lebenskraft" (vis vitalis) erfolge in Lebewesen die Bildung organischer Stoffe. Es gelang nämlich nicht, Kohlenstoffverbindungen wie beispielsweise Soda oder Ameisensäure im Labor selbst herzustellen. Der Gedanke einer Lebenskraft war nicht neu. Bereits die alten Philosophen der Antike bewegte dieser Gedanke, verwarfen ihn aber alsbald, nur um ihn dann erneut wieder aufzugreifen.

In der zweiten Hälfte des 18. Jahrunderts begann C. W. Scheele mit genaueren Untersuchungen von Stoffen, die von Tieren oder Pflanzen stammten. So gewann er eine große Zahl organischer Verbindungen in reiner Form. Er isolierte die Zitronensäure aus Zitronen, die Milchsäure aus saurer Milch, die Harnsäure aus Blasensteinen und entdeckte, dass Glycerin ein Bestandteil tierischer Fette ist. Er stellte bald fest, dass alle diese "aus Organismen stammenden" Stoffe im Wesentlichen aus Kohlenstoff, Wasserstoff und Sauerstoff bestehen. Es gelang ihm aber nicht, für sie einfache Verhältnisformeln zu bestimmen. Auch Scheele hielt diese Stoffe wie viele seiner Kollegen für besonders kompliziert aufgebaut und so glaubte man weiterhin, dass sie nur von lebenden Zellen unter dem Einfluß einer besonderen Lebenskraft hergestellt werden könnten.

Diese Auffassung wurde dann im Jahre 1828 durch das Experiment eines Chemikers widerlegt. F. Wöhler gelang es, den damals als anorganisch gekennzeichneten Stoff Ammoniumcyanat (NH4OCN) durch Erhitzen in den als rein organsich geltenden Stoff Harnstoff zu überführen. Wöhler wiederholte seine Experimente wieder und wieder, bis er sicher war, einen organischen Stoff ganz ohne Lebenskraft hergestellt zu haben. An seinen Lehrer Berzelius schrieb er:
". . . ich kann sozusagen mein chemisches Wasser nicht halten und muss Ihnen erzählen, dass ich Harnstoff machen kann, ohne dazu Nieren oder überhaupt ein Thier, sey es Mensch oder Hund, nöthig zu haben. "
Mit Wöhlers Experimenten war die Lehre von der "Lebenskraft" erstmals widerlegt. Seine Versuche zeigten darüberhinaus, dass anorganische Stoffe in chemischer Hinsicht verhältnismäßig stabil sind, die organischen Verbindungen dagegen zeigen eine geringe Wärmebeständigkeit, gute Brennbarkeit, häufig leichte Flüchtigkeit, einen eigenartigen Geruch und meist geringe Wasserlöslichkeit.
Die Abgrenzung zwischen organischer und anorganischer Chemie verlor mit der Widerlegung der "Lebenskraft-Theorie" immer mehr ihre Berechtigung und es setzte sich die Überzeugung durch, dass für organische Verbindungen die gleichen chemischen Gesetzmäßigkeiten gelten wie für anorganischen Verbindungen. Trotzdem hält man bis heute an der von Berzelius vorgenommenen Zweiteilung der Chemie fest. Es zeigte sich nämlich, dass die organischen Verbindungen ausschließlich Kohlenstoffverbindungen sind. Darauf sind auch die gemeinsamen Merkmale der organischen Stoffe zurückzuführen. Die historische Bezeichnung »Organische Chemie« umfaßt im heutigen Sinne also die Chemie der Kohlenstoffverbindungen.
Elementaranalyse organischer Verbindungen
Als die Forscher des 19. Jahrhunderts organische Verbindungen analysierten, fanden sie am häufigsten die Elemente Kohlenstoff, Wasserstoff, Sauerstoff und Stickstoff. Auch Schwefel und Phosphor konnten sie nachweisen. Alle übrigen Elemente fanden sie aber nur selten. Die folgenden Versuche sollen zeigen, wie man bestimmte Elemente in organischen Verbindungen nachweisen kann.
Viele organische Verbindungen verkohlen bereits beim Erhitzen und sind damit als Kohlenstoffverbindungen zu erkennen.

$ \mathrm {\ + \ \text Sauertsoff \; \longrightarrow \text Kohlenstoffdioxid} $
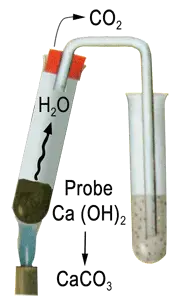
$ \mathrm {Ca(OH)_2 \ + \ CO_2 \; \longrightarrow \; CaCO_3 \downarrow \ + \ H_2O} $
$ \mathrm {\text Calciumhydroxid \; \longrightarrow \; \text Calciumcarbonat (weiße Trübung) }$
In leicht brennbaren organischen Substanzen ist der Kohlenstoffgehalt dadurch nachzuweisen, dass man die gasförmigen Verbrennungsprodukte in eine Lösung von Calciumhydroxid (»Kalkwasser«) leitetDas Element-Symbol mit den gelben Kästchen soll eine organische Verbindung darstellen

$ \mathrm {\ + \ \text Sauersoff \; \longrightarrow \text Wasser }$
Hält man über eine brennende organische Verbindung ein trockenes Becherglas, so beschlägt sich dieses mit Wasser. Diese Beobachtung gilt als einfacher Wasserstoffnachweis.

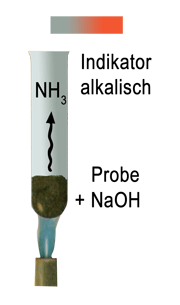
$ {\mathrm \ + \ \ \; \overset {NaOH} \longrightarrow \text Ammoniak }$
$ \mathrm {NH_3 \ + \ H_2O \; \longrightarrow \; NH_4^+ \ + \ OH^- (Hydroxidion) } $
$ \mathrm {\text Ammoniak \; \longrightarrow \; Ammoniumion + \ Hydroxidion \ (\rightarrow \text Indikatorreaktion)} $
Zum Stickstoffnachweis erhitzt man vorsichtig die organische Substanz mit Natriumhydroxid und prüft die entweichenden Dämpfe mit Indikatorpapier. Bei Anwesenheit von Stickstoff entweicht bei diesem Verfahren Ammoniak, der die alkalische Reaktion verursacht.

$ \mathrm \ \ {\overset {Hitze} \longrightarrow \ \ \text{Schwefelwasserstoff}} $
$\mathrm {H_2S \ + \ Pb_2 \longrightarrow 2 H^+ + PbS \ \downarrow}$
Schwefel kann mit einer Bleisalzlösung nachgewiesen werden. Schon beim Erhitzen schwefelhaltiger organischer Verbindungen entweicht häufig Schwefelwasserstoff, der mit $Pb_2^+$ schwarzes Bleisulfid bildet.

$ \;\; \mathrm {Cl+Cu \overset {Glühen} \longrightarrow \ {grüne \ Flamme}}$
Wenn man ein ausgeglühtes Kupferblech in eine Stoffprobe taucht und erneut in die Flamme hält, so färbt sich diese bei Anwesenheit von Halogenen grün:
| Versuch 6 | Versuch 7 | Versuch 8 | Versuch 9 |
 |
 |
 |
 |
| Nachweis von C und H | Nachweis von N | Nachweis von S | Nachweis von Halogen |