80. Alkane - Reaktionstyp Substitution
Begriff Substitution
In der Chemie bezeichnet die Substitution (spätlateinisch substituere: ersetzen) eine chemische Reaktion, bei der Atome oder Atomgruppen in einem Molekül durch ein anderes Atom oder eine andere funktionelle Gruppe (oder auch Substituenten) ersetzt werden
Ersatz von Wasserstoffatomen
Neben Oxidationsvorgängen ist für Alkane der Reaktionstyp der Substitution kennzeichnend (Versuch 1).
Bestrahlt man eine Brom-Hexan-Mischung mit energiereichem Licht, so entweicht ein stechend riechendes, farbloses Gas, das in feuchter Luft Nebel bildet. Wenn man das Gas auf eine Lackmuslösung leitet, dann zeigt die Rotfärbung die Anwesenheit von Wasserstoff-Ionen an. Leitet man das Gas auf Silbernitratlösung, dann weist ein ausfallender gelblicher Niederschlag (Silberbromid) auf das Gas Bromwasserstoff hin. Die Reaktion ist verständlich, da von den Reaktionspartnern nur Hexan Wasserstoff enthält.
Die Wasserstoffatome des Hexans wurden also durch Bromatome ersetzt. Nach folgendem Reaktionsmechanismus spaltet die Lichtenergie die Brommoleküle in einzelne Bromradikale:
$ \mathrm {Br \; – \ Br \ \xrightarrow{Licht} \ 2 \ Br \ \cdotp} $
Die Bromradikale entreißen dann dem Hexan ein Wasserstoffatom. Es entsteht ein Radikal:
$ \mathrm { H \; – \ {\overset {\large H} {\overset {|} {\underset {\large H} {\underset {|} C}}}} \; – \ {\overset {\large H} {\overset {|} {\underset {\large H} {\underset {|} C}}}} \; – \ {\overset {\large H} {\overset {|} {\underset {\large H} {\underset {|} C}}}} \; – \ {\overset {\large H} {\overset {|} {\underset {\large H} {\underset {|} C}}}} \; – \ {\overset {\large H} {\overset {|} {\underset {\large H} {\underset {|} C}}}} \; – \ {\overset {\large H} {\overset {|} {\underset {\large H} {\underset {|} C}}}} \; – \; H + Br \ \cdotp \; \longrightarrow \; \underbrace { H \; – \; {\overset {\large H} {\overset {|} {\underset {\large H} {\underset {|} C}}}} \; – {\overset {\large H} {\overset {|} {\underset {\large H} {\underset {|} C}}}} \; – {\overset {\large H} {\overset {|} {\underset {\large H} {\underset {|} C}}}} \; – {\overset {\large H} {\overset {|} {\underset {\large H} {\underset {|} C}}}} \; – {\overset {\large H} {\overset {|} {\underset {\large H} {\underset {|} C}}}} \; – {\overset {\large H} {\overset {|} {\underset {\large H} {\underset {|} C}}}} \ \cdotp }_{Hexylradikal} \underbrace {+ H \; – \; Br}_{Bromwasserstoff} }$
Das Hexylradikal kann nun weitere Brommoleküle spalten:
$ \mathrm { H \; – \ {\overset {\large H} {\overset {|} {\underset {\large H} {\underset {|} C}}}} \; – \ {\overset {\large H} {\overset {|} {\underset {\large H} {\underset {|} C}}}} \; – \ {\overset {\large H} {\overset {|} {\underset {\large H} {\underset {|} C}}}} \; – \ {\overset {\large H} {\overset {|} {\underset {\large H} {\underset {|} C}}}} \; – \ {\overset {\large H} {\overset {|} {\underset {\large H} {\underset {|} C}}}} \; – \ {\overset {\large H} {\overset {|} {\underset {\large H} {\underset {|} C}}}} \cdotp + Br \ – \ Br \ \longrightarrow \ Br \cdotp + \underbrace { H \; – \ {\overset {\large H} {\overset {|} {\underset {\large H} {\underset {|} C}}}} \; – \ {\overset {\large H} {\overset {|} {\underset {\large H} {\underset {|} C}}}} \; – \ {\overset {\large H} {\overset {|} {\underset {\large H} {\underset {|} C}}}} \; – \ {\overset {\large H} {\overset {|} {\underset {\large H} {\underset {|} C}}}} \; – \ {\overset {\large H} {\overset {|} {\underset {\large H} {\underset {|} C}}}} \; – \ {\overset {\large H} {\overset {|} {\underset {\large H} {\underset {|} C}}}} \; – \ Br }_{1-Monobromhexan} } $
Die vereinfachte Gesamtgleichung lautet also:
$ \mathrm { \underbrace { H \; – \ {\overset {\large H} {\overset {|} {\underset {\large H} {\underset {|} C}}}} \; – \ {\overset {\large H} {\overset {|} {\underset {\large H} {\underset {|} C}}}} \; – \ {\overset {\large H} {\overset {|} {\underset {\large H} {\underset {|} C}}}} \; – \ {\overset {\large H} {\overset {|} {\underset {\large H} {\underset {|} C}}}} \; – \ {\overset {\large H} {\overset {|} {\underset {\large H} {\underset {|} C}}}} \; – \ {\overset {\large H} {\overset {|} {\underset {\large H} {\underset {|} C}}}} \; – H }_{Hexan} + Br_2 \ \longrightarrow \ HBr + \underbrace { H \; – \ {\overset {\large H} {\overset {|} {\underset {\large H} {\underset {|} C}}}} \; – \ {\overset {\large H} {\overset {|} {\underset {\large H} {\underset {|} C}}}} \; – \ {\overset {\large H} {\overset {|} {\underset {\large H} {\underset {|} C}}}} \; – \ {\overset {\large H} {\overset {|} {\underset {\large H} {\underset {|} C}}}} \; – \ {\overset {\large H} {\overset {|} {\underset {\large H} {\underset {|} C}}}} \; – \ {\overset {\large H} {\overset {|} {\underset {\large H} {\underset {|} C}}}} \; – \ Br }_{1-Monobromhexan} } $
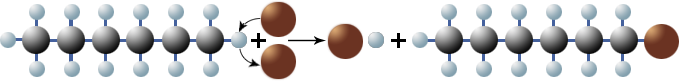
Die oben beschriebene Reaktion läuft so lange weiter, bis alles Brom verbraucht ist. Die Lösung wird dadurch farblos. Bei Bromüberschuß könnten sogar alle Wasserstoffatome des Hexans durch Bromatome ersetzt werden. In der Chemie heißt es: Die Wasserstoffatome werden substituiert. Wenn in der Chemie Atome oder Atomgruppen durch andere Atome oder Atomgruppen ersetzt werden, nennt man dies Substitution.
Wenn man man ein Gemisch aus Methan und Chlor einer Höhensonne oder dem Sonnenlicht aussetzen würde, dann würde die Reaktion explosionsartig ablaufen. Wiederum entstehen durch die Lichtenergie Radikale:
$ \mathrm { Cl \; – \ Cl \ \xrightarrow{Licht} \ 2 \ Cl \cdotp } $
Die Chlorradikale können nach und nach die Substitution der Wasserstoffatome des Methans hervorrufen:
$ \mathrm {\underbrace { H \; – \ {\overset {\Large H} {\overset {|} {\underset {\Large H} {\underset {|} C}}}} \; – \ H } _{Methan} \ \ + Cl \ \cdotp \quad \longrightarrow \quad HCl + {\underbrace {H \; – \ {\overset {\Large H} {\overset {|} {\underset {\Large H} {\underset {|} C}}}} \ \cdotp}_{Methylradikal}} }$
$ \mathrm { {\underbrace { H \; – \ {\overset {\Large H} {\overset {|} {\underset {\Large H} {\underset {|} C}}}} \ \cdotp}_{Methan}} \ + \ Cl_2 \quad \longrightarrow \quad Cl \cdotp \ + \ {\underbrace {H \; – \ {\overset {\Large H} {\overset {|} {\underset {\Large H} {\underset {|} C}}}} \; – \ Cl}_{Monochlormethan \ oder \\ \href{/KnowHow/Methylchlorid}{Methylchlorid}}} }$
Entsprechend bilden sich:
$ \mathrm {\underbrace { H \; – \ {\overset {\Large Cl} {\overset {|} {\underset {\Large Cl} {\underset {|} C}}}} \; – H}_{Dichlormethan \\ oder \ \href{/KnowHow/Methylenchlorid}{Methylenchlorid} } }$
$ \mathrm {\underbrace { H \; – \ {\overset {\Large Cl} {\overset {|} {\underset {\Large Cl} {\underset {|} C}}}} \; – Cl}_{Trichlormetan \ oder \\ \href{/KnowHow/Chloroform}{Chloroform}} }$
$ \mathrm {\underbrace { Cl \; – \ {\overset {\Large Cl} {\overset {|} {\underset {\Large Cl} {\underset {|} C}}}} \; – Cl}_{\href{/KnowHow/Tetrachlormethan}{Tetrachlormethan} \ oder \\ Tetrachlorkohlenstoff} }$
Allgemeine Reaktionsfähigkeit
Das reaktionsträge Verhalten der Alkane gegenüber chemisch so aggressiven Substanzen wie Salzsäure, Natronlauge oder Kaliumpermanganat (ein starkes Oxidationsmittel) kennzeichet diese Verbindungen als recht stabil. Sie zeigen kaum ein Bestreben (»parum affinis») Reaktionen einzugehen und hießen deshalb früher Paraffine.