106. Ester - Entstehung, Vorkommen
Ester und Wachse
Die Bezeichnung „Ester“ wurde von dem Chemiker Leopold Gmelin im Jahre 1850 aus dem Begriff „Essigäther“, einem historischen Namen für Ethylacetat, gebildet. Ester sind Abkömmlinge von Carbonsäuren (Carbonsäureester) mit der funktionellen Gruppe —COOR. Sie setzen sich aus einem Säureteil und einem Alkoholteil zusammen.

Die Benennung von Estern ist auf zwei Arten möglich: Entweder man nennt zuerst den Alkoholrest und hängt dann die Endung -at an den Wortstamm des Säurerestes an oder man nennt erst die Säure, dann den Wortstamm des Alkoholrestes und schließlich die Endung -ester. Ethylacetat und Essigsäureethylester sind also ein und dasselbe.
Ester können - je nachdem, ob nieder- oder hochmolekulare Carbonsäurereste vorliegen - entweder flüssig oder fest sein. Sie finden in den unterschiedlichsten Bereichen Verwendung. Beispielsweise sind viele Wirkstoffe in pharmazeutischen Erzeugnissen Ester und Ester sorgen bei der Herstellung von Parfüms für die verschiedensten angenehmen Gerüche. Außerdem werden Ester als Aromastoffe eingesetzt und sind in Allesklebern enthalten.
Die Esterbildung
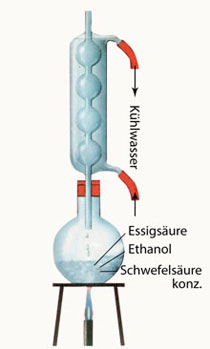
Wenn man eine wässrige Säurelösung langsam mit einem Alkohol versetzt, dann nimmt die ursprünglich von den Säurerest-Ionen und den hydratisierten Protonen verursachte elektrische Leitfähigkeit langsam ab (Kapitel 103). Bei gleichbleibender Temperatur erreicht die Leitfähigkeit schließlich einen typischen Grenzwert, der erhalten bleibt.
Zwischen der Säure und dem Alkohol ist also eine chemische Reaktion abgelaufen. Dabei ist aus Säure und Alkohol in einer Gleichgewichtsreaktion Ester und Wasser entstanden:
$ \mathrm { \underbrace { {H \ – \ {\overset {\Large H}{\overset | {\underset {\Large H}{\underset | C}}}} \ – \ {\overset {\Large O}{\overset {||} C}} \ – \ \boxed { \ O \ – \ H + H \ } \ – \ O \ – \ {\overset {\Large H}{\overset | {\underset {\Large H}{\underset | C}}}} \ – \ {\overset {\Large H}{\overset | {\underset {\Large H}{\underset | C}}}} \ – \ H \ }}_{Essigsäure \ + \ Ethanol} {\large \leftrightharpoons} \ \underbrace {H \ – \ {\overset {\Large H}{\overset | {\underset {\Large H}{\underset | C}}}} \ – \ {\overset {\Large O}{\overset {||} C}} \ – \ O \ – {\overset {\Large H}{\overset | {\underset {\Large H}{\underset | C}}}} \ – \ {\overset {\Large H}{\overset | {\underset {\Large H}{\underset | C}}}} \ – \ H}_{Essigsäureester} + H_2O }$
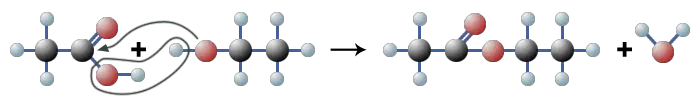
Die Esterbildung ist eine Kondensation. In der Chemie versteht man darunter eine Substitutionsreaktion, bei der sich zwei Moleküle unter Abspaltung eines einfachen Moleküls, meist Wasser, aber auch Ammoniak, Kohlenstoffdioxid, Chlorwasserstoff und andere sind möglich - zu einem größeren Molekül verbinden.
Die allgemeine Formel für Carbonsäureester lautet: R—COO—R. Sie enthalten also die folgende charakteristische Gruppe:
$ \mathrm { \ — \ {\overset {\Large O}{\overset {||} C}} \ — \ C \ — }$
$ \mathrm { \ — \ {\overset {\Large O}{\overset {||} C}} \ — \ C \ — }$
Ein Alkohol mit mehreren Hydroxygruppen, wie der dreiwertige Alkohol Glycerin, kann sich mit jeder OH-Gruppe an der Esterbildung beteiligen. Beispielsweise:
Veresterung des Glycerins mit Salpetersäure:
$ \mathrm {
\begin{array}{lll}
\mathrm {CH_2OH} \\
\; | \\
\mathrm {CHOH} \ + \ \\
\; | \\
\mathrm {CH_2OH}
\end{array}
\
\begin{array}{lll}
\mathrm {HONO_2} \\
\; \\
\; \\
\mathrm {HONO_2} \\
\; \\
\; \\
\mathrm {HONO_2} \\
\end{array}
\quad
{\large \leftrightharpoons}
\quad
\begin{array}{lll}
\mathrm {CH_2ONO_2} \\
\; | \\
\mathrm {CHONO_2} \ \ + 3 \mathrm {H_2O} \\
\; | \\
\mathrm {CH_2ONO_2}
\end{array}
}$
Glycerin Salpetersäure Trisalpetersäureglycerinester
Veresterung des Methanols mit Borsäure:
$ \mathrm {
{\overset { \quad \ \quad { \Large OH}} {\overset {\quad \ \diagup \!\!\! }
{\underset {\quad \quad {\Large OH} }
{\underset {\quad \diagdown}
B }}}} \!\!\!\!\!\!\!\!\! — OH
+
\begin{array}{lll}
\mathrm {HOCH_3} \\
\ \\
\mathrm {HOCH_3} \\
\ \\
\mathrm {HOCH} \\
\end{array}
\ {\large \leftrightharpoons} \!\!\!\!\!\!\!\!\!\!\!\!\!\!\!\!\!\!\!\!\!
{\overset { \qquad \ \ \qquad \;\;\;\;\;\; { \Large OCH_3}} {\overset {\qquad \ \diagup \!\! }
{\underset {\qquad \qquad \;\;\;\; {\Large OCH_3} }
{\underset {\qquad \diagdown}
B }}}} \!\!\!\!\!\!\!\!\!\!\!\!\!\!\!\!\!\!\!\!\!\!\! — OCH_3 + 3 \ H_2O
}$
Borsäure Methanol Borsäuretrimethylester
Allgemein gilt:
$ \mathrm { Säure + Alkohol \ {\large \leftrightharpoons} \ Ester + Wasser }$
Duft- und Aromastoffe, Fette und Wachse
Als Duft- und Aromastoffe haben Ester eine große Bedeutung - sowohl natürlich als auch künstlich erzeugt. Wenn sich niedere oder mittlere Alkohole mit Säuren verbinden, dann entstehen Ester, die angenehm fruchtig schmecken oder nach Blumen duften.

In vielen Nahrungsmitteln und fast allen Früchten sind Ester die Hauptverantwortlichen für die fruchtigen Aromen. Einige Ester riechen deutlich wie bestimmte Früchte, andere kann man zumindest als „fruchtartig“ beschreiben. Birnenaroma läßt sich durch die Veresterung von Essigsäure mit dem übel riechenden 1-PentanolC5H11OH herstellen. Eine Himbeeressenz enthält als Aromakomponente nicht weniger als 9 verschiedene Ester. Sogar die unangenehm stinkende Buttersäure kann man durch Veresterung in einen angenehmen Duftstoff verwandeln. Die Tabelle unten zeigt, wie Ester als Reaktionsprodukte unterschiedlicher Alkohole mit verschiedenen Säuren duften.

Fette sind die wichtigsten natürlichen Ester. Bei den Fetten handelt es sich um Verbindungen des Glycerins mit mittleren und höheren Fettsäuren. Ester aus höheren, einwertigen Alkoholen und Fettsäuren sind Wachse. Tierische und pflanzliche Wachse sind den Fetten und Ölen in physikalischer Hinsicht sehr ähnlich. Das bekannteste Wachs ist das Bienenwachs aus den Drüsen der Honigbiene. Es besteht zu etwa 75% aus komplexen Wachs-Estern. Größter Verbraucher von Bienenwachs ist die kosmetische und pharmazeutische Industrie, wo es Bestandteil von Cremes, Salben, Pasten, Lotionen und Lippenstiften ist. Die Produkte sind meist mit dem Hinweis „Enthält Echtes Bienenwachs“ versehen. Hauptbestandteil des Bienenwachses ist ein Ester mit der Zusammensetzung CH3—(CH2)14—COOC30H61, den man Myricylpalmitat nennt. Dabei handelt es sich um den Ester der Palmitinsäure mit Myricylalkohol.
| Alkohol | Säure | Geruch | Verwendung des Esters |
|---|---|---|---|
| Methanol | Propansäure | fruchtiger Geruch | vielseitige Verwendung |
| Methanol | Buttersäure | nach Äpfeln | Aromastoff |
| Methanol | Benzoesäure | herb-fruchtig, nach Nelke | Ausgangsstoff für die Parfümherstellung |
| Ethanol | Essigsäure | angenehm | Aromastoff für Liköre, Limonaden, Bonbons |
| Ethanol | Propansäure | nach Rum | Aromastoff |
| Ethanol | Buttersäure | nach Ananas | Aromastoff |
| Ethanol | Benzoesäure | nach Birnen | Aromastoff |
| Propanol | Buttersäure | nach Erdbeeren | Aromastoff |
| Propanol | Benzoesäure | blumig nach Jasmin | Aromastoff |