114. Aminosäuren - saure und basische Eigenschaften
Was sind Aminosäuren?
Fossilfunde von primitivsten Lebensformen in australischen Gesteinen bezeugen, dass es auf unserer Erde bereits vor über 3 Milliarden Jahren Aminosäuren gegeben haben muß. Aber auch in Meteoriten und Mondgestein sind sie nachgewiesen worden. Mit dem Begriff Aminosäure bezeichnet man rund 20 Carbonsäuren, aus denen sich die Moleküle des Lebens, die Proteine, zusammensetzen.
| Name | Formel | Bedeutung |
|---|---|---|
| Glycin | CH2NH2COOH | ist am Aufbau lebenswichtiger Enzyme beteiligt |
| Alanin | CH3CHNH2COOH | u.a. Baustein des Seidenproteins |
| Valin* | (CH3)2CHCHNH2COOH | wichtig für Nerven- und Muskeltätigkeit |
| Leucin* | (CH3)2CHCH2CHNH2COOH | aktiviert das Hormonsystem |
| Asparaginsäure | HOOC—CHNH2CH2COOH | in vielen Eiweißstoffen verbreitet (Spargel) |
| Glutaminsäure | HOOC—CHNH2CH2CH2COOH | aktiviert die Tatigkeit der Gehirnzellen |
| Lysin* | CH2NH2(CH2)3CHNH2COOH | fördert die Knochenbildung |
| Phenylalanin* | C6H5—CH2CHNH2COOH | Verbreitet, besonders häufig im Blut |
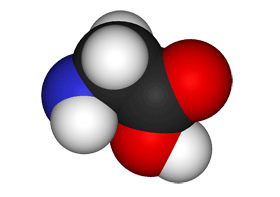
Wenn man Aminosäuren unter Anwesenheit einer Lauge erwärmt, dann wird wie bei Ammoniumsalzen die Verbindung Ammoniak (NH3) frei. Am Aufbau der Aminosäuren ist also das Element Stickstoff beteiligt, das sich in der funktionellen Gruppe, der Aminogruppe (NH2-Gruppe), befindet. Aminosäuren sind also Carbonsäuren, in denen ein oder mehrere Wasserstoffatome des Alkylrestes durch die Aminogruppe ersetzt sind. Die einfachste Aminosäure ist die Aminoessigsäure:
$ \mathrm { H_2N \ – \ CH_2 \ – \ COOH \quad }$ oder $ \quad \mathrm { H \ – \ {\overset {\Large H}{\overset {\mid} {\underset {—} N }}} \ – \ {\overset {\Large H}{\overset {\mid} {\underset {\Large H}{\underset {\mid} C}}}} \ – \ \!\!\!\!\!\!\!\!\!\!\!\!\! {\overset { \qquad \qquad { \Large O}} {\overset {\qquad \ \diagup \!\! \diagup } {\underset {\qquad \qquad {\Large OH} } {\underset {\qquad \diagdown }C }}}} }$
Ausgehend von der Carboxygruppe–COOH bezeichnet man die Stellung der Aminogruppe im Alkylrest mit α, β, γ usw.
α-Aminopropansäure (Alanin)
$ \mathrm { CH_3 \ – \ {\overset {\Large \alpha}{\overset {\Large \ } {\underset {\Large \ \ NH_2}{\underset \mid {CH}}}}} \ – \ COOH }$
β-Aminopropansäure
$ \mathrm { H_2N \ – \ {\overset {\Large \beta} {\overset {\Large \ } {CH_2}}} \ – \ {\overset {\Large \alpha} {\overset {\Large \ } {CH_2}}} \ – \ COOH }$
Die besonderen Eigenschaften der Aminosäuren
Anders als Carbonsäuren sind Aminosäuren feste Stoffe mit hohen Schmelzpunkten. Sie sind in Wasser gut löslich, in organischen Lösemitteln dagegen nur schwer. Diese Eigenschaften kennt man auch von Salzen, die aber aus entgegengesetzt geladenen Ionen bestehen. Wie kann man diese Feststellungen nun mit den Strukturformeln von oben in Einklang bringen? Wenn Aminoessigsäure auf Magnesium einwirkt, bildet sich Wasserstoff. Dies weist auf den Säurecharakter (Carboxygruppe) hin:
$ \mathrm { 2 \ CH_2NH_2 \ – \ COOH + Mg \ \longrightarrow \ (CH_2NH_2COO)_2Mg + H_2 \ \uparrow }$
Nun scheint aber die geringe Änderung der elektrischen Leitfähigkeit und die Reaktion mit Indikatorpapier dem zu widersprechen. Schaut man sich aber die Molekülstruktur an, so liegt die Lösung auf der Hand: Das Molekül enthält in der Carboxygruppe einen Protonendonator (Säure!) und in der Aminogruppe einen Protonenakzeptor (Base wie NH3).
Säurenatur:
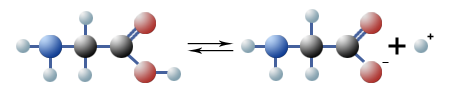
$ \mathrm { H_2N \ – \ CH_2 \ – \ COOH \quad {\overset {H_2O} {\large \leftrightharpoons}} \quad H_2N \ – \ CH_2 \ – \ COO^-_{(aq)} + H^+_{(aq)} }$
Basennatur:
$ \mathrm { H^+_{(aq)} + H \ – \ {\overset {—}{\overset { \ } {\underset {\Large H} {\underset {\mid} N}}}} \ – \ CH_2 \ – \ COOH \ {\large \leftrightharpoons} \ H \ – \ {\overset {\!\!\!\! \Large H} {\overset { \!\!\!\! \mid} {\underset {\!\!\!\! \Large H} {\underset { \!\!\!\! \mid}{N^+}}}}} \ – \ CH_2 \ – \ COOH_{(aq)} }$
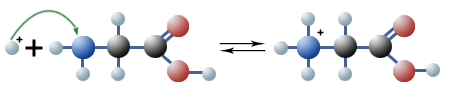
Aufgrund der stets gleichzeitig vorhandenen Säuregruppe (—COOH) und Aminogruppe (—NH2) sind Aminosäuren sind also in der Lage, Protonen abzuspalten und auch aufzunehmen. Solche Verbindungen nennt man amphoter: Sie können sowohl als Säuren als auch als Basen wirken. Im Wasser kommt es daher vorwiegend zu einer innermolekularen Neutralisation.
$ \mathrm { H_2N \ – \ \ CH_2 \ – \ COOH \quad {\overset {H_2O} {\large \leftrightharpoons}} \quad H_3N^+ \ – \ CH_2COOH^-_{(aq)} }$
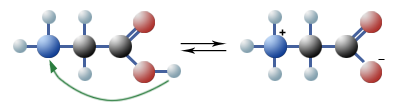
Weil das gebildete Ion sowohl eine positive als auch eine negative Ladung trägt, wird es »Zwitterion« genannt. Damit wird auch das Verhalten der Aminosäuren zu Indikatoren und im elektrischen Feld verständlich.
Trennung und Nachweis von Aminosäuren
Versuch 6 zeigt das Prinzip der Dünnschichtchromatografie, einer Methode, mit der man neben vielen anderen Substanzen auch Aminosäuren trennen und nachweisen kann.
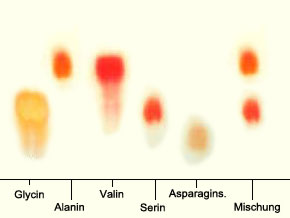
Das Grundprinzip der Chromatographie beruht in unserem Fall auf der verschiedenen Geschwindigkeit, mit der sich Aminosäuren in einer Schicht von Kieselgel oder Cellulose bewegen. So zeigt sich nach dem Besprühen von Ninhydrin, dass die Aminosäuren verschieden lange Strecken vom Startpunkt aus "gewandert" sind. Diese Strecken sind - unter gleichen Voraussetzungen - für jede Aminosäure typisch und erlaubt eine eindeutige Unterscheidung bei geringem Zeitaufwand.