74. Der Kohlenstoff
Vorkommen und Bedeutung
Kohlenstoff kommt in der Natur sowohl in gediegener (reiner) Form (Diamant, Graphit) als auch chemisch gebunden (z. B. in Form von Carbonaten, Kohlenstoffdioxid, Erdöl, Erdgas und Kohle) vor. Aufgrund seiner besonderen Elektronenkonfiguration (halbgefüllte L-Schale) besitzt Kohlenstoff die Fähigkeit zur Bildung von komplexen Molekülen und weist von allen chemischen Elementen die größte Vielfalt an chemischen Verbindungen auf. Somit ist Kohlenstoff ist ein essentielles Element der Biosphäre, es ist in allen Lebewesen – nach Sauerstoff (Wasser) – dem Gewicht nach das bedeutendste Element. Alles lebende Gewebe ist aus (organischen) Kohlenstoffverbindungen aufgebaut, sie sind die molekulare Grundlage allen irdischen Lebens.
Atombau und Bindungsverhalten des Kohlenstoffatoms
Der Kohlenstoff steht im Periodensystem in der 4. Hauptgruppe (Kohlenstoffgruppe) und in der 2. Periode, was bedeutet, dass er in der 2. Hauptschale 4 Elektronen besitzt. Wie wir wissen, kommt es zu chemischen Bindungen durch das Bestreben der Atome, stabile Elektronenhüllen zu bilden, wie es bei den Edelgasen der Fall ist. Der Kohlenstoff erreicht also eine Edelgasschale, indem er sich mit anderen Atomen verbindet (Atombindung). Hierbei haben sich bindende Atome gemeinsame Elekronenpaare (»Elektronenpaarbindung«).
| Wasserstoff | Wasser | Ammoniak | Tetrachlorkohlenstoff |
| H2 | H2O | NH3 | CCl4 |

Modifikationen des Kohlenstoffatoms
Kohlenstoff kristallisiert als Diamant oder Graphit. Diamant ist der härteste natürliche Stoff. In der Härteskala nach Mohs hat er die Härte 10. Seine Schleifhärte nach Rosiwal (auch absolute Härte) ist 140-mal größer als die des Korund. Die Härte des Diamanten ist allerdings in verschiedenen Kristallrichtungen unterschiedlich (Anisotropie). Dadurch ist es möglich, Diamant mit Diamant zu schleifen. In dem dazu verwendeten Diamantpulver liegen die Kristalle in jeder Orientierung vor (statistische Isotropie), damit wirken immer auch die härtesten unter ihnen auf den zu schleifenden Körper.

Im Diamant ist jedes Kohlenstoffatom von vier weiteren Kohlenstoffatomen umgeben, die an den Ecken eines Tetraeders ausgerichtet sind. Die Bindungsart zwischen den Kohlenstoffatomen ist die Atombindung, wodurch sie stabile Elektronenschale des Edelgases Neon erreichen. Die Tetraederstruktur ist die stabilste Anordnung von vier Atomen um ein Kohlenstoffatom. Diese Tetraederstruktur gibt es in sehr vielen organischen Verbindungen.
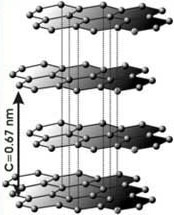
Graphit ist eine der natürlichen Erscheinungsformen des chemischen Elements Kohlenstoff in Reinform. Im Graphit ist jedes Kohlenstoffatom von drei weiteren Kohlenstoffatomen umgeben, daher kristallisiert er meist im hexagonalen, sehr selten auch im trigonalen Kristallsystem. Für die Elektronenpaarbindung eines Kohlenstoffatoms an drei weitere Atome werden nur drei der vier Valenzelektronen eines C-Atoms benötigt. Von jedem Kohlenstoffatom bleibt somit ein Elektron übrig, das leicht beweglich ist und - ähnlich wie das »Elektronengas« der Metalle - die Wärme und Stromleitfähigkeit des Graphits bewirkt.
Graphit entwickelt undurchsichtige, graue bis schwarze Kristalle in sechseckiger, tafeliger, schuppiger oder stegeliger Form, die auf den Kristallflächen Metallglanz aufweisen. Massige oder körnige Aggregate sind dagegen matt. Das ebene Sechseck, in dem sechs C-Atome wie im Graphit miteinander verbunden sind, findet sich ebenfalls häufig bei organischen Verbindungen. Die Mohshärte des Graphits beträgt zwischen 1 und 2, seine Dichte etwa 2,1 bis 2,3 g/cm³, und er hat eine grauschwarze Strichfarbe.