77. Die homologe Reihe der Alkane
Begriffe
Im Erdgas sind neben dem Methan noch weitere Gase enthalten: Ethan, Propan und Butan. Diese Gase bilden zusammen die ersten vier Verbindungen in der Gruppe der Alkane. Wenn man im Methanmolekül ein Wasserstoffatom durch ein weiteres Kohlenstoffatom ersetzt und dieses wieder vollständig mit Wasserstoff absättigt, entsteht der Kohlenwasserstoff Ethan. Im Gegensatz zum Methan hält es zwei Kohlenstoffatome im Molekül. Es besteht also aus C2H6-Molekülen, wobei die beiden Kohlenstoffatome durch eine Einfachbindung verknüpft sind.
Alle Bindungen, die von jedem Kohlenstoffatom ausgehen, sind wie beim Methan in einem Tetraederwinkel angeordnet. Wie beim Methan kann auch beim Ethan ein Wasserstoffatom durch eine CH3- Gruppe ersetzt werden. Dabei entsteht das Gas Propan. Wenn man diesen Vorgang wiederholt, so erhält man die Anfangsglieder einer Reihe, die sich beliebig fortsetzen lässt, wobei sich die aufeinanderfolgenden Glieder jeweils durch eine CH2-Gruppe unterscheiden.
$ \mathrm { H –{ \overset H {\overset {|} { \underset H {\underset {|}{C}}}}} –{ \overset H {\overset {|} { \underset H {\underset {|}{C}}}}} –{ \overset H {\overset {|} { \underset H {\underset {|}{C}}}}} –H \ = \ C_3H_6 }$

$ \mathrm { H –{ \overset H {\overset {|} { \underset H {\underset {|}{C}}}}} –{ \overset H {\overset {|} { \underset H {\underset {|}{C}}}}} –H \ = \ C_2H_6 }$
Zur Benennung der höheren Alkane (ab dem Pentan) verwendet man griechische Zahlwörter und hängt die Endung -an an. Alkane mit 5, 6, 7, 8, 9 oder 10 Kohlenstoffatomen heißen entsprechend Pentan, Hexan, Heptan, Octan, Nonan, Decan.
| Zahl | griechisch | Gebrauchsform | Zahl | griechisch | Gebrauchsform |
|---|---|---|---|---|---|
| eins | monos | mono- | sechs | hex | hexa- |
| zwei | düo | di- | sieben | hepta | hepta- |
| drei | treis | tri | acht | okto | octo- |
| vier | tettares | tetra- | neun | ennea | nona- |
| fünf | pente | penta- | zehn | deka | deca- |
Ausgehend vom Methanmolekül lassen sich die übrigen Alkane durch Einfügen von jeweils einer CH2- Gruppe aufbauen. Die vier Gase Methan, Ethan, Propan und Butan bilden dabei die Anfangsglieder einer langen Reihe von Kohlenstoff-Wasserstoffverbindungen, die alle der allgemeinen Summenformel CnH2n+2 entsprechen. Für ein beliebiges Glied dieser Reihe gilt also, dass auf n Kohlenstoffatome 2n Wasserstoffatome treffen. Anfang und Ende einer solchen Kette bilden jeweils weitere Wasserstoffatome.
Eine solche Reihe von Verbindungen, deren aufeinander folgende Glieder sich in ihren Molekülformeln um jeweils eine CH2- Gruppe unterscheiden, bezeichnet man als homologe Reihe. Baut man fortwährend CH2- Gruppen in ein Alkanmolekül ein, so gelangt man von Butan über das Pentan zum Hexan usw. und damit zu immer längeren Molekülen. Verbindungen zwischen Kohlenstoff und Wasserstoff, bei denen die Sättigungsmöglichkeit mit Wasserstoff voll ausgenutzt ist, heißen Alkane oder gesättigte Kohlenwasserstoffe.
Wenn man einem Alkan ein Wasserstoffatom entzieht, erhält man einen Alkylrest, der durch ein ungepaartes Elektron gekennzeichnet ist. Alkylgruppen kommen in sehr vielen Molekülen vor, insbesondere in den den Alkanen. Die Endung des betreffenden Alkans -an wird durch die Endung -yl ersetzt. Die einfachsten Alkylgruppen sind Alkane, denen ein Wasserstoffatom fehlt: z. B. leiten sich die Methyl-, Ethyl- und Propylgruppen von Methan, Ethan und Propan ab. Der Alkylrest ist wegen des ungepaarten Elektrons ein Radikal.
$\qquad \mathrm { \underbrace {H– { \overset H {\overset {|} { \underset H {\underset {|}{C}}}}} –H}_{Methan} \quad \longrightarrow \quad H– { \overset H {\overset {|} { \underset H {\underset {|}{C}}}}} \cdotp \qquad \underbrace {+ \ \cdotp H}_{Wasserstoffatom} } $
Aggregatzustand
Bei Gasen bestehen zwischen den einzelnen Teilchen - wegen des großen Atom- oder Molekülabstandes - nur geringe Kräfte. Bei Flüssigkeiten sind diese zwischenmolekularen Kräfte schon sehr viel größer und bei Feststoffen enorm stark.
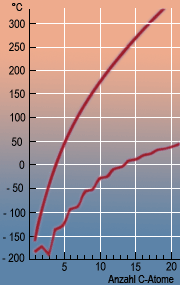
Ein Vergleich der Schmelz- und Siedetemperaturen der Alkane mit ihren Molekülformeln zeigt, dass die Verbindungen mit zunehmender Kettenlänge der Moleküle immer höher schmelzen. Die stärksten zwischenmolekularen Anziehungskräfte bestehen also bei Molekülen hoher Molekülmasse. Diese »Van-der Waals-Kräfte«, die ihre Ursache in den Anziehungskräften zwischen Atomkernen und Elektronen benachbarter Moleküle haben, wirken umso stärker, je größer das Molekül wird. Kurzkettige Alkane mit 1 - 4 Kohlenstoffatomen sind dementsprechend bei Raumtemperatur gasförmig, mittellange Alkane mit 5 - 16 Kohlenstoffatomen sind flüssig und die langkettigen Alkane mit 17 oder mehr Kohlenstoffatomen sind fest.
| Name | Summenformel | Smp. °C | Sdp. °C | Aggregatzustand bei 20°C | Alkyl |
| Methan | CH4 | -182,6 | -161,7 | Gase | Methyl |
| Ethan | C2H6 | -172,0 | -88,6 | Ethyl | |
| Propan | C3H8 | -187,1 | -42,2 | Propyl | |
| Butan | C4H10 | -135,5 | -0,5 | Butyl | |
| Pentan | C5H12 | -129,7 | 36,1 | Flüssigkeiten | Pentyl |
| Hexan | C6H14 | -94,0 | 68,7 | Hexyl | |
| Heptan | C7H16 | -90,5 | 98,4 | Heptyl | |
| Octan | C8H18 | -56,8 | 125,6 | Octyl | |
| Nonan | C9H20 | -53,7 | 150,7 | Nonyl | |
| Decan | C10H22 | -29,7 | 174,0 | Decyl | |
| ↓ | |||||
| Hexadecan | C16H34 | 18,1 | 280,0 | Hexadecyl | |
| Heptadecan | C17H36 | 22,0 | 303,0 | Feststoffe | Heptadecyl |
| ↓ | |||||
| Eicosan | C20H42 | 36,4 | — | Eicosyl |
Während Methan und die Flüssiggase Propan und Butan mit mit einer sauberen, blauen Flamme brennen, rußt die gelb brennende Hexanflamme. Mit zunehmender Kettenlänge verstärkt sich diese Rußneigung, was auf den steigenden Kohlenstoffgehalt der Verbindungen zurückzuführen ist: Der Kohlenstoffanteil wird nicht mehr vollständig zu Kohlendioxid verbrannt, sondern nur bis zum elementaren Kohlenstoff oxidiert. Erhitzt man also Alkane mit sehr hoher Molekülmasse, so wird die Zersetzung des Moleküls durch die Schwarzfärbung (Kohlenstoff) angezeigt. Die Kräfte zwischen den Molekülen sind stärker geworden als die Kräfte zwischen den Atomen des Einzelmoleküls. Die Bindungsstärke einer van der Waals'schen Bindung beträgt nur etwa ein Hundertstel einer Atombindung, doch bei großen Molekülen können viele derartige Anziehungskräfte die Festigkeit einer Atombindung überschreiten. Diese Stoffe kann man daher nicht mehr unzersetzt destillieren.
Dass bei Molekülen mit ungeraden Kohlenstoffzahlen zu Beginn der homologen Reihe die Schmelzpunkte verhältnismäßig tief liegen, beruht darauf, dass diese Moleküle im Kristallgitter nicht so gut zusammenpassen und deshalb leichter in den flüssigen Aggregatzustand übergehen.
Geruch
Die gasförmigen Alkane sind farb- und geruchslos. Für flüssige Alkane ist der Benzingeruch typisch. Tatsächlich bilden flüssige Alkane den größten Anteil des Benzins, welches hauptsächlich aus Alkanen mit 5 bis 9 Kohlenstoffatomen besteht.
Löslichkeit
Alle Alkane sind mit Ausnahme des Methans völlig wasserunlöslich, denn als unpolare Stoffe lösen sie sich nicht in polaren Lösungsmitteln. Methan löst sich in ganz geringen Mengen. Allerdings lösen sich Alkane in organischen Lösungsmitteln wie Benzin, Dichlormethan, Tetrachlormethan usw. Paraffin ist ein Gemenge aus höher siedenden Alkanen.
Paraffin und Fett lösen sich in Hexan. Unpolare Stoffe lösen sich in unpolaren Lösungsmitteln. Es gilt der Satz: Ähnliches löst sich in Ähnlichem. Alkane sind wasserabstoßend (hydrophob) oder fettliebend (lipophil), weil sie sich in den gleichen Lösungsmitteln wie die Fette lösen. Alkane werden als Lösungsmittel für Öle, Fette und andere organische Stoffe verwendet (»Reinigungsbenzin«).