86. Das Benzol - ein aromatischer Kohlenwasserstoff
Das historische Problem mit dem Benzol
Im Jahre 1825 wurde Benzol von dem englischen Physiker Michael Faraday (1791-1867) im Leuchtgas entdeckt, nämlich dadurch, dass er dieses Öl aus flüssigen Rückständen isolierte, die sich beim Verbrennen von Walölen in den Londoner Straßenlaternen aus der Gasphase abschieden. Er schlug deshalb den Namen „Pheno“ (gr. phainein = leuchten) vor. Ein Jahr später erkannte man, dass dieses Öl ein Kohlenwasserstoff ist.
Um die korrekte Strukturformel des Benzols schwelte ein langer Gelehrtenstreit. Aus der Summenformel C6H6 konnte lange Zeit keine Struktur abgeleitet werden, die mit den beobachteten Eigenschaften in Einklang zu bringen war. Zur Summenformel C6H6 lassen sich theoretisch 217 verschiedene Strukturformeln aufstellen. Erst im Jahre 1861 formulierte der österreichische Chemiker Johann Josef Loschmidt einige mögliche Strukturformeln des Benzols, die der deutsche Chemiker August Kekulé (1829- 1896) dann 1865 übernahm. Einer Legende nach kam Kekulé dieser Einfall im Traum. Nach Kekule wandern die Doppelbindungen im Molekül schnell hin und her. Sie sind an keinen festen Platz gebunden und unterscheiden sich dadurch von den Doppelbindungen der Alkene. Er schlug für das Benzolmolekül eine Ringstruktur vor.
Ein wichtiges (Erkennungs-)Merkmal ist das Ausbleiben einer Additionsreaktion mit Bromwasserstoffsäure oder Bromwasser. Benzol addiert nur unter besonderen Reaktionsbedingungen Brom, obwohl auf grund der Summenformelformel ein Molekül mit mehreren Doppel- oder Dreifachbindungen angenommen werden kann. (siehe Versuch 2, Kapitel 82).
Die Benzolstruktur in heutiger Sicht
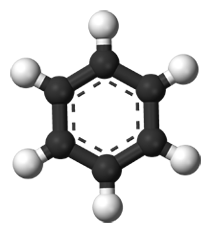
Heute weiß man, dass die tatsächliche Struktur des Benzols mit einem Formelbild nicht exakt beschrieben werden kann. Man kann nur sog. Grenzstrukturen aufstellen und stellt sich vor, dass der tatsächliche Bindungszustand zwischen diesen Grenzformeln liegt.
Diese Erscheinung wird Mesomerie genannt. Gemäß der Oktettregel sind diejenigen Moleküle besonders stabil, bei denen jedes Atom von acht Valenzelektronen umgeben ist. Für das Benzol lassen sich zwei Strukturformeln aufstellen, bei denen dies der Fall ist (mesomere Grenzstrukturen). Der Doppelpfeil zwischen den beiden Grenzformeln (Bild 1oben mitte) ist der Mesomeriepfeil. Er soll andeuten, dass der wahre Bindungszustand zwischen den formulierten Strukturen liegt.
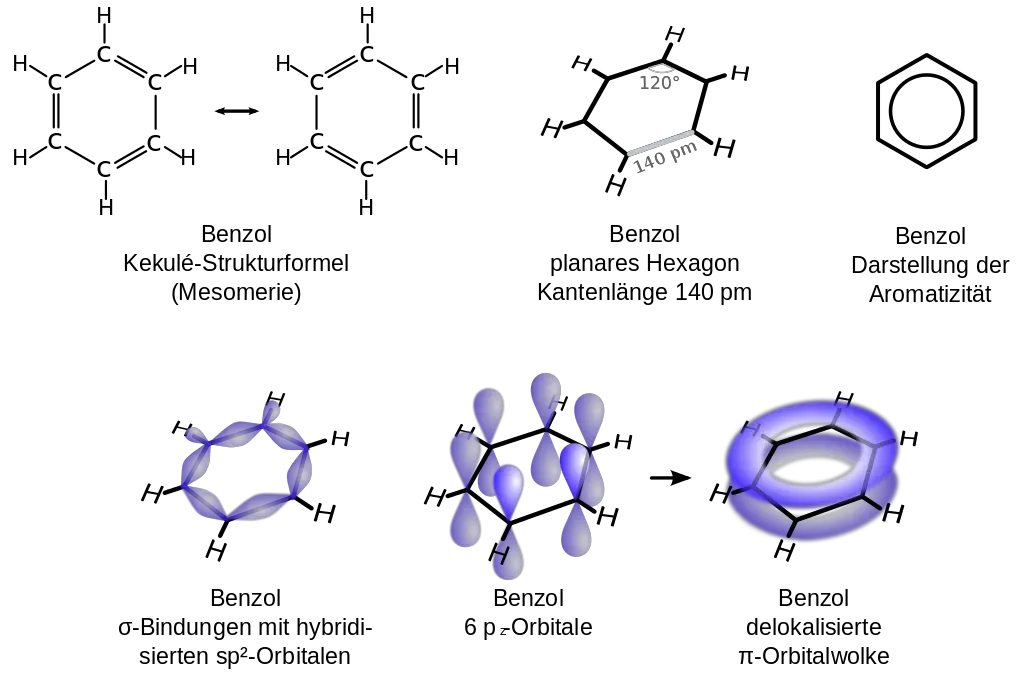
Dass keine der beiden Grenzformeln des Benzols korrekt ist, lässt sich aus den Bindungslängen der Bindungen zwischen den Kohlenstoffatomen ableiten. Die durch Doppelbindungen miteinander verbundenen Kohlenstoffatome müssten geringere Abstände haben als jene, die nur durch eine einfache Atombindung miteinander verbunden sind. Das ist jedoch nicht der Fall. Die Bindungslängen zwischen den Kohlenstoffatomen betragen einheitlich 139 pm.
Das Benzol besitzt einen aromatischen Geruch und ist die einfachste aromatische Verbindung, mit dem alle anderen Aromaten durch die Struktur verwandt sind. Von diesem typischen Geruch leitet sich die Bezeichnung Aromat, aus gr. ‚aroma‘=‚Duft‘, ab. Man faßt alle Verbindungen, die sich vom Benzol ableiten, als aromatische Verbindungenzusammen. Eine Vielzahl aromatischer Verbindungen ist im Steinkohlenteer vorhanden.
Anwendungen
Benzol wird in der chemischen Industrie für die Synthese vieler Verbindungen gebraucht, vorwiegend Ethylbenzol (52 Prozent), Cumol (20 Prozent), Cyclohexan (13 Prozent) und Nitrobenzol (neun Prozent), aber auch Anilin, Styrol, Nylon, Synthesekautschuk, Kunststoffe, waschaktive Stoffe, Insektizide, Farbstoffe und viele weitere Stoffe. Des Weiteren werden durch Substitution viele Aromaten wie zum Beispiel Phenol, Nitrobenzol, Anilin, Chlorbenzol, Hydrochinon und Pikrinsäure gewonnen.
Früher wurde Benzol als gutes Lösungs- und Reinigungsmittel in vielen Bereichen verwendet. Als Lösungsmittel für Kautschuklacke, Wachse, Harze und Öle wird Benzol zunehmend durch weniger giftige Stoffe verdrängt. Als gutes Lösungsmittel ist Benzol weitgehend von Aceton ersetzt worden. Als Ersatz für Benzol bieten sich die aromatischen Verbindungen Toluol und Xylol (Kapitel 92) an, die ebenfalls aus Steinkohle gewonnen werden.



Toluol und Xylol besitzen ebenfalls einen typischen aromatischen Geruch. Aus Toluol wird der bekannte Sprengstoff TNT gewonnen (Trinitrotoluol).
Die Entdeckung der aromatischen Verbindungen im Steinkohlenteer war Mitte des 19. Jahrhunderts der Beginn der chemischen Industrie.