107. Veresterung und Verseifung
Veresterung
Die Veresterung (auch Esterbildung genannt) ist eine chemische Reaktion, die von Emil Fischer entdeckt wurde. Sie ist eine Gleichgewichts- und Kondensationsreaktion, bei der ein Alkohol mit einer organischen oder anorganischen Säure zu einem Ester reagiert. Ester bestehen aus ungeladenen Molekülen, deswegen leiten sie den elektrischen Strom nicht.
Esterhydrolyse = Verseifung
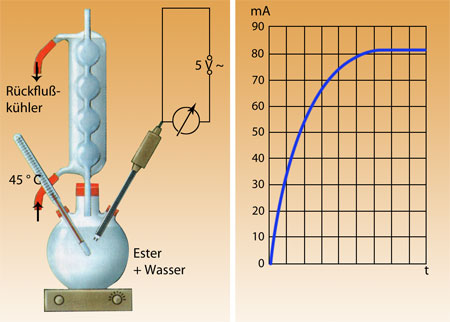
Ebenso zeigt eine frisch angesetzte Mischung aus reinem Ester und Wasser keine elektrische Leitfähigkeit. Wenn man die Mischung jedoch langsam erhitzt, tritt Leitfähigkeit ein, die langsam ansteigt und nach einer gewissen Zeit konstant bleibt. Man kann also folgendes festhalten:
- Wenn Ester und Wasser miteinander reagieren, entstehen Ionen und es tritt elektrische Leitfahigkeit ein.
- Die Ionenbildung steigt während der Reaktion und erreicht nach einer bestimmten Zeit eine gleichbleibende Konzentration.
Ein Ester mit Wasser wird also in Säure und Alkohol gespalten. Die Reaktion entspricht der Umkehrung der Veresterung und wird Verseifung genannt. Als Produkte der Reaktion entstehen der Alkohol und das Salz der Säure (Carboxylat-Ion), aus denen der Ester bestand.
$ \mathrm { \underbrace {CH_3 \ – \ \!\!\!\!\!\!\!\!\!\!\!\!\! {\overset { \qquad \ \quad { \Large O}} {\overset {\quad \ \diagup \!\! \diagup \!\! } C }} \!\!\!\!\!\!\!\!\! – O \ – \ C_2H_5}_{Essigsäureethylester} + H_2O \ \ {\overset {\large Verseifung} {\underset {\large Veresterung} {\large \rightleftharpoons} }} \quad \underbrace {CH_3COOH}_{Essigsäure} + \underbrace {C_2H_5OH}_{Ethanol} }$
$ \mathrm { \underbrace {CH_3COOH}_{Essigsäure \ \color {blue}{keine Leitfähigkeit}} \;\; {\overset {\large H_2O}{\large \rightleftharpoons} } \;\; \underbrace {CH_3COO^-_{(aq)}}_{Acetat-Ion \ \color {brown} {Elektrische Leitfähigkeit}} + H^+_{(aq)} }$
Der Vorgang der Esterspaltung ist eine Hydrolyse. Die saure Esterhydrolyse entspricht der Rückreaktion der sauren Veresterung und führt daher sehr schnell zu einem Gleichgewichtszustand.
Ursprünglich verstand man unter Verseifung lediglich die basische Esterhydrolyse von tierischen Fetten oder pflanzlichen Ölen, mit Laugen, vornehmlich Natronlauge oder Kalilauge, in der Seifensiederei. Dabei entstehen der dreiwertige Alkohol Glycerin und die jeweiligen Alkalisalze der in den Fetten vorkommenden Fettsäuren. Letztere werden Seifen genannt. Die Verseifung mit Natronlauge liefert Kernseife, die mit Kalilauge Schmierseife.
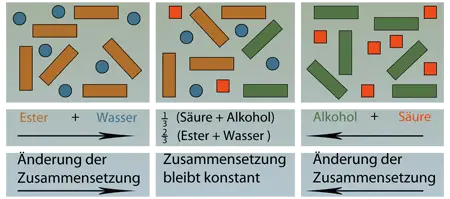
Das chemische Gleichgewicht ist ein dynamisches Gleichgewicht
Die bei der Verseifung entstandene Säure ist für das Auftreten der elektrischen Leitfähigkeit verantwortlich. Da sich die Säure mit Alkohol teilweise wieder zu Ester und Wasser verbinden kann ist es nicht möglich, dass ein Ester mit Wasser vollständig in Säure und Alkohol gespalten werden kann. Entsprechend reagieren in einem Alkohol-Säure-Gemisch nicht beide Reaktionspartner vollständig zu Ester (Kapitel 106, 1). Bei der Esterspaltung liegt also wie bei der Esterbildung immer ein Gemisch aus Ester, Wasser, Alkohol und Säure vor. Haben in diesem Gemisch einerseits die Stoffmengen von Ester und Wasser und andererseits von Säure und Alkohol ein bestimmtes Verhältnis erreicht, scheint es, dass keine Reaktion mehr abläuft. Diesen Zustand nennt man chemisches Gleichgewicht, da sich Bildung und Spaltung des Esters die Waage halten.
Das chemische Gleichgewicht ist ein dynamisches Gleichgewicht, da es einen Zustand darstellt, in dem Moleküle laufend miteinander reagieren. Die Schreibweise einer Gleichgewichtsreaktion erfolgt mit einem Doppelpfeil:
$ \mathrm {A + B \ \leftrightharpoons \ AB}$
Im Zustand des Gleichgewichts ändert sich der Stoffmengenanteil der Säure im Gemisch nicht mehr, und damit erreicht die elektrische Leitfähigkeit einen konstanten Wert.
Die Gleichgewichtsverschiebung
Chemikerinnen und Chemiker sind in der Lage, eine chemische Gleichgewichtsreaktion zu beeinflussen und zu steuern. In der Technischen Chemie hat man zahlreiche Verfahren dazu entwickelt. Will man eine hohe Ausbeute an Ester haben, muß man das Gleichgewicht auf die Seite des Esters verschieben. Entsprechend der Formelgleichung unten soll also das Gleichgewicht nach rechts verschoben werden. In den Versuchen 2 und 5 im Kapitel 106 hatte die konz. Schwefelsäure eine doppelte Wirkung:
- Wasserstoff-Ionen beschleunigen das Erreichen des Estergleichgewichtes.
- Da die konz. Schwefelsäure dem Gleichgewicht laufend Wasser entzieht, kommt es zu einer Verschiebung der Reaktion nach rechts.
Die Verschiebung des Gleichgewichts zugunsten der Esterspaltung kann man durch Laugen erreichen (siehe Versuch 2). Die OH– -Ionen der Lauge verbinden sich mit den Wasserstoff-Ionen der Säure, so dass die gebildete Säure laufend verbraucht wird. Es wird daher kein Gleichgewichtszustand erreicht.
$ \mathrm {
CH_3 \ – \ \!\!\!\!\!\!\!\!\!\!\!\!\!
{\overset { \qquad \ \ \qquad { \Large O}} {\overset {\qquad \ \diagup \!\! \diagup \!\! }
C }} \!\!\!\!\!\!\!\!\! – O
\ – \
C_2H_5 + H_2O \ {\large \rightleftharpoons} \ CH_3COOH + C_2H_5OH
}$
$ \mathrm {
CH_3COOH \qquad \; \; + \; OH^- \longrightarrow \ \; CH_3COO^- + H_2O
}$
$\mathrm { CH_3 \ – \ \!\!\!\!\!\!\!\!\!\!\!\!\! {\overset { \qquad \ \ \qquad { \Large O}} {\overset {\qquad \ \diagup \!\! \diagup \!\! } C }} \!\!\!\!\!\!\!\!\! – O \ – \ C_2H_5 + OH^-_{(aq)} \ \xrightarrow {H_2O} \ C_2H_5OH + CH_3COO^-_{(aq)} } $
Der hier von den OH– -Ionen verursachte Zustand ist irreversibel, d.h. er kann nicht mehr rückgängig gemacht werden. Das Gleichgewicht ist endgültig auf eine Seite verschoben.