115. Proteine - unüberschaubare Vielfalt
Im menschlichen Körper tummeln sich einige tausend verschiedene Proteine - insgesamt kennt man über 50.000! In den meisten Zellen sind sie die häufigsten Makromoleküle und haben im Körper sehr viele verschiedene Funktionen.

Chemisch bestehen Proteine aus Aminosäuren, was schier unbegrenzte Kombinationen ermöglicht. Beim Aufbau eines Proteins verbindet sich zunächst eine Carboxygruppe eines Aminosäuremoleküls mit einer Aminogruppe eines anderen Moleküls.
Unter Abspaltung von Wasser ist ein Dipeptid mit zwei Aminosäureresten entstanden:
$ \mathrm { \underbrace { CH_3 \ – \ {\underset {\Large \ NH_2}{\underset {\mid} {CH}}} \ – \ \ \!\!\!\!\!\!\!\!\! {\overset { \qquad \quad { \Large O}} {\overset {\quad \ \diagup \!\! \diagup }C }} \!\!\!\!\!\!\!\! – \ \boxed {OH + H} \ – \ {\underset {\Large H}{\underset {\mid} {N}}} \ – \ CH_2 \ – \ \!\!\!\!\!\!\!\!\!\! {\overset { \qquad \quad { \Large O}} {\overset {\quad \ \diagup \!\! \diagup }C }} \!\!\!\! – \ OH}_{Alanin \ + \ Glycin} \ \ \longrightarrow \ \ \underbrace { CH_3 \ – \ {\underset {\Large \ NH_2}{\underset {\mid} {CH}}} \ – \ \ \!\!\!\!\!\!\!\!\! {\overset { \qquad \quad { \Large O}} {\overset {\quad \ \diagup \!\! \diagup }C }} \!\!\!\!\!\!\!\! – \ {\underset {\Large H}{\underset {\mid} {N}}} \ – \ CH_2 \ – \ \!\!\!\!\!\!\!\!\!\! {\overset { \qquad \quad { \Large O}} {\overset {\quad \ \diagup \!\! \diagup }C }} \!\!\!\! – \ OH}_{Dipeptid} + H_2O }$

Wie aus dem Formelbild zu ersehen ist, werden die verbliebenen Aminosäurereste über die Gruppe $\mathrm { — \overset {\overset {\Large O}{\mid \mid}} {C} — \underset {\underset {\Large H}{\mid}} {N} — }$, die so genannte Peptidbindung, verknüpft.
$\mathrm { — \overset {\overset {\Large O}{\mid \mid}} {C} — \underset {\underset {\Large H}{\mid}} {N} — }$
Ein Dipeptid enthält wie die Aminosäuren, aus denen es zusammengesetzt ist, sowohl eine Carboxygruppe als auch eine Aminogruppe, daher kann es mit weiteren Aminosäuren oder anderen Peptiden wiederum Peptidbindungen eingehen. Verbindet sich ein Dipeptid mit einer weiteren Aminosäure, so entsteht ein Tripeptid usw.
Die Aminosäureketten können eine Länge von bis zu mehreren tausend Aminosäuren haben, wobei man Aminosäureketten mit einer Länge von unter ca. 100 Aminosäuren als Peptide bezeichnet und erst ab einer größeren Kettenlänge von Proteinen spricht. Die molekulare Größe eines Proteins wird in der Regel in Kilo-Dalton (kDa) angegeben. Titin, das mit ca. 3600 kDa größte bekannte menschliche Protein, besteht aus über 30.000 Aminosäuren.
$ \mathrm {
\cdots H_2N \ – \
{\overset { \Large R_1} {\overset {\mid} {\underset { \Large H} {\underset {\mid} C}}}}
\ – \ COOH + H_2N
\ – \
{\overset { \Large R_2} {\overset {\mid} {\underset { \Large H} {\underset {\mid} C}}}}
\ – \ COOH + H_2N
\ – \
{\overset { \Large R_3} {\overset {\mid} {\underset { \Large H} {\underset {\mid} C}}}}
\ – \ COOH \cdots \longrightarrow
}$
$ \mathrm {
\cdots \ {\Large \cdotp} {\underset { \Large H} {\underset {\mid} N}}
\ – \
{\overset { \Large R_1} {\overset {\mid} {\underset { \Large H} {\underset {\mid} C}}}}
\ – \
\!\!\!\!\!\!\!\!\!\!
{\overset { \qquad \quad { \Large O}} {\overset {\quad \ \diagup \!\! \diagup }C }}
\!\!\!\! – \
{\underset { \Large H} {\underset {\mid} N}}
\ – \
{\overset { \Large R_2} {\overset {\mid} {\underset { \Large H} {\underset {\mid} C}}}}
\ – \
\!\!\!\!\!\!\!\!\!\!
{\overset { \qquad \quad { \Large O}} {\overset {\quad \ \diagup \!\! \diagup }C }}
\!\!\!\! – \
{\underset { \Large H} {\underset {\mid} N}}
\ – \
{\overset { \Large R_3} {\overset {\mid} {\underset { \Large H} {\underset {\mid} C}}}}
\ – \
\!\!\!\!\!\!\!\!\!\!
{\overset { \qquad \quad { \Large O}} {\overset {\quad \ \diagup \!\! \diagup }C }}
\!\!\!\! – \
{\Large \cdotp} \cdots + 3 \ H_2O
}$
Ausschnitt aus einer Peptidkette
Die Vielfalt der Proteine ist in der Struktur begründet
Proteine bilden äußerst komplexe räumliche Strukturen, in denen die Aminosäuren in einer ganz bestimmten Reihenfolge aufeinander folgen. Für das chemische Verhalten spielt diese Aufeinanderfolge, die Aminosäuresequenz, eine große Rolle. Unterschiedliches chemisches Verhalten kennt man auch von einfacheren Molekülen, so macht es beispielsweise einen Unterschied, ob beim Propanol die OH-Gruppe an das 1. oder 2. Kohlenstoffatom gebunden ist (Kapitel 96). Betrachtet man einen aus 2 verschiedenen Aminosäuren bestehenden Polypeptidabschnitt, und nimmt man an, dass in diesem Abschnitt jede der beiden Aminosäuren nur zweimal vertreten ist, so ergeben sich bereits mehrere Möglichkeiten der Abfolge:
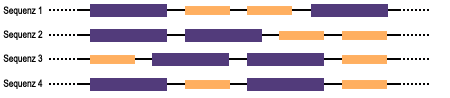
Alle 4 im Schema dargestellten Fälle entsprechen jeweils einem besonderen Peptid mit besonderen chemischen Verhaltensweisen. Bei zwanzig Aminosäuren als Grundbausteine ergeben sich bei einer Polypeptidkette mit 100 Aminosäureresten bereits unvorstellbar viele Kombinationsmöglichkeiten, namlich 10132. Zum Vergleich: im gesamten Universum existieren "nur" etwa 1080 Atome!
Die Aminosäurensequenz eines Proteins – und damit sein Aufbau – ist in der Desoxyribonukleinsäure (DNA) kodiert. Der dazu verwendete genetische Code hat sich während der Evolution der Lebewesen kaum verändert.
Die Eigenschaften eines Proteins hängen neben der Aminosäuresequenz, der so genannten Primärstruktur, auch von der räumlichen Gestalt der Molekülketten und deren Anordnung zueinander ab. Die Sekundärstruktur beschreibt die dreidimensionale Anordnung der einzelnen Polypeptidketten, wobei die häufigste und wichtigste Sekundärstruktur dieα-Helix ist. Übergeordnete Strukturebenen sind die Tertiärstruktur und die Quartärstruktur. Die dreidimensionale Struktur eines Proteins ist entscheidend für dessen Funktion. Die Untersuchung der Struktur eines Proteins gehört zu den schwierigsten Analysen in der Biochemie.