75. Überblick über Kohlenstoffverbindungen
Bindungstyp und Vielfalt der Kohlenstoffverbindungen
Die historische Bezeichnung "Organische Chemie" umfasst im heutigen Verständnis die Chemie der Kohlenstoffverbindungen. Einige Ausnahmen gibt es jedoch: Die Kohlensäure (H2CO3) und ihre Salze, die Carbonate, die Carbide sowie die Oxide des Kohlenstoffs werden dem Forschungsbereich der Anorganischen Chemie zugeordnet. Eine besondere Eigenschaft des Kohlenstoffatoms ist für die Bildung organischer Verbindungen von größter Bedeutung: Es kann sich zu verzweigten und unverzweigten Ketten und zu verschiedenen ringförmigen Strukturen verbinden.
Bei organischen Verbindungen des Kohlenstoffs herrscht die Atombindung vor. Aus diesem Grund sind organische Verbindungen häufig nicht in Wasser löslich und zeigen keine elektrische Leitfähigkeit (Versuch 2 ). An das Grundgerüst einer Kohlenstoffverbindung sind am häufigsten Wasserstoffatome gebunden.
Diese Bindungseigenschaften des Kohlenstoffs führen zu der schier unerschöpflichen Vielfalt von Kohlenstoffverbindungen. Es gibt heute weit mehr Verbindungen, die auf Kohlenstoff beruhen, als Verbindungen aller übrigen Elemente zusammen. Man kennt mittlerweile über 13 Millionen organische Kohlenstoffverbindungen, denen "nur" etwa 200.000 anorganische Verbindungen gegenüber stehen.

Grobe Einteilung der Kohlenstoffverbindungen
Nach dem Bau des Kohlenstoffgerüstes in den Molekülen kann man organische Verbindungen in zwei Gruppen einteilen.
1. Kettenförmige Kohlenstoffverbindungen:
|
$\mathrm {C_5H_{12} \ = \ Pentan}$ |
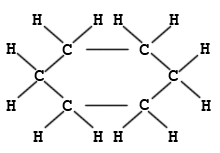
2. Ringförmige Kohlenstoffverbindungen
Cyclohexan ist ein Beispiel für einen ringförmigen Kohlenwasserstoff. Am Modell ist die Tetraederstruktur zu erkennen. Wie die Animation zeigt, liegen die Kohlenstoffatome nicht in einer Ebene, wie das etwa das Formelbild daneben vortäuschen mag.
Vom Benzol (auch Benzen) leitet sich eine wichtige Klasse von ringförmigen Kohlenwasserstoffen ab. Im Benzolmolekül findet sich das Bauprinzip des Graphits; die sechs Kohlenstoffatome liegen in einer Ebene wie im Graphit und binden je ein Wasserstoffatom. Benzol ist eine flüssige organisch-chemische Verbindung mit einem charakteristischen aromatischem Geruch. Es ist das einfachste und zugleich klassische Beispiel für aromatische Kohlenwasserstoffe.