103. Die Essigsäure - eine Carbonsäure
Wenn der Inhalt einer Flasche Wein zu Essig wird, kann mal schon mal sauer werden! Offensichtlich hat der Korken die Flasche nicht fest verschlossen und Essigsäurebakterien konnten den im Wein enthaltenen Alkohol unter Sauerstoffverbrauch zu Essigsäure vergären. In der technischen Chemie ist die Essigsäure der wichtigste Vertreter der Carbonsäuren. Als Lebensmittelzusatzstoff trägt die Essigsäure die Bezeichnung E 260.

Reine Essigsäure kristallisiert unterhalb von +17°C aus. Foto: David Gingrich
Ethansäure = Essigsäure
Säurecharakter
Reine Essigsäure ist eine ist eine farblose, flüssige, ätzende und typisch riechende Carbonsäure der Zusammensetzung C2H4O2 (Halbstrukturformel CH3COOH). Wässrige Lösungen der Essigsäure werden trivial nur Essig und reine Essigsäure Eisessig genannt. Die Dämpfe der konz. Essigsäure sind brennbar.
Die wichtigste Eigenschaft der Essigsäure ist ihre saure Reaktion in wässriger Lösung. Die Zunahme der Leitfähigkeit beweist, dass es beim Verdünnen der Essigsäure mit Wasser zur Bildung von Ionen kommt. Da sich die Farbe des Indikators verändert, kann man davon ausgehen, dass es zur Abspaltung von Protonen kommt.
Verantwortlich dafür ist die —COOH -Gruppe. Sie wird Carboxygruppe genannt und ist die funktionelle Gruppe der organischen Carbonsäuren:
$ \mathrm { \ – \!\!\!\!\!\!\!\!\!\!\! {\overset { \qquad \ \ \qquad { \Large O}} {\overset {\qquad \ \diagup \!\! \diagup } {\underset {\qquad \qquad {\Large OH} } {\underset {\qquad \diagdown }C }}}} }$ Carboxygruppe
Säuren mit nur einer Carboxygruppe nennt man Monocarbonsäuren. In wässriger Lösung kommt es bei ihnen zu einer Gleichgewichtsreaktion, wie im folgenden das Beispiel der Essigsäure zeigt:
$ \mathrm { \underbrace {H \ – { \overset {\Large H} {\overset {|} { \underset {\Large H} {\underset {|}{C}}}}} \ – \ \!\!\!\!\!\!\!\!\!\!\!\!\!\! {\overset { \qquad \ \ \qquad { \Large O}} {\overset {\qquad \ \diagup \!\! \diagup } {\underset {\qquad \qquad {\Large OH} } {\underset {\qquad \diagdown }C }}}}}_{Ethansäure \ (Essigsäure)} + H_2O \ {\large \leftrightharpoons} \ \underbrace {\Biggl [ { H \ – { \overset {\Large H} {\overset {|} { \underset {\Large H} {\underset {|}{C}}}}} \ – \ \!\!\!\!\!\!\!\!\!\!\!\!\!\! {\overset { \qquad \ \ \qquad { \Large O}} {\overset {\qquad \ \diagup \!\! \diagup } {\underset {\qquad \qquad {\Large O} } {\underset {\qquad \diagdown }C }}}} } \;\; \Biggr] ^–}_{Ethanation \ (Acetation)} + \underbrace {H_3O^+}_{Oxoniumion} }$
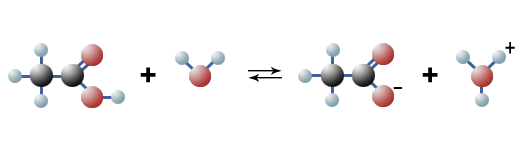
Vereinfacht:
$ \mathrm { \underbrace {CH_3COOH}_{Essigsäure} \ {\large \leftrightharpoons} \ \underbrace { {\lbrack CH_3COO^- \rbrack}_{(aq)}}_{Acetat-Ion} + \underbrace {{\lbrack H^+ \rbrack}_{(aq)}}_{Wasserstoff-Ion} }$
Wenn OH-Gruppen an Atome gebunden sind, von denen eine Doppelbindung ausgeht, dann spalten sie leicht ein Proton ab. Bei der Carboxygruppe trifft dies zu (Versuch 2 ).
Der Zerfall der Essigsäure in Acetat-Ionen und Protonen ist nicht sehr stark, daher ist die Essigsäure eine schwache Säure.
Mit unedlen Metallen und bei der Neutralisation bildet die Essigsäure Salze, die man Acetate oder Ethanate nennt (siehe Tabelle ganz unten).
Beispiele:
$ \mathrm { \underbrace {2 \ CH_3COOH}_{Essigsäure} + Mg \ \longrightarrow \underbrace {(CH_3COO)_2Mg}_{Magnesiumacetat} + H_2 \ \uparrow }$
$ \mathrm { CH_3COOH + \underbrace {NaOH}_{Natronlauge} \ \longrightarrow \underbrace {CH_3COONa}_{Natriumacetat} + H_2O }$
Die Essigsäure wird zur Herstellung vieler technischer Produkte und Arzneimittel gebraucht. Verdünnt (5-8%) wird sie als Speiseessig benutzt. Eisessig dient gelegentlich als Lösungsmittel.
Wenn der Wein sauer wird
Schon früh haben die Menschen die Erfahrung gemacht, dass Wein sauer wird, wenn er über längere Zeit in offenen Behältern gelagert wird. Dabei entsteht Essig, der historisch sowohl in Europa als auch in Asien als Würzmittel zur Säuerung und Konservierung von Lebensmitteln genutzt wurde. In Europa geht die Verwendung bis in die Antike zurück. Dabei wurde Essig traditionell wie beim bekannten Aceto balsamico in der italienischen Region Modena vor allem aus Wein gewonnen, der offen stehen gelassen und vergoren wurde. Das im Mittelalter in Frankreich entwickelte Orleans-Verfahren basierte ebenfalls auf diesem Prozess: Wein wurde in große und flache Bottiche gefüllt und offen hingestellt. Wahrscheinlich über Taufliegen (auch bekannt als Frucht- oder Essigfliegen) wurden Essigsäurebakterien eingetragen, die eine Kahmhaut auf der Weinoberfläche bildeten, die so genannte Essigmutter.
Bei diesem Vorgang entsteht aus dem Ethanol zuerst Ethanal, der unter nochmaliger Oxidation in Ethansäure übergeht. Ethansäure ist der systematische Name für Essigsäure.
$ \mathrm { \underbrace {CH_3 \ – \ CH_2 \ – \ OH}_{Ethanol} + \frac {1}{2} \ O_2 \ \longrightarrow \underbrace {CH_3 \ – \ CHO}_{Ethanal} + H_2O }$
$ \mathrm { \underbrace {CH_3 \ – \ CHO}_{Ethanal} + \frac {1}{2} \ O_2 \ \longrightarrow \underbrace {CH_3 \ – \ CHOOH}_{Ethansäure} }$
| Name | Formel | Bedeutung |
| Natriumacetat | CH3COONa | Wasserlöslich, reagiert alkalisch |
| Calciumacetat | (CH3COO)2Ca | Früher zur Acetongewinnung |
| Aluminiumacetat | (CH3COO)3Al | Beizen, Imprägnieren, Bestandteil der »essigsauren Tonerde« |
| Bleiacetat | (CH3COO)2Pb | Giftig, wasserlöslich, zum Nachweis von Schwefelwasserstoff |
| Kupferacetat | (CH3COO)2Cu | Giftig, bildet sich als Überzug an Kupfer- und Messinggegenständen in Küchen |
Die für diesen biochemischen Prozeß notwendigen Enzyme werden von bestimmten Bakterien geliefert. Da diese in der Luft praktisch allgegenwärtig sind, bleibt Wein oder Bier nur in luftdicht verschlossenen Fässern oder Flaschen vor der Umwandlung zu Essig verschont.
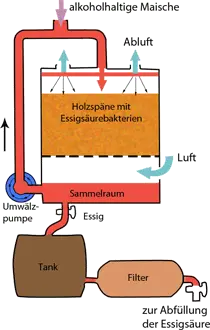
Wie heute Essigsäure gewonnen wird [1]
Biotechnologische Herstellung
Die Gewinnung von Essigsäure aus alkoholischen Flüssigkeiten wird auch heute noch als so genanntes Schnellessigverfahren durchgeführt. Ausgangsprodukte können z. B. Wein, Bier oder Malz sein, das in großen Tanks mit Essigbakterien geimpft wird. Dabei sind die Bakterien sehr stark von einer ausreichenden Sauerstoffversorgung abhängig und reagieren auf sauerstoffarme Lebensbedingungen sehr empfindlich. Bereits bei einer Unterbrechung der Sauerstoffversorgung von wenigen Minuten kommt es zu einer starken Abnahme der Ethanoloxidation.
Großtechnische Herstellung
Weltweit werden jährlich rund 7 Mio. Tonnen Essigsäure produziert, wobei rund 32 % auf die USA entfallen, 17 % auf Westeuropa und 11 % auf Japan. Nur etwa 190.000 Tonnen werden jährlich weltweit biotechnologisch hergestellt, wobei etwa 70 % des Weltbedarfs an Speiseessig in etwa 700 Bioreaktoren produziert wird. [6]
Die derzeit bedeutendste industrielle Synthese für Essigsäure ist die katalytische Umsetzung von Methanol mit Kohlenmonoxid unter Druck (Monsanto-Prozess).
$ \mathrm { \underbrace {CH_3OH}_{Methanol} + CO \ \longrightarrow \ \underbrace {CH_3COOH}_{Ethansäure} }$
Außerdem kann man Essigsäure auch synthetisch durch Oxidation von Acetaldehyd mit Luft oder Sauerstoff unter Einsatz eines Katalysators oder durch teilweise Oxidation anderer Kohlenwasserstoffe hergestellen.
Technisch werden auch noch die Luftoxidation von n-Butan bei etwa 180 °C und 85 bar, die katalytische Oxidation von Leichtbenzin sowie die Rektifikation von Holzessig genutzt.
[1] Wikipedia: Essigsäure