Ethanol
| Strukturformel | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Keile zur Verdeutlichung der Geometrie | |||||||||||||||
| Allgemeines | |||||||||||||||
| Name | Ethanol | ||||||||||||||
| Andere Namen |
| ||||||||||||||
| Summenformel | C2H6O | ||||||||||||||
| CAS-Nummer | 64-17-5 | ||||||||||||||
| PubChem | 702 | ||||||||||||||
| Kurzbeschreibung |
klare, farblose, würzig riechende und brennend schmeckende, leichtentzündliche, hygroskopische Flüssigkeit[1][2] | ||||||||||||||
| Eigenschaften | |||||||||||||||
| Molare Masse | 46,07 g·mol−1 | ||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||
| Dichte | |||||||||||||||
| Schmelzpunkt | |||||||||||||||
| Siedepunkt |
78 °C[3] | ||||||||||||||
| Dampfdruck | |||||||||||||||
| pKs-Wert |
16[4] | ||||||||||||||
| Löslichkeit |
beliebig mit Wasser, Diethylether, Chloroform, Benzin und Benzol mischbar[1] | ||||||||||||||
| Brechungsindex |
1,3638[1] | ||||||||||||||
| Sicherheitshinweise | |||||||||||||||
| |||||||||||||||
| MAK |
500 ml·m−3 beziehungsweise 960 mg·m−3[3] | ||||||||||||||
| LD50 | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||
Ethanol (auch Äthanol, Trivialname Alkohol) ist ein aliphatischer, einwertiger Alkohol mit der Summenformel C2H6O. Die reine Substanz ist eine bei Raumtemperatur farblose, leicht entzündliche Flüssigkeit mit einem brennenden Geschmack und einem charakteristischen, würzigen (süßlichen) Geruch. Bekannt ist Ethanol als Bestandteil von Genussmitteln und alkoholischen Getränken wie Wein, Bier und Likör.
Die Vergärung von Zucker zu Ethanol ist eine der ältesten bekannten biochemischen Reaktionen. In der Neuzeit wird Ethanol für industrielle Zwecke aus Ethylen hergestellt. Ethanol hat eine weite Verbreitung als Lösungsmittel für Stoffe, die für medizinische oder kosmetische Zwecke eingesetzt werden, wie Duftstoffe, Aromen, Farbstoffe oder Medikamente, sowie als Desinfektionsmittel. Die chemische Industrie verwendet es sowohl als Lösungsmittel als auch als Ausgangsstoff für die Synthese von weiteren Produkten wie Carbonsäureethylestern.
Ethanol wird energetisch als Biokraftstoff, etwa als so genanntes Bioethanol verwendet. Beispielsweise enthält der Ethanol-Kraftstoff E85 einen Ethanolanteil von 85 Vol.-%.
Systematik
Ethanol (C2H5OH) gehört zu den linearen n-Alkanolen. Ethanol leitet sich von dem Alkan (gesättigten Kohlenwasserstoff) Ethan (C2H6) ab, in dem formal ein Wasserstoffatom durch die funktionelle Hydroxygruppe (–OH) ersetzt wurde. Zur Benennung wird dem Namen Ethan das Suffix -ol angehängt. Die Summenformel für Ethanol nach dem Hill-System ist C2H6O, die häufig verwendete Schreibweise C2H5OH ist keine Summen-, sondern eine Halbstrukturformel.
„Alkohol“ ist das umgangssprachliche Wort für „Ethanol“; die Fachbezeichnung „Alkohole“ hingegen steht für eine Gruppe organisch-chemischer Verbindungen, die neben dem Kohlenwasserstoffgerüst als zusätzliche Funktionelle Gruppe mindestens eine Hydroxygruppe besitzen, wobei sich an dem Kohlenstoffatom mit der Hydroxygruppe kein höherwertiger Substituent befindet.
Geschichte

Ethanol entsteht auf natürlichem Weg bei der Vergärung zuckerhaltiger Früchte. Dem Menschen ist diese natürlich vorkommende Substanz seit langem zur Berauschung bekannt.[13][14] So finden sich in ägyptischen Schriftrollen der III. Dynastie[15] sowie auf alt-mesopotamischen Keilschrifttafeln[15] Hinweise auf die Herstellung ethanolhaltiger Getränke.
Biere, später Weine wurden zunächst mit Hilfe von Wildhefen erzeugt. Die Ethanolgehalte solcher Getränke waren geringer als heute, da die Wildhefen ab einer bestimmten Ethanolkonzentration die Umwandlung von Zucker in Ethanol einstellen. Durch jahrhundertelange Züchtung tolerieren heutige Kulturhefen wie Saccharomyces cerevisiae höhere Ethanolgehalte.[16] Die erste Gewinnung von konzentriertem Ethanol gelang dem persischen Arzt, Naturwissenschaftler, Philosophen und Schriftsteller Abu Bakr Mohammad Ibn Zakariya al-Razi durch die Destillation von Wein.[17]
Im Jahre 1796 erhielt Johann Tobias Lowitz erstmals reinen Ethanol durch Filtrierung von destilliertem Ethanol über Aktivkohle.[18] Antoine Lavoisier beschrieb Ethanol erstmals als eine Verbindung aus Kohlenstoff, Wasserstoff und Sauerstoff. Im Jahre 1808 bestimmte Nicolas-Théodore de Saussure die chemische Zusammensetzung von Ethanol. Fünfzig Jahre später veröffentlichte Archibald Scott Couper die Strukturformel von Ethanol. Es war eine der ersten Strukturformeln, die bestimmt wurden.
Ethanol wurde zum ersten Mal synthetisch im Jahre 1826 durch Henry Hennel und George Simon Serullas in Großbritannien hergestellt. Im Jahre 1828 stellte Michael Faraday Ethanol durch säurekatalysierte Hydratisierung von Ethylen her, einem Prozess, welcher der industriellen Ethanolsynthese ähnelt.
Heute wird Ethanol hauptsächlich durch Gärung aus Biomasse gewonnen. Im Kontext der Erzeugung von Biokraftstoff wird es Bioethanol genannt. Agraralkohol ist Ethanol aus Agrarrohstoffen, das weltweit, in Deutschland unter staatlicher Aufsicht in landwirtschaftlichen Brennereien erzeugt wird.
Vorkommen
Ethanol ist ein in reifen Früchten und Säften natürlich vorkommendes Produkt der alkoholischen Gärung. Viele Lebensmittel enthalten natürlicherweise geringe Mengen Ethanol. So enthält alkoholfreies Bier noch bis 0,5 % Vol. Ethanol.[19] Laut dem Deutschen Lebensmittelbuch dürfen Fruchtsäfte einen Ethanolgehalt von etwa 0,38 % Vol. aufweisen.[20] So enthält Apfelsaft bis 0,4 % Vol. Ethanol. Eine Ausnahme bildet Traubensaft, der bis 1 % Vol. Ethanol enthalten darf.[21] Eine reife Banane kann bis zu 1 % Vol., Brot bis 0,3 % Vol. enthalten. Reifer Kefir kann bis 1 % Vol. Ethanol enthalten, Sauerkraut bis zu 0,5 % Vol. Der physiologische Ethanolgehalt des menschlichen Bluts beträgt etwa 0,02 bis 0,03 ‰.[22]
Ethanol wurde neben anderen organischen Molekülen wie Vinylalkohol in interstellaren Molekülwolken nachgewiesen, wobei deren Bildungsmechanismus ungeklärt ist.[23]
Herstellung
Alkoholische Gärung
Ethanol wird durch Gärung aus Biomasse, meist aus Zucker- oder Stärke-haltigen Feldfrüchten oder traditionell aus Produkten des Gartenbaus gewonnen. Dieser Prozess wird mit einer Reihe von Nahrungsmitteln kontrolliert durchgeführt, wodurch zum Beispiel Wein aus Weintrauben oder Bier aus Malz und Hopfen entstehen. Holzzucker kann als Nebenprodukt des Sulfitverfahrens zu Sulfitsprit fermentiert werden. Dieser kann auf Grund zahlreicher Verunreinigungen jedoch nur energetisch genutzt werden.
Bei der Gärung wird zuerst Stärke in Disaccharide gespalten, deren glycosidische Bindung durch Hydrolasen gespalten werden. Die entstehenden Monosaccharide werden anschließend durch Hefe oder Bakterien vergoren. Bei einer Ethanolkonzentration nahe 15 % beginnen Hefezellen und Bakterien abzusterben, weshalb durch Gärung keine höhere Konzentration erreicht werden kann. Die Bruttogleichung der alkoholischen Gärung ist:
Destillation
Ethanol kann durch Destillation für technische und Genusszwecke konzentriert werden, da es bereits bei 78 °C verdampft.
Zum Verzehr geeigneter Trinkalkohol wird durch Destillation – dem so genannten Brennen – einer alkoholhaltigen Maische aus landwirtschaftlichen Ausgangsprodukten gewonnen. Je nach Brennverfahren sind im Destillat, dem so genannten Brand, neben Ethanol noch Aromen, Fuselöle, weitere organische Verbindungen und Wasser enthalten, die den Charakter und den Geschmack des Endproduktes wie zum Beispiel Weinbrand, Whisky oder Rum bestimmen. Für die Herstellung von Wodka wird hingegen fast reines Ethanol verwendet und nur noch mit Wasser verdünnt. Unverdünnt dient reines Ethanol mit der Verkehrsbezeichnung Ethylalkohol landwirtschaftlichen Ursprungs als Ausgangsprodukt für weitere alkoholische Getränke, zum Beispiel für die meisten Liköre. Alkoholische Getränke, die destilliertes Ethanol enthalten, heißen Spirituosen (umgangssprachlich auch Branntwein oder Schnaps) – im Gegensatz zu Wein und Bier, deren Ethanol ausschließlich durch alkoholische Gärung entstanden ist.
Großtechnisch erfolgt die Herstellung reinen Ethanols für technische Anwendungen durch azeotrope Rektifikation (Schleppmittelrektifikation). Die Anlage besteht aus zwei Rektifikationskolonnen. In der Haupttrennsäule erfolgt die Rektifikation des Ethanol-Wasser-Gemischs bis in die Nähe des azeotropen Punkts. Das Sumpfprodukt ist Wasser.[24]
Dem Kopfprodukt, das aus 95,6 % Ethanol und 4,4 % Wasser besteht, wird der Hilfsstoff Cyclohexan beigemischt. Früher übliche Schleppmittel wie Benzol im Young-Verfahren oder wie Trichlorethan im Drawinol-Verfahren werden heutzutage nicht mehr verwendet. Dieses Dreistoffgemisch aus Ethanol, Wasser und Schleppmittel gelangt in die Hilfsstoff-Trennsäule. Dort erfolgt eine Auftrennung in den im Sumpf anfallenden reinen Alkohol sowie in ein Cyclohexan-Wasser-Gemisch als Kopfprodukt. Cyclohexan und Wasser sind im flüssigen Zustand nicht mischbar und trennen sich nach der Kondensation in einem Abscheider (Dekanter). Der Hilfsstoff Cyclohexan wird am Einlauf der Hilfsstoff-Trennsäule wieder dem zuströmenden, azeotropen Ethanol-Wasser-Gemisch beigefügt. Er läuft im Kreislauf im oberen Bereich der Hilfsstoff-Trennsäule und wird deshalb als „kopflaufender Hilfsstoff“ bezeichnet. Wasserfreies Ethanol wird im Labormaßstab durch Destillation über wasserentziehenden Chemikalien wie Calciumoxid, wasserfreiem Calciumsulfat oder Molsieben gewonnen.[24] Der Prozess der Herstellung von Absoluten Alkohol wird als Absolutierung bezeichnet.
Technische Synthesen
Ethanol wird durch chemische Synthese aus Wasser und Ethen im sogenannten Indirekten Prozess homogenkatalytisch unter Zugabe von Schwefelsäure hergestellt. Der Prozess läuft zweistufig ab unter Bildung von Schwefelsäureestern, die in einem zweiten Schritt hydrolysiert werden müssen. Die Schwefelsäure muss nach erfolgter Hydrolyse wieder aufkonzentriert werden.[25] Im Direkten Prozess dient auf Silika aufgebrachte Phosphorsäure als heterogener Katalysator. Bei Temperaturen bis zu 300 °C und Drücken von 70 bar Druck wird Ethanol direkt aus Ethen und Wasser in der Gasphase hergestellt. Der Umsatz beträgt pro Reaktordurchgang allerdings nur 5 % bezogen auf Ethen.[25] Wegen der Abwasserproblematik und Korrosionsproblemen durch die anfallende Schwefelsäure beim Indirekten Prozess wird Ethanol industriell heutzutage mittels Phosphorsäurekatalyse hergestellt. Die Bruttogleichung für beide Prozesse lautet:
Prinzipiell ist die Gewinnung von Ethanol durch katalytische Hydrierung von Acetaldehyd möglich. Bei Wasserstoffdrücken von etwa 300 bar wird Acetaldehyd dabei an Nickel- oder Kupfer-haltigen Kontakten umgesetzt.[26]
Ethanol fällt im Synol-Verfahren durch Reaktion von Kohlenstoffmonoxid mit Wasserstoff an und kann destillativ von den anderen entstehenden Alkoholen getrennt werden. Durch Radiokohlenstoffdatierung lässt sich synthetisches Ethanol aus fossilen Rohstoffen von Ethanol aus nachwachsenden Rohstoffen unterscheiden. Dieser Umstand lässt sich zum Nachweis des Panschen von Wein oder Spirituosen mit industriellem Ethanol nutzen.[27] Bei durch Gärprozesse hergestelltem Ethanol lässt sich über die Deuteriumverteilung die pflanzliche Herkunft feststellen.[28]
Produktionsmengen
Weltweit erzeugten die USA und Brasilien 2005 zusammen über 90 % der Jahresproduktion von 365,67 Mio. hl (36,567 Mrd. l).[29] Die größten europäische Erzeuger sind Russland und Frankreich. Deutschland erzeugt jährlich fast 4 Mio. hl zu gleichen Teilen als Getränkealkohol und als Alkohol für chemisch-technische Zwecke, was einer Eigenbedarfsdeckung von etwa 62 % entspricht.
Neben der Produktion von Neutralalkohol für Getränke, Lebensmittel und technische Zwecke entfallen weltweit etwa 65 % auf die Herstellung von Kraftstoffethanol.[30] In den USA wird der Aufbau neuer Produktionsanlagen für Ethanol besonders forciert, vor allem durch das Gesetz „Energy Policy Act“ (EPACT) von 2005, das den Ausbau von erneuerbaren flüssigen Energieträgern fördern soll.
Besteuerung und Vergällung
Ethanol unterliegt in Deutschland der Branntweinsteuer. Diese wird von der Zollverwaltung beim Inverkehrbringer (Spirituosenhersteller, berechtigter Empfänger, Branntweinlagerinhaber) zum Zeitpunkt des Lagerabganges erhoben. Ein Versand unter Steueraussetzung ist per BVD oder EVD möglich – beispielsweise zwischen Hersteller und Großhändler mit offenem Branntweinlager sowie bei Exportgeschäften.
Für technische Zwecke, etwa in Druckereien, bei der Lackherstellung, Reinigungsmittelproduktion, für Kosmetik und ähnliche Einsatzgebiete und als Brennspiritus ist die Verwendung von Ethanol steuerfrei möglich. Um zu verhindern, dass dieses Ethanol ohne Entrichtung der Steuer als Genussmittel getrunken oder solchen beigefügt wird, wird unversteuerter Alkohol unter Zollaufsicht vergällt. Vergällung bedeutet, dass Ethanol mit anderen Chemikalien, wie beispielsweise Methylethylketon (MEK) und zwei weiteren branntweinsteuerrechtlich vorgeschriebenen Markierungskomponenten, Petrolether, Cyclohexan, Diethylphthalat oder ähnlichem versetzt wird, um es für den menschlichen Genuss unbrauchbar zu machen. Dies wird in Deutschland über die Branntweinsteuerverordnung (BrStV)[31] und in Österreich über die Verordnung des Bundesministers für Finanzen über die Vergällung von Alkohol (VO-Vergällung) geregelt.[32]
Bioethanol für die Beimischung zu Kraftstoff wird bei der Produktion mit ETBE oder Benzin vergällt. Die oben genannten, für Spiritus oder kosmetische Zwecke gängigen Vergällungsmittel, beispielsweise Methylethylketon, dürfen in Kraftstoffen nach EN 228 nicht verwendet werden.
Bei dem in Form von Brennspiritus als Brennstoff verwendeten Ethanol, beispielsweise für Rechauds sowie Camping- und Expeditionskocher, wird dem Ethanol zusätzlich zum MEK noch das extrem bittere Denatoniumbenzoat (1 Gramm/100 Liter) beigemischt. Die früher übliche Verwendung von Pyridin als Vergällungsmittel für Brennspiritus ist branntweinsteuerrechtlich zwar immer noch erlaubt, dieses wird wegen seiner gesundheitlichen Bedenklichkeit seit 1993 von deutschen Herstellern nicht mehr eingesetzt. Im Gegensatz zu Pyridin, das einen Siedepunkt von 115 °C aufweist, ist Denatoniumbenzoat ein Feststoff, der erst bei 163 bis 170 °C schmilzt. Es verdampft daher bei der Verwendung von Brennspiritus nicht, sondern reichert sich in den Dochten von Spiritusgeräten an, was zum Beispiel bei Spiritusglühlichtern und Spiritus-Vergaserkochern zu Betriebsstörungen führt.
Einige Spiritusabfüller mischen dem Ethanol diverse Fremdstoffe bei, vermutlich aus Kostengründen. Abfüller, die in ihrem Produkt dagegen nur Ethanol verwenden, werden dies zumeist durch die Kennzeichnung „UN 1170“ deutlich machen.
Die Vergällungsmittel haben meist ähnliche Siedepunkte wie Ethanol, so dass sie sich durch Destillieren nur schwierig entfernen lassen. Die Vergällungsmittel Diethylphthalat, das Verwendung als Weichmacher findet, und MEK stellen ein Problem bei der Verwendung als Reinigungsmittel dar. Farben und Lacke, die an sich resistent gegen Ethanol sind, können erweichen oder angegriffen werden.
Eigenschaften
Physikalische Eigenschaften
| Flammpunkt | 12 °C[1] |
| Zündtemperatur | 425 °C[1] |
| Explosionsgrenzen | untere: 3,4 Vol.-%/obere: 15 Vol.-%[1] |
| Schallgeschwindigkeit | 1180 m·s−1 (20 °C) Temp.-Abhängigkeit: −3,6 m·s−1·°C−1 |
| Dichte | 0,79 g·cm−3 = 0,79 kg·dm−3 |
| Energiedichte bzgl. der Masse | 7,44 kWh·kg−1 = 26,78 MJ·kg−1[33] |
| Energiedichte bzgl. des Volumens | 5,87 kWh·l−1 = 21,14 MJ·l−1[33] |
| dynamische Viskosität | 1,2 · 10−3 Pa·s (20 °C) |
| kinematische Viskosität | 1,52 · 10−6 m2·s−1 (20 °C) |
| Oberflächenspannung | 0,02255 N·m−1 (20 °C) |
| Brechungsindex | 1,3638[1] |
| Biologische Abbaubarkeit | 94 % (OECD 301 E) |
| UN-Nummer | 1170 |
| Gefahrennummer | 30 + 33 |
Herausragendes Merkmal des Ethanols ist seine Hydroxygruppe. Da ein Sauerstoffatom Elektronen stärker anzieht als Wasserstoff und Kohlenstoff, resultiert eine asymmetrische Verteilung der Elektronendichte entlang dieser Bindung: Es bildet sich ein molekularer Dipol. Dieser verleiht Ethanol seine typischen Eigenschaften. Zum einen ziehen sich die Dipole auf molekularer Ebene gegenseitig an, so dass eine vergleichsweise hohe Siedetemperatur von 78 °C resultiert (Sp, Ethan = −88,6 °C), zum anderen ist Ethanol mit Flüssigkeiten mischbar, die ähnliche Dipoleigenschaften aufweisen, zum Beispiel Wasser und Methanol. Diese Eigenschaft wird als Hydrophilie bezeichnet. Gleichzeitig besitzt das Molekül einen organischen Rest, der ihm eine begrenzte Mischbarkeit mit rein lipophilen Substanzen verleiht. Aus diesem Grund ist Ethanol in der Chemie und Pharmazie ein wichtiges Lösungsmittel. Pflanzenauszüge oder andere Medikamente werden als alkoholische Lösungen, sogenannte „Tinkturen“, angeboten.
Ethanol bildet am Gefrierpunkt ausreichend große Einkristalle für die Bestimmung mittels Kristallstrukturanalyse. Es kristallisiert im monoklinen Kristallsystem und weist bei 87 K die folgenden Gitterparameter a = 537,7 pm, b = 688,2 pm, c = 825,5 pm und β = 102,2 ° auf sowie 4 Formeleinheiten pro Elementarzelle.[34] Die Moleküle bilden über Wasserstoffbrückenbindungen mit einem Sauerstoff-Sauerstoff-Abstand von 271,6 pm und 273,0 pm lange Ketten. Die Konformation um die Kohlenstoff-Kohlenstoff-Bindung ist in beiden Molekülen versetzt. Während die Hydroxygruppe in einem Molekül entlang der C–C–OH-Achse eine gauche-Konformation besitzt, weist das andere Molekül eine trans-Konformation auf.[34]
Ethanol ist in jedem Verhältnis mit Wasser mischbar. Dabei kommt es beim Vermischen unter Wärmeentwicklung zu einer Volumenkontraktion. Das Gesamtvolumen einer Wasser/Ethanol-Mischung ist kleiner als die Summe der Einzelvolumina. So entstehen durch Mischen von 50 ml Ethanol mit 50 ml Wasser 97 ml Ethanol-Wasser-Gemisch.
Der Schmelzpunkt wässriger Ethanollösungen sinkt mit steigendem Ethanolgehalt, bis bei einem Gehalt von 93,5 Ma% ein Eutektikum mit einer Schmelztemperatur von −118 °C erreicht wird.[35] Bei Temperaturen um −20 °C verdunstet Ethanol (96 %) kaum noch und zeigt eher zähflüssige Eigenschaften. Bei −70 °C wird es noch zähflüssiger (Kühlol).
Ethanol bildet mit vielen anderen Stoffen azeotrope Gemische.
In organischen Lösungsmitteln wie Tetrachlorkohlenstoff bildet Ethanol in Abhängigkeit von der Konzentration über Wasserstoffbrückenbildung Dimere, Trimere und Tetramere. Die Bildungsenthalpie ist über Infrarotspektroskopieuntersuchungen ermittelbar. Diese liegt für das Tetramer bei 92 kJ mol−1, bei 42 kJ mol−1 für das Trimer und bei 21 kJ mol−1 für das Dimer.[36][37]
-
Exzessvolumen (Volumenkontraktion) bei der Mischung von Ethanol und Wasser
-
Fest-Flüssig-Phasendiagramm von Ethanol-Wasser-Gemischen
Spektroskopische Eigenschaften
Im Protonenresonanzspektrum weist Ethanol bei Raumtemperatur eine Triplettstruktur durch Kopplung der Protonen der Hydroxygruppe mit den Methylenprotonen auf. Dies weist auf eine Fixierung der Hydroxygruppe gegenüber den Methylenprotonen hin. Mit steigenden Temperaturen wird die Aufspaltung kleiner und verschwindet durch die steigende Rotation der Hydroxygruppe schließlich ganz.[38]
Das Infrarotspektrum für Ethanol weist eine C-H-, eine O-H- und eine C-O-Streckschwingung sowie verschiedene Biegeschwingungen auf. Die O-H-Streckschwingung erscheint als eine breite Bande bei etwa 3300–3500 cm−1, die C-H-Streckschwingung bei etwa 3000 cm−1.[39]
-
1H-NMR-Spektrum von Ethanol
-
Infrarotspektrum von flüssigen Ethanol,
mit einer O-H-Bande bei 3300 cm−1
und einer C-H-Bande bei 2950 cm−1
Chemische Eigenschaften
Die OH-Gruppe des Ethanols ist mit einem pKs-Wert von 16[4] sehr schwach sauer, wodurch sie in der Lage ist, mit starken Basen (wie etwa den Alkalimetallen Natrium und Kalium) ein Proton (H+) abzuspalten. Durch Umsetzen mit Alkalimetallen wird Ethanol quantitativ in seine deprotonierte Form, das Ethanolat-Ion (CH3CH2O−) überführt. Die Reaktion verläuft unter Entwicklung von Wasserstoff ab:
Ethanol löst sich in allen Verhältnissen mit Wasser und vielen anderen organischen Lösungsmitteln wie Diethylether, Chloroform und Benzol.
Autoprotolyse
Ethanol kann sowohl als Brønsted-Säure als auch als Brønsted-Base reagieren und ist damit ein Ampholyt:
wobei die Autoprotolysekonstante pKau = 19,5 ist.
Nukleophile Substitution
In aprotischen Lösungsmitteln reagiert Ethanol mit Halogenwasserstoffen über eine nukleophile Substitution zu Ethylhalogeniden. Ethanol und Chlorwasserstoff reagieren zu Ethylchlorid und Wasser.
Ethanol und Bromwasserstoff reagieren zu Ethylbromid und Wasser.
Ethylhalogenide können spezifischer durch Halogenierungsreagenzien wie Thionylchlorid oder Phosphortribromid gebildet werden.
Veresterung
Säurekatalysiert reagiert Ethanol mit Carbonsäuren zu Ethylestern:
Ethylester finden Verwendung als Zusätze für Kosmetika sowie Geruchs- und Geschmacksstoffe.
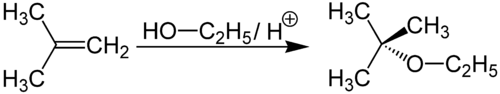
Dehydratation
Sehr starke Säuren, wie Schwefelsäure, katalysieren die Dehydratation des Ethanols. Es bilden sich Diethylether oder Ethen:
Ethanol spaltet in einer Eliminierungsreaktion Wasser unter Bildung einer Doppelbindung ab.
Welches Produkt sich bildet, hängt von den Reaktionsbedingungen wie Temperatur, Konzentrationen usw. ab. Bei der Dehydratation kann unter bestimmten Reaktionsbedingungen das hochgiftige Diethylsulfat gebildet werden.[40]
Oxidation
Ethanol kann bereits von Luftsauerstoff bei Raumtemperatur über Acetaldehyd bis hin zur Essigsäure oxidiert werden. Derartige Reaktionen werden beispielsweise in biologischen Systemen von Enzymen katalysiert. Im Labor dienen kräftige anorganische Oxidationsmittel wie Chromsäure oder Kaliumpermanganat zur Oxidation zu Essigsäure. Die teilweise Oxidation bis zum Acetaldehyd gelingt mit schwächeren Oxidationsmitteln, etwa mit Pyridiniumchlorochromat (PCC).
Die Oxidation des Ethanols muss nicht auf der Stufe der Essigsäure stehenbleiben. An Luft verbrennt Ethanol mit blauer Flamme mit einem Heizwert von etwa 30 MJ/kg zu Kohlendioxid und Wasser:
Mit Chlor oder Brom reagiert Ethanol zu Acetaldehyd. Dieses bildet mit überschüssigen Ethanol Halbacetale. Die weitere Oxidation mit Chlor führt zu Halbacetalen des Chlorals. In der Reaktion mit Thionylchlorid bildet sich Ethylchlorid.
Desinfektion aufgrund Denaturierung
Entsprechend der Denaturierung durch Säuren oder Laugen kann Ethanol die in Biopolymeren zur Aufrechterhaltung der Struktur erforderlichen Wasserstoffbrücken stören, indem er als polares Lösungsmittel interferiert.[41] Daraus resultieren Konformationsänderungen. 50 bis 70%iges Ethanol denaturiert die meisten Proteine und Nukleinsäuren. Da durch Zerstörung der Raumstruktur Membranproteine ihre Funktion einbüßen und aufgrund der Membrandefekte die betreffenden Zellen luftballonartig platzen, kann mit höherprozentigem Ethanol desinfiziert werden: Bakterien- und Pilzzellen werden über die Denaturierung ihrer Membranproteinen irreversibel inaktiviert, entsprechend werden behüllte Viren ihrer proteinhaltigen Hülle beraubt.[42]
Verwendung

Ethanol findet Verwendung in den drei Hauptmärkten Alkoholische Getränke, als Rohstoff für die chemische Industrie und als Energieträger. Ethanol, das aus der Vergärung von Zucker- und stärkehaltigen Lebensmitteln stammt, wird in allen Bereichen eingesetzt, während synthetisches Ethanol nur als Chemierohstoff und Energieträger verwendet wird. Die konkurrierende Verwendung von Ethanol aus der Nahrungsmittelproduktion als Chemie- und Energierohstoff wird kontrovers diskutiert.
Die Hauptmenge des produzierten Ethanols wird in Form von alkoholischen Getränken für Genusszwecke verbraucht.[1] Es dient weiterhin als Lösungsmittel sowohl für Konsumprodukte unter anderem im Haushalt (Parfüm, Deodorant), als auch für medizinische Anwendungen (Lösungsmittel für Medikamente, Desinfektionsmittel) sowie in der Industrie selbst ebenfalls als Lösungsmittel und allgemein als Brennstoff.
Haushalts- und Konsumprodukte
Ethanol findet als hervorragendes Lösungsmittel überall im Haushalt Verwendung, so als Träger für Geruchsstoffe wie Parfüm, Deodorant und Duftspray. Als Reinigungsmittel beispielsweise für Glas, Chrom, Kunststoff, Scheibenwaschanlage und als Fleckenentferner findet Ethanol Verwendung. Als Zusatz zum Wasser dient es als Frostschutzmittel.
Ethanol findet verbreiteten Einsatz als Lebensmittelzusatz. So werden Portweinen, Sherry und anderen Südweinen Ethanol zugegeben, die so genannte Aufspritung, um zum gewünschten Zeitpunkt den Fermentationsprozess zu beenden.[43] Durch die vorzeitig beendete Gärung haben diese Weine und Liköre einen hohen Restzuckergehalt und sind dadurch sehr süß.[44]
Ethanol kann zur Haltbarmachung anderer Lebensmittel zugesetzt werden.[45]

Als Brennstoff für Campingkocher als so genannter Brennspiritus findet Ethanol im Haushalt eine energetische Verwendung. Durch Zugabe von Celluloseacetat oder Seife kann Brennspiritus in ein Gel, so genannter Hartspiritus überführt werden.[46]
Medizin
Die Wirksamkeit als Desinfektionsmittel oder Antiseptikum (etwa zur Händedesinfektion) hängt von der Konzentration des Ethanol-Wasser-Gemisches ab. Bei einem optimalen Alkoholgehalt zwischen 50 und 80 %[47] wird die Bakterienhülle zerstört und Ethanol wirkt damit tödlich. Alle Bakterien einschließlich der Tuberkelbakterien werden innerhalb einer Minute durch Denaturierung der Bakterienzellwand abgetötet (Bakterizidie). Daneben wirken Ethanol-Wasser-Mischungen durch ihren hohen Osmotischen Druck; 70 %iges Ethanol weist den höchsten osmotischen Druck von 250·106 Pascal der Mischungen mit Wasser auf.[2] Eingeschränkt wirksam ist er gegen Viren, nicht wirksam gegen Bakterien-Endosporen. Bei offenen Wunden sollte das Gemisch nicht eingesetzt werden (Brennen). Lösungen mit über 80 % Alkoholgehalt zeigen eine noch stärkere Wirkung, aber werden aufgrund der mangelnden Hautverträglichkeit nicht regelmäßig eingesetzt. Wasserfreies Ethanol härtet die Bakterienhülle, die Bakterien bleiben dadurch am Leben.[48] Das Trinken von Ethanol oder alkoholischen Getränken wirkt nicht antiseptisch. Getränke mit einem Ethanolgehalt von weniger als 20 % töten praktisch keine Keime ab. Durch Kombination mit Alkalien (etwa 1 %) oder Peroxycarbonsäuren (0,2 bis 0,5 %) wird die Wirksamkeit unter anderem gegen Viren und Sporen stark verbessert.[47] Ethanol dient als Lösungsmittel zur Herstellung der Iodtinktur, einer Mischung aus Iod in Ethanol zur Wunddesinfektion, der zu Vermeidung der Bildung von Iodwasserstoff Kaliumiodid zugegeben wird.
95 %iges Ethanol kann zur Verödung „heißer“ Schilddrüsenknoten und anderer umschriebener Tumore benutzt werden;[49] das Verfahren wird als Perkutane Ethanol-Injektionstherapie bezeichnet.[50]
Flüssige Medikamente können Ethanol als Lösungsmittel oder Lösungsvermittler enthalten, wenn der Arzneistoff beziehungsweise die Arzneistoffe in Wasser schlecht oder unlöslich sind. Ethanol selbst ist mit Wasser beliebig mischbar. Es hat eine wichtige Funktion in der Konservierung und Stabilisierung flüssiger pflanzlicher Medikamente (Phytotherapeutika). Die Medikamente sind entsprechend der Arzneimittel-Warnhinweisverordnung (AMWarnV) zu kennzeichnen.
Durch Einreiben der Haut mit hochprozentiger Ethanollösung (beispielsweise Franzbranntwein) wird die Durchblutung gefördert. Volksmedizinisch werden verdünnte ethanolische Lösungen zur Behandlung von Insektenstichen verwendet. Ein alkoholgetränktes Tuch wird dazu einige Zeit auf den frischen Stich gelegt. Die Schmerzlinderung geschieht aufgrund der kühlenden Wirkung der Ethanollösung; der Juckreiz wird unterdrückt. Eine chemische Veränderung oder Inaktivierung der Gifte bewirkt Ethanol jedoch nicht.
Bei einer Vergiftung mit Methanol wird als erste Maßnahme Ethanol intravenös gegeben, was die Umwandlung von Methanol über das Enzym Alkoholdehydrogenase in das giftige Methanal hemmt. Ethanol bindet etwa 25-mal stärker an Alkoholdehydrogenase als Methanol.[51] Bei einer schweren Alkoholsucht kann ein Alkoholprädelir mit Ethanol unterbrochen werden, um eine akute Zweiterkrankung ohne die sonst auftretenden Symptome behandeln zu können.
Ethanol als Kraftstoff

Ethanol findet als Ethanol-Kraftstoff in Form des biogenen Bioethanol Verwendung als Kraftstoff für Ottomotoren, wobei vor allem Mischungen mit Benzin vorliegen. Dafür kann sowohl fossiles als auch aus regenerativer Biomasse hergestelltes Bioethanol verwendet werden, da es chemisch gesehen keinen Unterschied zwischen beiden Arten gibt. Aufgrund der Verfügbarkeit, der Herstellungskosten und politischer Fördermaßnahmen wird heute vor allem Bioethanol verwendet, das auf der Basis von fermentierbarem Zucker (Zuckerrohr und Zuckerrübe) und Stärke (vor allem Mais- und Weizenstärke) erzeugt wird. Es wird diskutiert, ob zukünftig die Nutzung von Cellulose-Ethanol aus Holz möglich ist.
Ethanol wird vor allem als Beimischung zu herkömmlichem Kraftstoff genutzt, beispielsweise in einer Konzentration von 5 % Ethanol (E5 als Beimischung in gewöhnlichem Fahrzeugbenzin) oder 85 % Ethanol (als E85 für dafür geeignete Fahrzeuge). Im Zusammenhang mit dem Kyoto-Protokoll wird heute häufig über die Herstellung und den Einsatz biogener Treibstoffe (Biokraftstoffe) und die Reduzierung von Kohlenstoffdioxid-Emissionen pro gefahrenem Kilometer debattiert. In der Europäischen Union stieg die Produktionsmenge von Ethanol für den Kraftstoffsektor von 525 Millionen Liter im Jahr 2004 auf 3,7 Milliarden Liter im Jahr 2009.[52]
Ethanol wurde nach einer Entwicklung von Wernher von Braun zudem bis in die 1950er-Jahre als Treibstoff für die Raketen der Typen A1, A2, A3, A4, A4b und A5 verwendet. Im Unterschied zu Benzin kann durch Verdünnen mit Wasser für Testzwecke leicht der Heizwert heruntergesetzt werden, um bei Probeläufen von Triebwerken Explosionen zu verhindern, zum anderen war Ethanol während des Zweiten Weltkriegs leicht aus landwirtschaftlichen Produkten gewinnbar, im Gegensatz zum knappen Benzin.
Neben reinem Ethanol finden seine Derivate Einsatz im Kraftstoffbereich. So wird Ethyl-tert-butylether (ETBE) analog zum Methyl-tert.-butylether zur Erhöhung der Oktanzahl von Ottokraftstoffen eingesetzt. ETBE wird durch säurekatalysierte Addition von Ethanol an Isobuten hergestellt:
Weitere Nutzung von Ethanol
Ethanol ist ein wichtiges Lösungsmittel und Zwischenprodukt in der Chemischen Industrie. Ein wichtigstes Folgeprodukt ist Ethylchlorid, das aus Ethanol durch Umsetzung mit Chlorwasserstoff hergestellt wird.[25] Die Oxidation liefert weitere Folgeprodukte wie Acetaldehyd und Essigsäure.[25]
Ethanol wird in einer Vielzahl von Veresterungsreaktionen eingesetzt. Die erhaltenen Ester haben vielfältige Verwendungsmöglichkeiten als Lösungsmittel und als Zwischenprodukt für Folgesynthesen. Ein wichtiges Folgeprodukt ist Ethylacrylat, ein Monomer, das als Co-Monomer in verschiedenen Polymerisationsprozessen eingesetzt wird. Essigsäureethylester wird als Lösungsmittel für Klebstoffe und Nagellack und zur Extraktion von Antibiotika eingesetzt. Glycolether wie 2-Ethoxyethanol sind als Lösungsmittel für Öle, Harze, Fette, Wachse, Nitrozellulose und Lacke weit verbreitet.
In Umkehrung der petrochemischen Herstellungsreaktion entsteht aus Ethanol wieder Ethen, das zum Beispiel von Braskem als Rohstoff für die Polyethylenherstellung genutzt wird. In einer Anlage in Rio Grande, Brasilien, produziert Braskem bereits auf Zuckerrohr basierendes Polyethylen in einer Anlage mit einem Ausstoß von 200.000 t pro Jahr.[53]
Biologische Bedeutung
Ethanol wird im gesamten Verdauungstrakt aufgenommen. Dies beginnt in geringem Umfang bereits in der Mundschleimhaut. Das dort resorbierte Ethanol geht direkt in das Blut über und wird damit über den gesamten Körper einschließlich des Gehirns verteilt. Etwa 20 % werden im Magen resorbiert; der Rest im Dünndarm.[54] Das in Magen und Darm aufgenommene Ethanol gelangt zunächst mit dem Blut in die Leber, wo es teilweise abgebaut wird. Die Ethanolaufnahme wird durch Faktoren, welche die Durchblutung steigern, erhöht, beispielsweise Wärme (Irish Coffee, Grog), Zucker (Likör) und Kohlenstoffdioxid (Sekt). Dagegen verlangsamt Fett die Aufnahme. Dies führt nicht zu einer niedrigeren Resorption des Alkohols insgesamt, sondern nur zu einer zeitlichen Streckung.[55]
Etwa 2–10 % des aufgenommenen Ethanols werden unverändert über Urin, Schweiß und Atemluft wieder abgegeben.[56] Ein Teilabbau findet schon im Magen statt; eine dort gefundene sigma-Alkoholdehydrogenase zeigt eine etwa um den Faktor 200 höhere Aktivität als die in der Leber lokalisierten Isoenzyme. Der Anteil am gesamten Ethanolabbau beträgt lediglich ungefähr 5 %.[57]
In der Leber wird der Hauptteil des Ethanols – wie andere wasserlösliche Gifte – durch die Enzyme Alkoholdehydrogenase (ADH) und Katalase sowie das MEOS-System zu Ethanal (Acetaldehyd, H3C-CHO) abgebaut, um weiter durch Acetaldehyddehydrogenase zu Essigsäure oxidiert zu werden. Die Essigsäure wird über den Citratzyklus und die Atmungskette in allen Zellen des Körpers unter Energiegewinnung zu CO2 veratmet. Die Leber kann bei erheblich gesteigertem, regelmäßigem Konsum ihre Abbauaktivität in geringem Maße anpassen. Das Zwischenprodukt Ethanal ist für die so genannten „Kater“-Symptome wie Kopfschmerzen, Übelkeit und Erbrechen[58] mitverantwortlich. Der Abbau des Ethanals wird durch Zucker gehemmt, daher ist der Kater bei süßen alkoholischen Getränken, insbesondere Likör, Bowlen und manchen Sektsorten besonders intensiv.
Die Abbaurate durch die Alkoholdehydrogenase ist innerhalb gewisser Grenzen konstant. Sie beträgt bei Männern etwa 0,1 g pro Stunde und kg Körpergewicht, bei Frauen 0,085 g/h und kg/KG.[59][60] Die exakt gemessenen Abbauraten für Männer lagen dabei zwischen 0,088 und 0,146 g/h und kg Körpergewicht.[57] Bei Männern findet sich eine leicht erhöhte Aktivität der gastrischen Alkoholdehydrogenase im Magen, mit der Folge einer geringfügigen Beschleunigung des Alkoholabbaus. Hochdosierte Aufnahme von Fructose kann bei manchen Menschen durch Unterstützung des Katalase-Ethanolabbaus zu einer schnelleren Metabolisierung führen.[58] Bei höherer Alkoholkonzentration – ab etwa 50 g Ethanolaufnahme pro Tag[57] – oder bei chronischen Trinkern wird der Alkohol zusätzlich über das mikrosomale Ethanol oxidierende System (MEOS) abgebaut. Dabei wird Ethanol in den Mikrosomen der Leberzellen durch Cytochrom P450 (CYP2E1) unter Sauerstoffverbrauch ebenfalls zu Ethanal oxidiert. Ethanol bewirkt situativ eine Betäubung, eine Stimulation oder einen Stimmungswandel. Es führt zu einer Erweiterung insbesondere der peripheren Blutgefäße.
Toxikologie
Ethanol ist weder als Gift noch als gesundheitsschädlich eingestuft, jedoch wird es von Pathologen zu den „obligat hepatotoxischen Stoffen“,[61] also zu den Lebergiften, gezählt; es gilt ein „direkter toxischer Effekt des Alkohols auf die Erythropoiese“, die Bildung roter Blutzellen, als gesichert[62]; Pädiater nennen ihn eine „teratogene Noxe“[63], also ein die Leibesfrucht schädigendes Gift und die Pharmakologen/Toxikologen sprechen von „akuter Vergiftung“ ab einer bestimmten Schwellendosis sowie von einer „chronischen Vergiftung“ beim Alkoholismus.[64] So zeigen verdünnte Lösungen von Ethanol in Wasser schon bei Konzentrationen von wenigen Volumenprozenten physiologische Effekte. Die Aufnahme führt – ab etwa 0,5–1 Promille Ethanolkonzentration im Blut – zu typischen akuten Trunkenheitssymptomen wie Schwindel, Übelkeit, Orientierungsstörung, Redseligkeit und gesteigerter Aggressivität. Die Letale Dosis (LD) liegt etwa bei 3,0 bis 4,0 Promille für ungeübte Trinker. Es wurden jedoch schon Werte über 7 Promille gemessen.[65] Die LD50 beträgt für die Ratte 7060 mg/kg bei oraler Applikation.[7] Bei einer akuten Ethanolvergiftung kann der noch im Magen befindliche Alkohol durch Herbeiführen von Erbrechen oder durch Auspumpen des Mageninhalts teilweise entfernt werden.
Nachweis
Ethanol kann durch Veresterung als p-Nitrobenzoesäureester oder 3,5-Dinitrobenzoesäureester nachgewiesen werden. Die Reaktion erfolgt durch Umsetzung mit dem entsprechenden Säurechlorid. Unspezifisch kann Ethanol durch die Iodoformprobe nachgewiesen werden. Durch chromatografische Methoden wie der Gaschromatografie kann Ethanol quantitativ bestimmt werden. Nasschemisch-quantitativ ist der Nachweis durch Oxidation mit einem Überschuss von Kaliumdichromat möglich, wobei das nicht umgesetzte Kaliumdichromat jodometrisch ermittelt werden kann. In der Lebensmittelanalytik wird der Dichteunterschied zwischen Wasser und Ethanol sich zu nutze gemacht. Der Ethanolgehalt wird in einer (Wasserdampf-)Destillation abgetrennt und pyknometrisch bestimmt. Alternativ kann die Dichte auch im Biegeschwinger gemessen werden. Bei beiden Verfahren wird anhand von Tabellenwerten ausgewertet..
Die Ethanolkonzentration während des Herstellungsprozesses, etwa in Brauereien, kann infrarotspektroskopisch durch die Messung der Intensität der Schwingungsfrequenz der C-H-Bande bei 2900 cm−1 überwacht werden.
Literatur
- Allinger, Cava, de Jongh, Johnson, Lebel, Stevens: Organische Chemie, 1. Auflage, Walter de Gruyter, Berlin 1980, ISBN 3-11-004594-X, S. 125–127.
- Beyer / Walter: Lehrbuch der Organischen Chemie, 19. Auflage, S. Hirzel Verlag, Stuttgart 1981, ISBN 3-7776-0356-2, S. 115–117.
- Morrison / Boyd: Lehrbuch der Organischen Chemie, 3. Auflage, VCH, Weinheim 1986, ISBN 3-527-26067-6, S. 526–527.
Siehe auch
Weblinks
- Wie wirkt Alkohol im Gehirn?, Beitrag vom 10. Februar 2004 bei Quarks & Co
- „Alkohol“ Ethanol – ein Artikel zum Thema von Peter Bützer (PDF-Datei; 966 kB)
Einzelnachweise
- ↑ 1,0 1,1 1,2 1,3 1,4 1,5 1,6 1,7 Thieme Chemistry (Hrsg.): Eintrag zu Ethanol im Römpp Online. Version 3.29. Georg Thieme Verlag, Stuttgart 2012, abgerufen am 11. November 2011.
- ↑ 2,0 2,1 Gerhard Eisenbrand (Hrsg.), Peter Schreier (Hrsg.): RÖMPP Lexikon Lebensmittelchemie. 2. Auflage, Thieme Verlag, Stuttgart 2006, S. 322.
- ↑ 3,0 3,1 3,2 3,3 3,4 3,5 Eintrag zu CAS-Nr. 64-17-5 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 5. Januar 2008 (JavaScript erforderlich).
- ↑ 4,0 4,1 4,2 4,3 4,4 4,5 4,6 4,7 Ethanol bei ChemIDplus.
- ↑ 5,0 5,1 Eintrag aus der CLP-Verordnung zu CAS-Nr. 64-17-5 in der GESTIS-Stoffdatenbank des IFA (JavaScript erforderlich)
- ↑ Seit 1. Dezember 2012 ist für Stoffe ausschließlich die GHS-Gefahrstoffkennzeichnung zulässig. Bis zum 1. Juni 2015 dürfen noch die R-Sätze dieses Stoffes für die Einstufung von Zubereitungen herangezogen werden, anschließend ist die EU-Gefahrstoffkennzeichnung von rein historischem Interesse.
- ↑ 7,0 7,1 G. Stuart Wiberg, H. Locksley Trenholm, Blake B. Coldwell: Increased ethanol toxicity in old rats: Changes in LD50, in vivo and in vitro metabolism, and liver alcohol dehydrogenase activity, in: Toxicology and Applied Pharmacology, 1970, Vol. 16, S. 718–727; doi:10.1016/0041-008X(70)90077-3.
- ↑ Gigiena i Sanitariya. For English translation, see HYSAAV, 1967, Vol. 32(3), S. 31.
- ↑ Raw Material Data Handbook, Vol.1: Organic Solvents, 1974. Vol. 1, S. 44.
- ↑ Matti Välimäki, Matti Härkönen, Reino Ylikahri: Acute Effects of Alcohol on Female Sex Hormones, in: Alcoholism: Clinical and Experimental Research, 1983, Vol. 7, S. 289–293; doi:10.1111/j.1530-0277.1983.tb05462.x.
- ↑ S. J. Baker, G. J. Chrzan, C. N. Park, J. H. Saunders: Behavioral effects of 0 and 0.05% blood alcohol in male volunteers, in: Neurobehavioral Toxicology and Teratology, 1986, Vol. 8, S. 77–81; PMID 3703098.
- ↑ M. Yamagishi, T. Iwasaki: Acute alcohol intoxication in a two-month-old baby, in: Journal of UOEH, 1987, Vol. 9, S. 53–59; PMID 3576010.
- ↑ Robert Dudley: Ethanol, fruit ripening, and the historical origins of human alcoholism in primate frugivory; doi:10.1093/icb/44.4.315.
- ↑ J. Westermeyer: Cross-cultural studies on alcoholism. In: H. W. Goedde: Alcoholism: Biomedical and genetic aspects. Pergamon Press, New York; S. 305–311.
- ↑ 15,0 15,1 Diana von Cranach: Drogen im Alten Ägypten. In: G. Völger, K. Welck: Rausch und Realität: Drogen im Kulturvergleich, Bd. 2, Rowohlt, Reinbek 1982, ISBN 3-499-34006-2; S. 480–487.
- ↑ Helmut Hans Dittrich: Mikrobiologie des Weines, 240 Seiten, Ulmer Eugen Verlag, (2005) ISBN 3-8001-4470-0, S. 89
- ↑ Claus Priesner, Karin Figala: Alchemie: Lexikon einer hermetischen Wissenschaft, 412 Seiten, Verlag C.H.Beck, (1998) ISBN 3-406-44106-8, S. 146.
- ↑ Ram B. Gupta: Gasoline, Diesel and Ethanol Biofuels from Grasses and Plants, 246 Seiten, Verlag Cambridge University Press, (2010), ISBN 0-521-76399-1, S. 74.
- ↑ Etikettenschwindel - Alkoholfreies Bier enthält doch Alkohol. welt.de, 28. März 2012, abgerufen am 15. Juli 2012.
- ↑ Lebensmittelbuch.Kommission: Leitsätze für Fruchtsäfte. Bundesministerium für Ernährung, Landwirtschaft und Verbraucherschutz, 27. November 2002, abgerufen am 15. Juli 2012.
- ↑ Anhang I Nr. 8 der Verordnung (EG) Nr. 1439/1999.
- ↑ Peter Bützer: „Alkohol“ Ethanol. Oktober 2011, abgerufen am 15. Juli 2012.
- ↑ D. T. Halfen, A. J. Apponi, N. Woolf, R. Polt, and L. M. Ziurys: A Systematic Study of Glycolaldehyde in Sagittarius B2(N) at 2 and 3 mm: Criteria for Detecting Large Interstellar Molecules, in: The Astrophysical Journal, 639, 2006 March 1, S. 237–245; doi:10.1086/499225.
- ↑ 24,0 24,1 H. G. Hirschberg: Handbuch Verfahrenstechnik und Anlagenbau. Chemie, Technik und Betriebswirtschaft, Verlag Springer, Berlin (1999), ISBN 3-540-60623-8.
- ↑ 25,0 25,1 25,2 25,3 W. Keim, A. Behr, G. Schmitt: Grundlagen der industriellen Chemie, Salle-Sauerländer Verlag, 1986, ISBN 3-7935-5490-2.
- ↑ E. Breitmaier, G. Jung: Organische Chemie. Grundlagen, Stoffklassen, Reaktionen, Konzepte, Molekülstruktur, Verlag Thieme, Stuttgart 2005, ISBN 3-13-541505-8.
- ↑ C. Bauer-Christoph, N. Christoph, M. Rupp: Spirituosenanalytik, Verlag Behr (2009) ISBN 3-89947-440-6.
- ↑ A. Rapp, A. Markowetz: NMR-Spektroskopie in der Weinanalytik., In: Chemie in unserer Zeit, 27. Jahrg. 1993, Nr. 3, S. 149, doi:10.1002/ciuz.19930270307.
- ↑ C. Ford Runge, Benjamin Senauer: How Biofuels Could Starve the Poor, Council on Foreign Affairs, Mai/Juni 2007.
- ↑ Evelyn Boos, Thomas Priermeier: Gewinnchance Klimawandel: Investitionsmöglichkeiten und Anlagestrategien. Linde Verlag, Wien 2008, ISBN 978-3-7093-0216-3, S. 81.
- ↑ Branntweinsteuerverordnung
- ↑ Verordnung des Bundesministers für Finanzen vom über die Vergällung von Alkohol (VO-Vergällung)
- ↑ 33,0 33,1 Karl-Ludwig Haken: Grundlagen der Kraftfahrzeugtechnik. Hanser Verlag, 2007, ISBN 978-3-446-22812-2, S. 23.
- ↑ 34,0 34,1 Per-Gunnar Jönsson: Hydrogen Bond Studies. CXIII The Crystall Structure of Ethanol at 87 K, in: Acta Cryst., 1976, B32, S. 232–235; doi:10.1107/S0567740876002653.
- ↑ E. W. Flick: Industrial Solvents Handbook. Fifth Edition, Noyes Data Corporation (ndc), Westwood, NJ/USA 1998, ISBN 0-8155-1413-1, S. 252.
- ↑ W. C. Coburn Jr., E. Grunwald: Infrared Measurements of the Association of Ethanol in Carbon Tetrachloride; J. Am. Chem. Soc., 1958, 80, S. 1318–1322; doi:10.1021/ja01539a010.
- ↑ George Brink, Leslie Glasser: Studies in hydrogen bonding: the enthalpy of hydrogen bond formation of ethanol in carbon tetrachloride solutions. In: Journal of Molecular Structure. 145, 1986, S. 219–224, doi:10.1016/0022-2860(86)85026-8.
- ↑ W. J. Moore, D. O. Hummel: Physikalische Chemie, Verlag Walter de Gruyter, Berlin, New York, 1983, ISBN 978-3-11-008554-9.
- ↑ Manfred Hesse, Herbert Meier, Bernd Zeeh: Spektroskopische Methoden in der organischen Chemie, 456 Seiten, Verlag Thieme, Stuttgart (2005), ISBN 3-13-576107-X.
- ↑ Eintrag zu Diethylsulfat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 22. Juli 2008 (JavaScript erforderlich).
- ↑ WWU Münster: Unterrichtsreihe zum Thema Eiweiß
- ↑ Standardanweisung Hygienische Händedesinfektion der Universität Greifswald
- ↑ WIGL Lehrmittel: Südweine (doc)
- ↑ A. Berendt: Sherry. Der Guide für Kenner und Genießer. Heyne, München 1997, ISBN 3-453-12894-X.
- ↑ Nagl-Netzreport: Haltbarmachung von Lebensmitteln.
- ↑ Hartspiritus, Eintrag bei wissenschaft-online
- ↑ 47,0 47,1 H.-H. Frey, F. R. Althaus: Lehrbuch der Pharmakologie und Toxikologie für die Veterinärmedizin, Georg Thieme Verlag, 2007, ISBN 978-3-8304-1070-6, S. 469.
- ↑ Herbert Hof, Rüdiger Dörries: Medizinische Mikrobiologie, 3. Aufl., Georg Thieme Verlag, Stuttgart 2005, S. 686.
- ↑ Percutane Alkohol Injektion (PEI) der Schilddrüse bei www.madeasy.de.
- ↑ Lothar-Andreas Hotze, Petra-Maria Schumm-Draeger: Schilddrüsenkrankheiten. Diagnose und Therapie. Berlin 2003, ISBN 3-88040-002-4.
- ↑ Alkohol-Dehydrogenase.
- ↑ 52,0 52,1 Daten von e.pure.org
- ↑ Braskem Ethanol-to-Ethylene Plant, Brazil
- ↑ H. Lüllmann, L. Hein, K. Mohr, M. Wehling: Pharmakologie und Toxikologie. 16. Auflage, Georg Thieme Verlag, 2006, ISBN 978-3-13-368516-0, S. 521.
- ↑ K. Roth: Die Chemie des Katers: Alkohol und seine Folgen. in: Chemie in Unserer Zeit, 2007, 41, S. 46; doi:10.1002/ciuz.200700409.
- ↑ W. Gerok, C. Huber, T. Meinertz, H. Zeidler, Henning (Hrsg.): Die innere Medizin: Referenzwerk für den Facharzt. 11. Auflage, Schattauer Verlag, 2006, ISBN 978-3-7945-2222-4, S. 644–646.
- ↑ 57,0 57,1 57,2 Hans-Konrad Biesalski, Olaf Adam: Ernährungsmedizin: Nach dem Curriculum Ernährungsmedizin der Bundesärztekammer. 3. Auflage, Georg Thieme Verlag, 2004, ISBN 978-3-13-100293-8, S. 520–528.
- ↑ 58,0 58,1 P. Schauder, G. Ollenschläger: Ernährungsmedizin: Prävention und Therapie. Elsevier Deutschland, 2006, ISBN 978-3-437-22921-3.
- ↑ Heinrich Kasper: Ernährungsmedizin und Diätetik. 10. Auflage, Elsevier, Urban & Fischer Verlag, 2004, ISBN 978-3-437-42011-5, S. 70.
- ↑ Eduard Burgis: Intensivkurs allgemeine und spezielle Pharmakologie. 4. Auflage, Elsevier, Urban & Fischer Verlag, 2008, ISBN 978-3-437-42613-1, S. 520.
- ↑ Ekkehard Grundmann (Hrsg.): Spezielle Pathologie. Lehrbuch. bgr.v. Franz Büchner, 7., neu bearb. Aufl., München/Wien/Baltmimore 1986, ISBN 3-541-00467-3, S. 258.
- ↑ Ekkehard Grundmann (Hrsg.): Spezielle Pathologie. Lehrbuch. bgr.v. Franz Büchner, 7., neu bearb. Aufl., München/Wien/Baltmimore 1986, ISBN 3-541-00467-3, S. 75.
- ↑ Karl-Heinz Niessen (Hrsg.): Pädiatrie. 3., neubearbeitete Aufl., Weinheim/Basel/Cambridge/New York 1993, ISBN 3-527-15517-1, S. 64.
- ↑ Wolfgang Forth e.a. (Hrsg.): Allgemeine und spezielle Pharmakologie und Toxikologie. Für Studenten der Medizin, Veterinärmedizin, Pharmazie, Chemie, Biologie sowie für Ärzte, Tierärzte und Apotheker. 6., völlig neu bearb. Aufl., Mannheim/Leipzig/Wien/Zürich 1992, ISBN 3-411-15026-2, S. 798.
- ↑ Mann mit knapp 7,7 Promille aufgefunden Tagesspiegel.de, abgerufen am 13. November 2008.
| Bitte den Hinweis zu Gesundheitsthemen beachten! |