33. Das Lösen von Salzen
Wassermoleküle und Ionen - Wechselwirkung
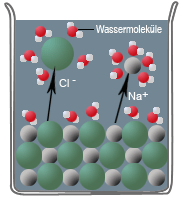
Wenn Salzkristalle mit Wasser in Berührung kommen, dann lagern sich an deren Oberflächen und Kanten die Wassermoleküle als Dipole an. Dabei richten sich die positiv geladenen Ionen des Salzes am negativen Pol des Wassermoleküls aus - und umgekehrt - die negativ geladenen Ionen am positiven Pol des Wassermoleküls.
Diese Wechselwirkung nennt man Ion-Dipol-Wechselwirkung, bei der die Ionen am Rande des Ionengitters von Wassermolekülen aus dem Ionengitter herausgelöst und von ihnen umhüllt werden (Hydrathülle). Nun können die Ionen in das Wasser diffundieren. Diesen Vorgang bezeichnet man als Hydratation, bei dem Energie frei wird, die Hydrationsenergie. Sie dient als Maß für die Neigung der Ionen, sich mit Wassermolekülen zu verbinden
Unter Ausbildung von Wasserstoffbrücken zu der ersten Hydrathülle können sich weitere Wassermoleküle anlagern und so eine weitere Hydrathülle bilden. In der Hydrathülle verringert sich die gegenseitige Anziehung der Ionen sehr stark, außerdem ziehen sich im Wasser zwei entgegengesetzt geladene Ionen nur mit $ \tfrac {1} {80} $ der Kraft an, die sie in Luft zusammenhalten würde. Als Folge der Hydratisierung und der Verringerung der Ionenanziehung beginnt der Salzkristall, sich aufzulösen.
| Na+ | 398,88 |
| Li+ | 508,24 |
| K+ | 314,25 |
| Ag3+ | 468,86 |
| Ca2+ | 1579,63 |
| Mg2+ | 1910,64 |
| Al3+ | 4609,00 |
| Fe+ | 4491,68 |
| Cl– | 376,26 |
| F– | 511,18 |
| Br– | 342,32 |
| I– | 298,47 |
Energiebilanz beim Lösungsvorgang
Löst man einen Ionenkristall in Wasser, so findet ein Energieumsatz statt, der durch zwei Merkmale gekennzeichnet ist: es wird Energie verbraucht, um die Gitterenergie zu überwinden, andererseits wird bei der Hydratation der Ionen Energie gewonnen.
Ist die Hydrationsenergie gleich groß oder größer als seine Gitterenergie, bezeichnet man ein Salz als gut löslich. Bei Salzen, bei denen die Hydrationsenergie deutlich größer als die Gitterenergie ist, tritt beim Lösen eine Erwärmung des Salz-Wasser-Gemischs ein (Lösungswärme).
Beim Lösen von Calciumchlorid-Hexahydrat kühlt hingegen die Lösung ab. Diese Abkühlung beruht darauf, dass die zum Auflösen des Salzes benötigte Gitterenergie nicht völlig von der Hydrationsenergie gedeckt wird und dass die noch nötige Energie aus der Wärmeenergie des Wassers entnommen wird. Ist die Gitterenergie wesentlich größer als die Hydrationsenergie, läuft der Lösungsvorgang nicht ab: der betreffende Stoff ist in Wasser unlöslich.
$ \mathrm {Hydratisierungsenergie > Gitterenergie = Erwärmung} $
$ \mathrm {Hydratisierungsenergie < Gitterenergie = Abkühlung\ { \color {brown} {bzw.}} \ Unlösichkeit}$
Der Lösungsvorgang von Salzen in Wasser - Formulierung
Nach der Auflösung eines Salzkristalls befinden sich dessen Ionen nun in der Salzlösung. Dort sind sie jedoch - im Gegensatz zum festen Zustand - von Wassermolekülen umhüllt, was man vereinfacht mit folgender Formel darstellen kann:
$ \mathrm { NaCl \; \xrightarrow{H_{2}O} \; Na_{(aq)}^{+} \; + \; Cl_{(aq)}^{-} } $
Die Formel H2O über dem Reaktionspfeil deutet an, dass das Salz in Wasser (aqua) gelöst wird. Durch ein "aq" am Ion markiert man, dass das Ion hydratisiert vorliegt, also von einer unbestimmten Zahl von H2O - Molekülen umhüllt ist.
$ \mathrm { KBr \quad \xrightarrow{H_{2}O} \quad K_{(aq)}^{+} \; + \; Br_{(aq)}^{-} } $
Kaliumbromid $\longrightarrow$ Kalium-Ion + Bromid-Ion
Die Summe der positiven und negativen Ladungen muss links und rechts des Reaktionspfeils gleich sein, wie folgendes Beispiel zeigt:
$ \mathrm { MgCl_{2} \quad \xrightarrow{H_{2}O} \quad Mg_{(aq)}^{2+} \; + \; 2 \ Cl_{(aq)}^{-} } $
Magnesiumchlorid $\longrightarrow$ Magnesium-Ion + Chlorid-Ion
- $ \mathrm { CuCl_{2} } $
- $ \mathrm { FeBr_{3} } $
- $ \mathrm { ZnI_{2} } $
- $ \mathrm { Na_{2}S } $
- $ \mathrm { KF } $
- $ \mathrm { LiCl } $
- $ \mathrm { NiCl_{2} } $