46. Die Neutralisation
Die Beobachtung der Neutralisation
Unter einer Neutralisation versteht man in der Chemie die Aufhebung der (unter anderem) ätzenden Wirkung von Säuren oder Basen. Versetzt man Salzsäure mit Natronlauge, so tritt nach einer gewissen Zeit ein Punkt ein, an dem die Säurewirkung durch die zugesetzte Lauge aufgehoben wird. Die Grundlage der Neutralisation beruht also auf der Tatsache, dass sich die Wirkungen einer Säure und einer Base beim Vermischen nicht addieren, sondern aufheben.
So kann eine Säure mit einer geeigneten Menge einer Base und eine Base mit einer geeigneten Menge einer Säure neutralisiert werden. Die Änderung der Farbe des Indikators zeigt dies an.
Der Versuch 2 zeigt, dass die Neutralisation ein exothermer Vorgang ist. Die entstehende Wärme bei dieser Reaktion nennt man Neutralisationswärme.
Säure + Lauge → Salz + Wasser
Die Erklärung der Neutralisation
Gibt man Säuren und Laugen zusammen, so treffen hydratisierte Protonen und Hydroxidionen aufeinander. Vereinfacht kann dieser Vorgang so gedeutet werden: Positiv geladene Protonen und negativ geladene Hydroxidionen ziehen sich aufgrund ihrer entgegengesetzten Ladung an und vereinigen sich zu neutralen Wassermolekülen. Das Hydroxidion betätigt sich hier als Base: Es nimmt ein Proton auf.

$ \mathrm { H^{+}_{(aq)} \qquad + \qquad OH^{-}_{(aq)} \quad \longrightarrow \quad H_{2}O \quad + \ 57,3 \ kJ } $
Der Vorgang der Wasserbildung aus hydratisierten Protonen und Hydroxidionen ist der wesentliche chemische Vorgang bei der Neutralisation. Da er exotherm verläuft, verstehen wir auch das Auftreten der Neutralisationswärme.
Bei der Neutralisation wird die Ursache für die saure bzw. alkalische Reaktion (H+(aq) und OH–(aq)), die Indikatoren anzeigen, aufgehoben. In der neutralisierten Lösung befinden sich in unserem Versuch neben dem Wasser und dem Indikator noch Natriumionen und Chloridionen. Diese bilden beim Eindampfen festes Natriumchlorid. Die Neutralisation von Salzsäure und Natronlauge kann jetzt vollständig formuliert werden:
$ \mathrm { \underbrace { Na^{+}_{(aq)} + OH^{-}_{(aq)} }_{Natronlauge} + \underbrace {H^{+}_{(aq)} + Cl^{-}_{(aq)} }_{Salzsäure} \longrightarrow H_{2}O + \underbrace { Na^{+}_{(aq)} + Cl^{-}_{(aq)} }_{gelöstes \ Natriumchlorid}} $ + 57,3 kJ
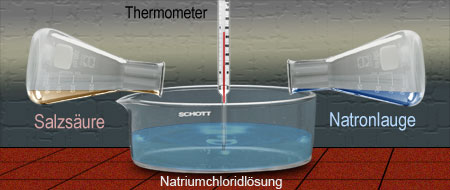

sauer $\mathrm + $ alkalisch $ \longrightarrow $ neutral
Neutralisation von Salzsäure mit Natronlauge.
Als Indikator dient Lackmus.
Leitfähigkeitsänderung bei der Neutralisation
Bei der Neutralisation tritt eine Änderung der elektrischen Leitfähigkeit ein, weil die für den Ladungstransport mitverantwortlichen H+(aq) und OH–(aq) verschwinden. Ist das gebildete Salz dazu noch schwer oder praktisch nicht in Wasser löslich, fällt die Leitfähigkeit, wie in unserem Versuch 3, stark ab. Die Neutralisation der Schwefelsäure wird im nächsten Kapitel behandelt.

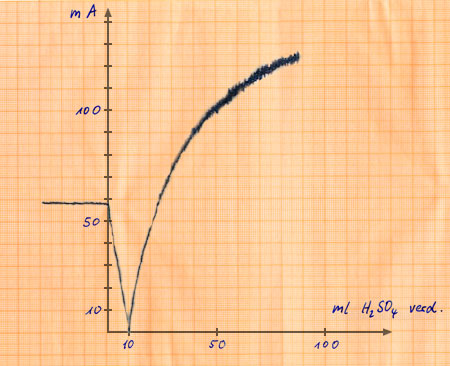
Änderung der Leitfähigkeit bei einer Neutralisation von Ba(OH)2 - Lösung mit Schwefelsäure.
Meßkurve.