51. Haber-Bosch-Verfahren
Das Haber-Bosch-Verfahren hat die Welt verändert
Seit mehr als 100 Jahren ist man in der Lage, Stickstoff in Dünger zu verwandeln. Seit der Engländer Thomas Robert Malthus im Jahr 1798 behauptete, dass die Produktion von Lebensmitteln nicht mit dem Bevölkerungswachstum Schritt halten könne, haben es sich Forscher wie Justus von Liebig zur Aufgabe gemacht, die Ernteerträge der Bauern durch künstliche Düngung zu steigern. Bereits eingesetzt wurden Kalisalze und Phosphor, den man aus dem Thomasmehl der Stahlwerke gewann. Die Düngung mit Stickstoff blieb jedoch weiterhin ein Problem. Obwohl die Erdatmosphäre mehr als ausreichend Stickstoff enthält, können Pflanzen ihn in dieser Form nicht verwerten.
Die einzige Quelle für Stickstoffdünger waren vor 100 Jahren die Salpetervorkommen (Chilesalpeter) in der Atacama-Wüste. Doch schon damals erkannte man, dass die Vorräte begrenzt sind und so orakelte der Chemiker William Crookes, dass sie bis zum Jahr 1930 erschöpft sein würden. Aufgrund seines hohen Stickstoffgehaltes von 46,62 % ist heute Harnstoff weltweit das bedeutendste Stickstoffdüngemittel. Harnstoff kann in großen Mengen durch die Reaktion von Ammoniak und Kohlenstoffdioxid gewonnen werden.
Die theoretischen Grundlagen der Ammoniaksynthese
Die einfachste Stickstoff-Wasserstoff-Verbindung ist das Gas Ammoniak, NH3. Seine Bildung aus den Elementen erfolgt in einer Gleichgewichtsreaktion:
$ \mathrm { N_{2} + 3 \ H_{2} \ \rightleftharpoons \ 2 \ NH_{3} \; + \; 46 \ kJ } $
Durch Veränderung der äußeren Bedingungen (z. B. Druck, Temperatur) kann die Stoffmengenkonzentration der Reaktionspartner einer Seite jedoch vergrößert oder verringert werden. Bild 1 zeigt so eine, wie man in der Chemie sagt, "Verschiebung des Gleichgewichts".
Die Tatsache, dass mit steigender Temperatur die Ausbeute an Ammoniak geringer wird, ist damit zu erklären, dass die Bildung von Ammoniak aus den Elementen ein exothermer, die Spaltung dagegen ein endothermer, also ein wärmeverbrauchender Vorgang ist. So wird bei großer Hitze der Bildung von Ammoniak entgegengewirkt, da die Spaltung während der Gleichgewichtreaktion begünstigt wird. Das Gleichgewicht wird nach links verschoben und die Konzentration von Ammoniak verringert sich.
Die Bildung von Ammoniak-Molekülen ist auch stark davon abhängig, welcher Druck während der Gleichgewichtsreaktion herrscht. Um zu verstehen, warum dies so ist, muß man sich aus dem Physikunterricht in Erinnerung rufen, dass das Mol eines jeden Gases bei einer Temperatur von 0°C und einem Druck von 1,013 bar ein Volumen von 22,4 Liter einnimmt. Für die Volumenverhältnisse bei der Synthese von Ammoniak gilt also folgendes:
1 Mol Stickstoff $+$ 3 Mol Wasserstoff $\rightleftharpoons$ 2 Mol Ammoniak
22,4 l Stickstoff $+$ 3 $\cdot$ 22,4 l Wasserstoff $\rightleftharpoons$ 2 $\cdot$ 22,4 l Ammoniak
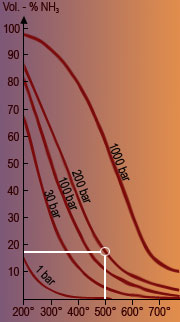
Aus 89,6 Liter Ausgangsprodukten entstehen also 44,8 Liter Endprodukte. Dies bedeutet, dass die Reaktion unter Volumenverminderung abläuft. Hoher Druck verschiebt das Gleichgewicht nach rechts und begünstigt die Bildung von Ammoniak.
Der französische Chemiker Henry Le Chatelier (1850-1936) hat die Gleichgewichtsverschiebung in seinem "Prinzip vom kleinsten Zwang" so formuliert:
Übt man auf ein System, das sich im chemischen Gleichgewicht befindet, einen Zwang durch Änderung der äußeren Bedingungen aus, so stellt sich infolge dieser Störung des Gleichgewichts ein neues Gleichgewicht, dem Zwang ausweichend, ein.
Veranschaulichung des Prinzips vom kleinsten Zwang
Als Beispiel kann das Gasgemisch aus dem Gleichgewicht zwischen dem braunen Stickstoffdioxid und dem farblosen Distickstofftetroxid dienen (Versuch 4):
$ \rm 2 \ NO_2 \ \rightleftharpoons \ N_2O_4 $
Der Wärmeinhalt (Enthalpie) der Hinreaktion beträgt $ \Delta \overrightarrow H = -58 \rm\tfrac{kJ}{mol} $, d. h. es handelt sich um eine exotherme Reaktion, da Energie frei wird. Die Rückreaktion ist endotherm: $ \Delta \overleftarrow H = +58 \rm\tfrac{kJ}{mol} $.
begünstigt NH3 - Zerfall.
Druckerhöhung:
begünstigt NH3 - Bildung
Großtechnisches Verfahren zur NH3 - Synthese
Erhöht man nun die Temperatur bei konstantem Volumen, so wird die Reaktion in die entgegengesetzte, also in die endotherme Richtung ablaufen, womit sich das Gleichgewicht nach links verschiebt, das Gasgemisch wird dunkler (NO2 -Bildung). Temperatursenkung bewirkt die exotherme Reaktion, wodurch sich das Gleichgewicht nach rechts verschiebt und das Gasgemisch sich aufhellt (N2O4 -Bildung). Da aus 1 Vol. N2O4 2 Vol. NO2 entstehen, kann dieses Gleichgewicht auch durch Druckänderung verschoben werden. Druckerhöhung führt nach dem Prinzip vom kleinsten Zwang zu einer Gleichgewichtsverschiebung nach rechts und Druckverminderung nach links (Versuch Versuch 5 ).
Wegen des gestiegenen Bedarfs begannen Wissenschaftler ab etwa 1900 mit der Erforschung der direkten Reaktion von Stickstoff und Wasserstoff zu Ammoniak. Man erkannte bald, dass diese Reaktion bei Normalbedingungen kaum stattfindet und dass dafür hohe Temperaturen, ein hoher Druck sowie ein geeigneter Katalysator nötig sind.
Die technische Durchführung der Ammoniaksynthese
1909 gelang es dem deutschen Chemiker Fritz Haber (1868-1934) erstmals Ammoniak im Labormaßstab herzustellen. Daraufhin versuchte er mit Hilfe von Carl Bosch dieses Verfahren auch im industriellen Maßstab anzuwenden, was schließlich 1910 im Versuchsbetrieb auch gelang. Bereits 1913 wurde bei der BASF in Ludwigshafen die erste kommerzielle Fabrik zur Ammoniaksynthese in Betrieb genommen. Dabei kam ein inzwischen von Alwin Mittasch entwickelter, neuartiger Katalysator zum Einsatz. Die erste Großsynthese von Ammoniak wurde mit zunächst 30 t pro Tag gestartet.

Bis in die 19-siebziger Jahre waren die Produktionskapazitäten auf Westeuropa, USA und die ehemalige UdSSR konzentriert. Heute werden neue Anlagen zur Ammoniaksynthese vorzugsweise in Regionen mit hohem Eigenbedarf oder großen, anders kaum nutzbaren Erdgasvorkommen gebaut. So verbraucht z. B. China inzwischen zirka 22 Millionen Tonnen Stickstoff, das entspricht 28 Prozent der Weltproduktion. Der Anteil Europas ist gleichzeitig auf 16 Prozent abgesunken.
Der größte Teil des jährlich produzierten Ammoniaks wird mit 100 Millionen Tonnen über das Haber-Bosch-Verfahren hergestellt. Aufgrund des hohen Energiebedarfs bei der Herstellung des benötigten reinen Wasserstoffs entfallen etwa 1,4 % des Weltenergieverbrauchs auf das Haber-Bosch-Verfahren. Die BASF betreibt selbst vier Ammoniakanlagen mit einer Gesamtkapazität von 1,5 Millionen Tonnen, welche überwiegend zur Düngemittelerzeugung eingesetzt werden.
Die Chemie hinter dem Haber-Bosch-Verfahren
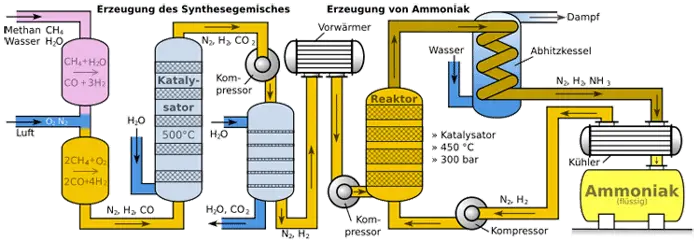
Vor der eigentlichen Synthese-Reaktion müssen zunächst die Ausgangsstoffe gewonnen werden. Während Stickstoff als Luftbestandteil in großen Mengen zu Verfügung steht und durch Luftverflüssigung gewonnen wird, muss Wasserstoff zunächst aus geeigneten Quellen hergestellt werden. Dabei bietet sich vor allem das Methan im Erdgas an, das mit Wasserdampf bei 800°C zu CO und H2 umgesetzt wird:
$ \mathrm { 205 \ kJ + CH_{4} + H_{2}O \quad \rightleftharpoons \quad 3 \ H_{2} + CO } $
Da die obige Reaktion das Methangas nur unvollkommen umsetzt, lässt man in einem zweiten Schritt das restliche Methangas mit dem Sauerstoff der Luft zu Kohlenstoffmonoxid und Wasserstoff reagieren:
$ \mathrm { 2 \ CH_{4} + O_{2} + 4 \ N_{2} \quad \rightleftharpoons \quad 2 \ CO + 4 \ H_{2} + 4 \ N_{2} } $
Der für die spätere Ammoniaksynthese erforderliche Stickstoff kommt also automatisch in das Gasgemisch. In einem letzten Schritt muss das Kohlenstoffmonoxid zu Kohlenstoffdioxid oxidiert werden, da es mit Ammoniak Feststoffe bilden würde, die in kürzester Zeit die Reaktoren ruinieren würden:
$ \mathrm { CO + H_{2}O \quad \rightarrow \quad CO_{2} + \ H_{2} } $
Nach Abtrennung des Kohlenstoffdioxides durch einen Gaswäscher wird der Wasserstoff im richtigen Verhältnis mit Stickstoff gemischt und bei Hochdruck und etwa 450 °C katalytisch zu Ammoniakgas umgesetzt:
$ \mathrm { N_{2} + 3 \ H_{2} \quad \rightleftharpoons \quad 2 \ NH_{3} \; + \; 46 \ kJ } $
Die Ammoniaksynthese bietet also die enorm wichtige Möglichkeit, den Stickstoff der Luft in eine chemische Verbindung einzubauen. Auf dieser Grundlage können andere Synthesen durchgeführt werden, z. B. das Ostwaldverfahren zur Gewinnung von Salpetersäure, von Mineraldüngern, von Kunst- und Farbstoffen.

Carl Bosch entwickelte dann die industriellen Großanlagen, mit denen ab 1913 die wirtschaftliche Abhängigkeit vom Chilesalpeter gelöst werden konnte.
Die heutigen Ammoniakreaktoren leisten bis zu 1000 t täglich.
