59. Das Leichtmetall Aluminium
Aluminium - ein besonderes Metall mit kurzer Vergangenheit
Aluminium ist ein silbrig-weißes Leichtmetall. Es ist das dritthäufigste Element und häufigste Metall in der Erdkruste. Obwohl das Metall sehr unedel ist, ist es durch Passivierung geschützt, so dass es bei Raumtemperatur nicht mit Luft oder Wasser reagiert. Aluminium ist im Vergleich zu anderen Metallen noch nicht lange bekannt. Seine Herstellung gelang 1825 erstmalig dem Chemiker und Physiker Hans Christian Ørsted durch Reaktion von Aluminiumchlorid (AlCl3) mit Kaliumamalgam, wobei Kalium als Reduktionsmittel diente:
$ \mathrm{4\ AlCl_3 + 3\ K \rightarrow Al + 3\ KAlCl_4}$
Friedrich Wöhler verwendete 1827 die gleiche Methode, bediente sich zur Reduktion jedoch metallischen Kaliums und erhielt damit reineres Aluminium. Zu jener Zeit kostete Aluminium mehr als Gold. Der Preis für Aluminium ist seit den Tagen seiner Entdeckung stark gefallen. Der Aufwand zur Herstellung ist jedoch nach wie vor enorm hoch. Will man eine Tonne Aluminium produzieren, benötigt man 15.000 Kilowattstunden (kWh) Strom sowie 600 kg Kohle (Elektrodenmaterial) und 4.000 kg Bauxit (Aluminiumoxid, Al2O3).
Eigenschaften
Aluminium ist ein relativ weiches und zähes Metall. Es ist dehnbar und kann durch Auswalzen zu dünnen Folien verarbeitet werden. Aluminiumfolien können bis 0,004 mm Dicke ausgewalzt werden. Legierungen mit einem Anteil bis zu 3 % Magnesium oder Silicium lassen sich gut gießen (Aluminium-Druckguss). Der Schmelzpunkt liegt bei 660,4 °C und der Siedepunkt bei 2470 °C. Die Dichte von 2,7 g/cm3 zeigt deutlich, dass Aluminium ein Leichtmetall ist.
Elektrische Eigenschaften
Aluminium ist ein guter elektrischer Leiter: Zwar leitet Aluminium den Strom je Gramm Masse besser als Kupfer, ist aber voluminöser als dieses, so dass Kupfer je Quadratzentimeter Leitungsquerschnitt Strom besser leitet als Aluminium. Weil Kupfer reaktionsträger und die Verarbeitung weniger problematisch als bei Aluminium ist, wird meistens Kupfer verwendet und Aluminium nur, wenn es auf das Gewicht ankommt. Aluminium wird insbesondere dann als Leitermaterial für elektrischen Strom im Stromnetz verwendet, wenn es sich um starre und dicke Leitungen handelt (Stromschienen, Erdkabel). Hier bietet es Kostenvorteile gegenüber Kupfer.
Chemische Eigenschaften
Als unedles Metall reagiert Aluminium mit Salzsäure sehr heftig unter Wasserstoffentwicklung, von Schwefelsäure wird es langsam aufgelöst. In Salpetersäure wird es passiviert.
$ \mathrm { 2 \ Al + \underbrace {6 \ H^{+}_{(aq)} + 6 \ Cl^{-}_{(aq)}}_{Salzsäure} \longrightarrow 2 \underbrace {Al^{3+}_{(aq)} + 6 \ Cl^{-}_{(aq)}}_{Aluminiumchlorid} + 3 \ H_{2} \uparrow } $
Aluminiumpulver brennt blitzartig mit einer Stichflamme ab (Versuch 1, Kapitel 14), während sich ein Stück Aluminiumblech als feuerfest erweist. Dieser Unterschied beruht neben der größeren Oberfläche des Pulvers auch an einer sich sehr schnell an der Luft bildenden dünnen Oxidschicht des reinen Leichtmetalls Aluminium. Auch das stumpfe, silbergraue Aussehen geht auf diese passivierende, etwa 0,05 µm dicke Oxidschicht zurück. Außerdem macht sie reines Aluminium bei pH-Werten von 4 bis 9 sehr korrosionsbeständig.
Die Oxidschicht schützt auch vor weiterer Oxidation, ist aber bei der elektrischen Kontaktierung und beim Schweißen hinderlich. Sie kann durch elektrische Oxidation (Eloxieren) oder auf chemischem Weg verstärkt werden. Elektrisch oxidiertes Aluminium nennt man Eloxal. Mit konz. Salpetersäure wird die Oberfläche von Aluminium oxidiert, so dass das Metall von weiterer Säure nicht mehr angegriffen werden kann (Versuch 2). Auch diese Erscheinung beruht auf einer Passivierung.
Die Wasserstoffentwicklung bei der Reaktion des Metalls mit Natronlauge ist auf eine primäre Reaktion des Aluminiums mit Wasser (vgl. Natrium, Kapitel 40) zurückzuführen.
1. Schritt: Reaktion mit Wasser:
$ \mathrm{ 2 \ Al + 6 \ H_2O \ \longrightarrow \ 2 \ Al(OH)_3 + 3 \ H_2 }$
Hier schließt sich im Normalfall die Trocknung der Oberfläche an, die eine Umwandlung des Hydroxids zum Oxid zur Folge hat:
$ \mathrm{ 2 \ Al(OH)_3 \ \longrightarrow \ Al_2O_3 + 3 \ H_2O }$
Dies passiert jedoch nicht bei der Reaktion von Aluminium in wässriger Natronlauge.
2. Schritt: Komplexierung des Hydroxids zu Natriumaluminat. Das Alumination ist ein sog. Komplexion. Elemente, die mit Säuren und Laugen Salze bilden, nennt man amphotere Elemente. Viele Gebrauchsmetalle gehören dazu.
$ \mathrm{ Al(OH)_3 + Na^+ + OH^- \ \longrightarrow \ Na^+ + Al(OH)_4^- }$
Durch den zweiten Schritt wird das gallertartige Hydroxid wasserlöslich und kann von der Metalloberfläche abtransportiert werden. Dadurch ist die Aluminiumoberfläche nicht mehr vor dem weiteren Angriff des Wassers geschützt und Schritt 1 läuft wieder ab.
Mit dieser Methode lassen sich – ebenso wie bei der Reaktion von Aluminium mit Säuren – pro zwei Mol Aluminium drei Mol Wasserstoffgas herstellen.
$ \mathrm{ 2 \ Al + 6 \ HCl \ \longrightarrow \ 2 \ AlCl_3 + 3 \ H_2 }$
Mit Brom reagiert Aluminium bei Zimmertemperatur unter Flammenerscheinung. Hierbei ist zu beachten, dass das entstehende Aluminiumbromid mit Wasser unter Bildung von Aluminiumhydroxid und Bromwasserstoffsäure reagiert.
$ \mathrm{AlBr_3 + 3\ H_2O \longrightarrow Al(OH)_3 + 3\ HBr}$
Mit Quecksilber bildet Aluminium ein Amalgam. Wenn Quecksilber direkt mit Aluminium in Berührung kommt (d. h. wenn die Aluminiumoxidschicht an dieser Stelle mechanisch zerstört wird), frisst das Quecksilber Löcher in das Aluminium.
Vorkommen
Aluminium ist mit einem Anteil von 7,57 Gewichtsprozent nach Sauerstoff und Silicium das dritthäufigste Element der Erdkruste und damit das häufigste Metall. Allerdings kommt es aufgrund seines unedlen Charakters praktisch ausschließlich in gebundener Form vor. Die größte Menge befindet sich chemisch gebunden in Form von Alumosilicaten, zum Beispiel als Bestandteil von Ton, Gneis und Granit.
Seltener wird Aluminiumoxid in Form des Minerals Korund und seiner Varietäten Rubin (rot) und Saphir (blau) gefunden. Die Farben dieser Kristalle beruhen auf Beimengungen anderer Metalloxide. Korund hat mit fast 53 % den höchsten Aluminiumanteil in einer Verbindung.
Das einzige wirtschaftlich wichtige Ausgangsmaterial für die Herstellung von Aluminium ist Bauxit, AlO(OH). Bauxitvorkommen befinden sich in Südfrankreich (Les Baux), Guinea, Bosnien und Herzegowina, Ungarn, Russland, Indien, Jamaika, Australien, Brasilien und den Vereinigten Staaten.
Trotz seines unedlen Charakters kann Aluminium in der Natur auch elementar, also gediegen, vorkommen. In seltenen Fällen kann Aluminium tafelige Kristalle bis etwa einen Zentimeter Größe entwickeln. Aufgrund der extremen Seltenheit hat gediegenes Aluminium keine Bedeutung als Rohstoffquelle.

Gewinnung von Aluminium
Aluminiumrecycling (Sekundär-Aluminium)
Bei der Herstellung unterscheidet man Primäraluminium, das aus Bauxit gewonnen wird, und Sekundäraluminium aus Aluminiumschrott. Die Wiederverwertung benötigt dabei nur etwa 5 % Energie der Primärgewinnung. Bei Aluminium ist die Recycling-Effizienz deswegen sehr gut, da es wesentlich energieaufwändiger ist, Primär-Aluminium durch Aufschluss von Bauxit (Aluminiumerz) und dessen Umwandlung zu Tonerde /Aluminiumoxid mit anschließender Schmelzflusselektrolyse zu gewinnen, als Altaluminium einzuschmelzen (Schmelzpunkt >660 °C). Für die Aluminiumgewinnung aus Bauxit wird in bedeutendem Ausmaß elektrische Energie benötigt, beim Recycling können Primärenergieträger, z.B. Erdgas verwendet werden. In Deutschland wurden im Jahr 2006 rund 1,3 Millionen Tonnen Aluminium verarbeitet, davon 0,8 Millionen Tonnen als Formguss, der wiederum zu 80 % aus dem Recycling kam.
Primär-Aluminium
Eine wirtschaftliche großtechnische Gewinnung von metallischem Primäraluminium ist nur aus Bauxit möglich. Das in diesem Erz enthaltene Aluminiumoxid/-hydroxid-Gemisch wird zunächst mit Natronlauge aufgeschlossen (Bayer-Verfahren), um es von Fremdbestandteilen wie Eisen- und Siliciumoxid zu befreien. Dann wird es meist in Wirbelschichtanlagen (aber auch in Drehrohröfen) zu Aluminiumoxid(Al2O3) gebrannt.
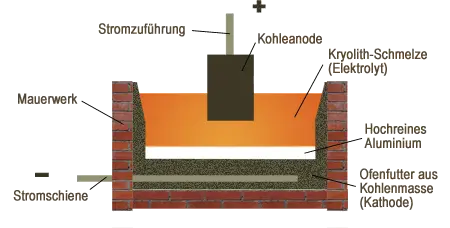
Die Chemie hinter der Aluminiumherstellung
Die Herstellung von Aluminium erfolgt ausschließlich durch Schmelzflusselektrolyse von Aluminiumoxid nach dem Kryolith-Tonerde-Verfahren (Hall-Héroult-Prozess). Zur Herabsetzung des Schmelzpunktes wird das Aluminiumoxid zusammen mit Kryolith geschmolzen. Der Prozess ist aufgrund der hohen Bindungsenergie des Aluminiums sehr energieaufwändig. Bei der Elektrolyse entsteht an der den Boden des Gefäßes bildenden Kathode Aluminium und an der Anode Sauerstoff, der mit dem Graphit (Kohlenstoff) der Anode zu Kohlendioxid und Kohlenstoffmonoxid reagiert.
Die Graphitblöcke, welche die Anode bilden, brennen wegen des im Prozess entstehenden Sauerstoffs langsam ab und werden von Zeit zu Zeit ersetzt. Die Graphit-Kathode (Gefäßboden) ist gegenüber dem Aluminium inert. Das sich am Boden sammelnde flüssige Aluminium wird mit einem Saugrohr abgesaugt.
Die Aluminiumherstellung ist nur in der Nähe preiswert zur Verfügung stehender Elektroenergie wirtschaftlich.
Vereinfacht lassen sich die Elektrodenvorgänge so darstellen:
Schmelzen: $\qquad \mathrm { Al_2O_3 \; \leftrightharpoons \; 2 \ Al^{3+} + 3 \ O^{2-} }$
Kathode: $\qquad \quad \mathrm { 2 \ Al^{3+} + 6 \ e^{-} \; \longrightarrow \; 2 \ Al }$
Anode: $\qquad \qquad \mathrm { 3 \ O^{2-} \; \leftrightharpoons \; \frac {3}{2} \ O_{2} + 6 \ e^{-} }$
Verwendung
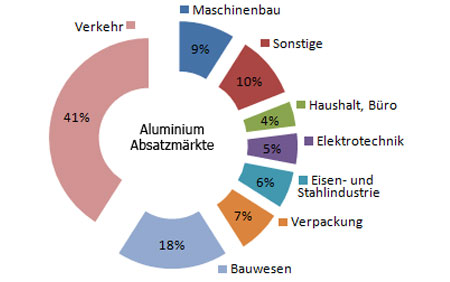
Der industrielle Einsatz von Aluminium steigt ständig. Welche Industriezweige wieviel Aluminium verbrauchen, geht aus Bild 7 hervor. Die wichtigsten Einsatzgebiete sind:
- Konstruktionswerkstoff - Wegen seiner geringen Dichte wird Aluminium gern dort verwendet, wo es auf geringe Masse ankommt, vor allem in der Luft- und Raumfahrt, aber auch im Fahrzeugbau.
- Elektrotechnik - Hervorzuheben ist das geringe Absinken der spezifischen elektrischen Leitfähigkeit von Aluminium bei Zusatz von Legierungsbestandteilen, wohingegen Kupfer bei Verunreinigungen eine stark absinkende Leitfähigkeit zeigt.
- Elektronik - Die Elektronikindustrie setzt Aluminium aufgrund der guten Verarbeitbarkeit und der guten elektrischen Leitfähigkeit und Wärmeleitfähigkeit ein. Aluminium wird zur Herstellung von Antennen und Hohlleitern verwendet.
- Verpackung und Behälter - In der Verpackungsindustrie wird Aluminium zu Getränke- und Konservendosen sowie zu Aluminiumfolie verarbeitet. Aus Aluminium werden auch Kochtöpfe und andere Küchengeräte sowie Reise- und Militär-Geschirr hergestellt.
- Optik und Lichttechnik - Aluminium wird als Spiegelbeschichtung von Oberflächenspiegeln, unter anderem in Scannern, Kraftfahrzeug-Scheinwerfern und Spiegelreflexkameras eingesetzt. Es reflektiert im Gegensatz zu Silber auch Ultraviolettstrahlung.
Metallschaum
Zukunftsträchtig scheinen neu entwickelte Werkstoffe auf Aluminiumbasis zu sein, die so genannten Metallschäume. Sie besitzen eine durch Poren und Hohlräume bedingte geringe Dichte, weisen aber eine hohe Spezifische Steifigkeit und Festigkeit auf. Neben Aluminium oder Aluminiumlegierungen ist es unter Verwendung geeigneter Treibmittel ebenfalls möglich Schäume aus Kupfer, Zink, Blei oder Stahl/Eisen herzustellen.

Metallschaum aus Aluminium wird hergestellt, indem man Aluminiumpulver mit einem ebenfalls pulverförmigen Treibmittel unter hohem Druck zu einer massiven Einheit zusammenpresst. Anschließend wird dieses feste Teil in einem Ofen erhitzt. Bei mehr als 400°C zersetzt sich das Treibmittel und setzt ein harmloses Gas frei. Dadurch geht das Metall wie ein Laib Brot beim Backen auf. Der fertige Aluschaum besteht aus 70 - 80 % Luft, wodurch er sehr gute Dämmeigenschaften erhält. Die Gasbläschen im Aluminiumschaum sind etwa so groß wie die Bläschen in feinem Badeschaum. Aluminiumschaum ist sehr leicht, seine Dichte liegt unter 1 g/cm³. Wegen der geringen Dichte und der geschlossenen Poren geht Aluminiumschaum in Wasser nicht unter.
