Ruthenium
| Eigenschaften | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemein | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name, Symbol, Ordnungszahl | Ruthenium, Ru, 44 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie | Übergangsmetalle | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppe, Periode, Block | 8, 5, d | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aussehen | silbrig weiß metallisch | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS-Nummer | 7440-18-8 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massenanteil an der Erdhülle | 0,02 ppm[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomar [2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atommasse | 101,07 u | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomradius (berechnet) | 130 (178) pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalenter Radius | 146 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronenkonfiguration | [Kr] 4d7 5s1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. Ionisierungsenergie | 710,2 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. Ionisierungsenergie | 1620 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. Ionisierungsenergie | 2747 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physikalisch [2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aggregatzustand | fest | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristallstruktur | hexagonal | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dichte | 12,37 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohshärte | 6,5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetismus | paramagnetisch ( = 6,6 · 10−5)[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzpunkt | 2607 K (2334 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Siedepunkt | 4423 K[4] (4150 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molares Volumen | 8,17 · 10−6 m3/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Verdampfungswärme | 619 k/mol[4] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzwärme | 25,7 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dampfdruck | 1,4 Pa bei 2523 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schallgeschwindigkeit | 5970 m/s | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektrische Leitfähigkeit | 14,1 · 106 A/(V · m) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Wärmeleitfähigkeit | 120 W/(m · K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemisch [2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidationszustände | 2, 3, 4, 6, 8 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativität | 2,2 (Pauling-Skala) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotope | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Weitere Isotope siehe Liste der Isotope | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NMR-Eigenschaften | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ruthenium (v. lateinisch ruthenia „Ruthenien“, „Russland“) ist ein chemisches Element mit dem Elementsymbol Ru und der Ordnungszahl 44. Es zählt zu den Übergangsmetallen, im Periodensystem steht es in der 5. Periode und der Gruppe 8 (früher Teil der 8. Nebengruppe) oder auch Eisengruppe. Es ist ein silberweißes, hartes und sprödes Platinmetall.
Ruthenium wurde 1844 vom deutschbaltischen Chemiker Karl Ernst Claus in sibirischen Platinerzen entdeckt. Es ist sehr selten und wird nur in geringen Mengen genutzt. Die Hauptanwendungsgebiete des Metalls liegen in der Elektronikindustrie beim Perpendicular Recording, einem Datenspeicherverfahren für Festplatten, und als Katalysator in verschiedenen chemischen Verfahren wie Hydrierungen, Methanisierung oder bei der Ammoniaksynthese. Einige Rutheniumverbindungen, z.B. die Grubbs-Katalysatoren, spielen ebenfalls eine Rolle in chemischen Synthesen.
Ruthenium besitzt keine bekannten biologischen Funktionen, jedoch werden einige Komplexe des Metalls hinsichtlich ihrer Wirkung als Mittel gegen Krebs erforscht.
Geschichte

Nachdem zwischen 1803 und 1804 kurz hintereinander die vier Platinmetalle Palladium, Rhodium, Iridium und Osmium von William Hyde Wollaston und Smithson Tennant in Platinerzen entdeckt wurden, versuchten andere Chemiker ebenfalls, aus derartigen Erzen bislang unbekannte Elemente zu isolieren.
Zunächst meldete der polnische Chemiker Jędrzej Śniadecki 1808, dass er im Jahr zuvor in seltenen südamerikanischen Platinerzen ein neues Element entdeckt habe. Er nannte dieses nach dem kurz zuvor entdeckten Asteroiden Vesta Vestium. Nachdem diese Entdeckung von anderen Chemikern jedoch nicht verifiziert werden konnte, wurde die Entdeckung wieder verworfen.[8]
Nach der Entdeckung großer Platinerzlagerstätten im Ural 1819 begannen Jöns Jakob Berzelius in Stockholm und Gottfried Osann in Tartu diese zu untersuchen. Dabei erhielt Osann 1828 zunächst ein unbekanntes weißes Oxid, dessen Eigenschaften zu keinem anderen Oxid passten, und nach Reduktion ein unbekanntes goldgelbes Metall. Dieses nannte er nach dem Herkunftsland des Erzes Russland Ruthenium.[9] Nachdem jedoch Berzelius diese Entdeckung nicht bestätigen konnte, wiederholte Osann seine Arbeiten, konnte aber die Isolierung des Rutheniums nicht wiederholen und zog daraufhin seine Entdeckung zurück.[10][11]
Der deutschbaltische Chemiker Karl Ernst Claus versuchte seit 1841 an der Universität Kasan, Osanns Experimente zu wiederholen und unbekannte Elemente aus Platinerzen zu extrahieren. Dies gelang ihm schließlich 1844, als er sechs Gramm eines unbekannten hellgrauen Metalls gewinnen konnte. Er nannte das neue Element wie Osann ebenfalls Ruthenium. Ebenso wie Osann bat Claus Berzelius, die Experimente zu überprüfen und das neue Element zu bestätigen. Da dieser 1845 die Ergebnisse bestätigen konnte, gilt seitdem Claus als Entdecker des Rutheniums.[12]
Vorkommen
Ruthenium zählt zu den seltensten nicht-radioaktiven Elementen auf der Erde. Seine Häufigkeit beträgt etwa 1 ppb und ist vergleichbar mit der von Rhodium, Iridium oder Rhenium.[13] Es ist meist mit anderen Platinmetallen vergesellschaftet, so beträgt der Anteil des Rutheniums in der wichtigsten Platinmetalllagerstätte, dem südafrikanischen Bushveld-Komplex, zwischen acht und zwölf Prozent.[14]
Wie andere Platinmetalle kommt es gediegen in der Natur vor und ist darum von der IMA als Mineral mit der System-Nr. 1.AF.05 (Klasse: Elemente, Abteilung: Metalle und intermetallische Verbindungen, Unterabteilung: Platin-Gruppen-Elemente) anerkannt.[15]
Seine Typlokalität, in der das Mineral 1974 erstmals von Y. Urashima, T. Wakabayashi, T. Masaki und Y. Terasaki gefunden wurde, liegt am Fluss Uryū auf der japanischen Insel Hokkaidō. Neben dieser sind weitere 21 Fundorte elementaren Rutheniums bekannt. Zu diesen zählen unter anderem Nischni Tagil und der Miass-Fluss in Russland, der Yuba River in Kalifornien oder der Bushveld-Complex in Südafrika.[16]
Neben elementarem Ruthenium sind auch verschiedene rutheniumhaltige Minerale bekannt. Bei den zur Zeit 13 bekannten (Stand: 2010)[17] handelt es sich um Legierungen mit anderen Platinmetallen wie Rutheniridosmin, Sulfide wie Laurit (RuS2) oder Arsenide wie Ruthenarsenit (Ru,Ni)As.
Gewinnung und Darstellung

Durch die Ähnlichkeiten und geringe Reaktivität der Platinmetalle ist eine Trennung dieser Elemente kompliziert. Es existieren mehrere Möglichkeiten, Ruthenium zu isolieren. Enthält ein Erz eine hohe Rutheniumkonzentration, erfolgt die Abtrennung des Rutheniums am besten zuerst und wird durch Destillation erreicht. Dazu wird eine drei- oder sechswertiges Ruthenium enthaltende Lösung mit Oxidationsmitteln wie Chlor, Chloraten oder Kaliumpermanganat versetzt. Durch dieses wird das Ruthenium zum leicht flüchtigen Ruthenium(VIII)-oxid oxidiert. Dieses kann in verdünnter Salzsäure aufgefangen und zu wasserlöslichen Chlororuthenat-Komplexen reduziert werden. Der Grund für dieses Vorgehen sind die Gefahren, die durch die Bildung von Ruthenium(VIII)-oxid während der Trennung bestehen. So können durch Reaktion von Ruthenium(VIII)-oxid mit Ammoniumsalzen explosive Stickstoff-Chlor-Verbindungen entstehen.[14]
Sind nur geringe Mengen Ruthenium im Ausgangsmaterial enthalten, werden zunächst die übrigen Platinmetalle abgetrennt. Dazu gibt es für die verschiedenen Metalle unterschiedliche Verfahren, insbesondere die Extraktion mit geeigneten Lösungsmitteln oder das Ausfällen der schwerlöslichen Salze. Schließlich bleibt das gelöste Ruthenium übrig. Die Lösung wird von vorhandenem Ammonium befreit, das Ruthenium zu Ruthenium(VIII)-oxid oxidiert und durch Destillation abgetrennt.[14]
Um metallisches Ruthenium zu erhalten, wird es entweder als Ammoniumhexachlororuthenat oder als Ruthenium(IV)-oxid ausgefällt und bei 800 °C in einer Wasserstoffatmosphäre reduziert.
Neben Platinerzen ist auch der Anodenschlamm, der bei der Nickelproduktion anfällt, ein wichtiger Rohstoff für die Gewinnung von Ruthenium und den anderen Platinmetallen. Eine weitere mögliche Quelle für Ruthenium sind abgebrannte Brennelemente, da bei der Kernspaltung auch Ruthenium und andere Platinmetalle entstehen. Eine Tonne dieser Brennelemente enthält über zwei Kilogramm Ruthenium, aber auch andere Platinmetalle wie Rhodium oder Palladium.[18] Die Weltproduktion an Ruthenium liegt im Bereich von ca. 20 t pro Jahr (Stand 2008).[19]
Eigenschaften
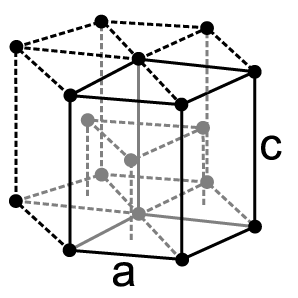
Physikalische Eigenschaften
Ruthenium ist ein silberweißes, hartes und sprödes Metall. Mit einer Dichte von 12,37 g/cm3 ist es nach Palladium das zweitleichteste Platinmetall. Ruthenium schmilzt bei 2606 K und siedet bei etwa 4592 K, lediglich Iridium und Osmium besitzen unter den Platinmetallen höhere Schmelz- und Siedepunkte.[20] Unterhalb von 0,49 K wird das Element zum Supraleiter.[21]
Ebenso wie Osmium kristallisiert Ruthenium in einer hexagonal-dichtesten Kugelpackung in der Raumgruppe 6/mmm mit den Gitterparametern a = 270,6 pm und c = 428,1 pm sowie zwei Formeleinheiten pro Elementarzelle.[22] Mitunter werden vier verschiedene polymorphe Formen des Rutheniums angegeben, in die sich das Metall beim Erhitzen auf Temperaturen von 1308, 1473 und 1770 K umwandelt. Diese beruhen jedoch auf kalorimetrischen Messungen aus dem Jahr 1931, die in der Folgezeit nicht bestätigt werden konnten. Daher ist es wahrscheinlich, dass das Element bis zum Schmelzpunkt lediglich eine Modifikation besitzt.[23]
Chemische Eigenschaften
Innerhalb der Eisengruppe besitzt Ruthenium ähnliche Eigenschaften wie das Osmium, während es sich von denen des Eisens deutlich unterscheidet. Es ist wie andere Platinmetalle und im Gegensatz zum Eisen ein reaktionsträges Edelmetall. Mit dem Sauerstoff der Luft reagiert es erst bei Temperaturen über 700 °C und bildet dabei Ruthenium(VIII)-oxid. Hierbei unterscheidet es sich auch vom Osmium, das schon bei Raumtemperatur beim Kontakt mit Sauerstoff in Spuren das entsprechende Osmium(VIII)-oxid bildet. Auch mit Fluor und Chlor reagiert Ruthenium erst in der Hitze und bildet dabei Ruthenium(VI)-fluorid beziehungsweise Ruthenium(III)-chlorid.
Das Metall löst sich nicht in Säuren wie z. B. Flusssäure, Schwefelsäure, Salpetersäure oder auch Königswasser. Angegriffen wird es dagegen langsam von wässrigen Chlor- und Bromlösungen, schnell von Cyanidlösungen und von Quecksilber(II)-chlorid. Starke Oxidationsmittel wie Kaliumhydroxid-Kaliumnitrat- oder Natriumhydroxid-Natriumperoxid-Schmelzen oxidieren Ruthenium schnell.[23]
Isotope
Es sind insgesamt 33 Isotope und weitere sechs Kernisomere des Rutheniums zwischen 87Ru und 120Ru bekannt. Von diesen sind sieben stabil und kommen auch in der Natur vor. Am häufigsten ist dabei das Isotop 102Ru mit einem Anteil von 31,6 % an der natürlichen Isotopenzusammensetzung. Vier Isotope, 104Ru, 101Ru, 100Ru und 99Ru sind mit Anteilen zwischen 12–19 % ähnlich häufig. Die seltensten der stabilen Isotope sind 96Ru und 98Ru mit Anteilen von 5,52 beziehungsweise 1,88 %. Von den instabilen Isotopen besitzen lediglich 97Ru, 103Ru und 106Ru Halbwertszeiten von einigen Tagen; die der anderen liegen im Bereich von Millisekunden bis Stunden.[24]
Rutheniumisotope, vor allem 101Ru, 102Ru und 104Ru entstehen bei der Kernspaltung und sind daher in abgebrannten Brennelementen vorhanden. Eine Tonne bei der Kernspaltung eingesetztes Uran enthält als Spaltprodukt etwa 1,9 Kilogramm Ruthenium. Dieses kann bei der Wiederaufarbeitung durch Oxidation zu flüchtigem Ruthenium(VIII)-oxid aus dem in Salpetersäure gelösten Gemisch abgetrennt werden. Da dieses Ruthenium aber auch einen Anteil des radioaktiven und mit einer Halbwertszeit von 373 Tagen relativ langlebigen Isotopes 106Ru enthält, kann es nicht direkt für andere Zwecke eingesetzt werden.[25][26]
Verwendung
Ruthenium wird nur in geringem Maß genutzt. Der größte Teil des Metalls wird dabei in der Elektronikindustrie verwendet. Hier spielt seit dem Jahr 2006 vor allem das Perpendicular Recording eine Rolle, ein Verfahren zur Speicherung von Daten auf Festplatten, bei dem eine dünne Schicht Ruthenium die Speicherschicht aus einer Cobalt-Chrom-Platin-Legierung von einer weichmagnetischen Unterschicht trennt. Der Grund dafür, dass Ruthenium genutzt wird, liegt in seiner hexagonalen Kristallstruktur, die eine ähnliche Gitterkonstante wie die verwendete Speicherschicht-Legierung besitzt.[27][19] Dünne Rutheniumschichten werden in elektrischen Kontakten wie Schleifringen oder Reed-Relais eingesetzt. Sie sind im Vergleich zu anderen einsetzbaren Metallen wie cobalt-gehärtetem Gold härter und damit beständiger gegen Abrieb.[28]
Wie andere Platinmetalle wirkt auch Ruthenium katalytisch. So kann es etwa zur Hydrierung von Aromaten, Säuren und Ketonen verwendet werden.[29] Ruthenium wirkt auch katalytisch bei der Methanisierung, der Herstellung von Methan aus Wasserstoff und Kohlenstoffmonoxid bzw. Kohlenstoffdioxid. Ruthenium hat bislang jedoch nur geringe Anwendungen für die Methanisierung gefunden, meist werden Nickel-Katalysatoren genutzt. Die zur Methanisierung mit Ruthenium benötigten niedrigeren Temperaturen könnten für Langzeit-Weltraummissionen interessant sein, da das von den Astronauten ausgeatmete Kohlenstoffdioxid umgesetzt und so der Sauerstoffkreislauf geschlossen werden könnte.[30][31]
Analog zu Eisen und Osmium katalysiert auch Ruthenium die Ammoniak-Synthese aus Stickstoff und Wasserstoff. Es besitzt eine höhere Katalysatoraktivität als Eisen und ermöglicht so eine höhere Ausbeute bei niedrigeren Drücken. Der Einsatz des Metalls ist vor allem durch den Preis limitiert.[32] Industriell eingesetzt wird ein Rutheniumkatalysator, der auf einer Kohlenstoffmatrix geträgert und durch Barium und Caesium als Promotoren verbessert wurde, seit 1998 in zwei Produktionsanlagen von KBR auf Trinidad. Da die langsame Methanisierung des Kohlenstoffträgers beim Prozessablauf stört, wird an kohlenstofffreien Rutheniumkatalysatoren für die Ammoniaksynthese geforscht.[33]
In kleinen Mengen wird Ruthenium in Legierungen von Palladium oder Platin zur Erhöhung der Härte eingesetzt. Rutheniumhaltige Legierungen werden unter anderem für Federspitzen von Füllfederhaltern[29] oder für Zahnfüllungen gebraucht.[34] Titanlegierungen werden durch geringe Mengen an Ruthenium (0,1 %) korrosionsbeständiger, was für Anwendungen in der chemischen Industrie oder der Ölförderung wichtig ist. Es ist dabei eine mögliche Alternative zu Palladium.[35] Auch in Superlegierungen auf Nickelbasis, die für Turbinenschaufeln verwendet werden, kann Ruthenium ein Legierungsbestandteil sein, es bewirkt hier eine erhöhte Phasenstabilität.[36]
Ein großer Teil des Rutheniums wird nicht in Form des Metalls, sondern als Verbindung, vor allem als Ruthenium(IV)-oxid eingesetzt, das unter anderem als Material für Widerstände und Elektroden, beispielsweise für die Beschichtung von Titananoden in der Chloralkali-Elektrolyse.[29][8]
Biologische Bedeutung
Wie andere Platinmetalle besitzt Ruthenium keine biologische Bedeutung und kommt im Körper normalerweise nicht vor. Verschiedene Rutheniumkomplexe haben ein pharmakologisches Potenzial. Es werden verschiedene Anwendungen als Wirkstoff erforscht. Einige Verbindungen werden schon in klinischen Studien erprobt. Am wichtigsten hierfür ist die Wirkung als Zytostatikum, also als Mittel zur Therapie von Krebs. Hier gelten Rutheniumkomplexe als mögliche Alternativen zu Cisplatin beziehungsweise Carboplatin. Neben der tumorhemmenden Wirkung, die die Verbindungen mehrerer Platinmetalle besitzen, begründet sich dies vor allem auf drei Eigenschaften von Rutheniumkomplexen:
- Sie besitzen einen langsamen Ligandenaustausch, so dass der Komplex die richtige Stelle im Körper erreichen kann, ohne dass er mit Wasser oder anderen Molekülen reagiert,
- mehrere mögliche Oxidationsstufen (+2, +3, +4) unter physiologischen Bedingungen, sowie
- eine große Ähnlichkeit zu Eisen, so dass sie dieses in Proteinen wie Transferrin ersetzen können.
Da dreiwertiges Ruthenium relativ inaktiv ist, während zweiwertiges eine starke tumorhemmende Wirkung zeigt, sollte es möglich sein, dreiwertiges Ruthenium in einem Tumor zum zweiwertigen zu reduzieren und so zu aktivieren. Damit wäre eine selektivere Wirkung als bei anderen Zytostatika möglich.[37] Bisher ist noch kein Arzneimittel auf der Basis von Ruthenium zugelassen.[38]
Neben der Verwendung in der antineoplastischen Chemotherapie werden auch Anwendungen von Rutheniumverbindungen als Immunsuppressivum, Antibiotikum und antimikrobielle Substanz, beispielsweise zur Bekämpfung von Malaria oder der Chagas-Krankheit, untersucht.[37]
Vorsichtsmaßnahmen
Ruthenium ist als Metall ungiftig. Im Gegensatz zu Osmium bildet sich auch das giftige und leicht flüchtige Tetraoxid nicht durch Reaktion mit Sauerstoff bei Raumtemperatur, sondern nur bei der Reaktion mit starken Oxidationsmitteln. In Pulverform ist Ruthenium brennbar, bei Bränden darf nicht mit Wasser, sondern nur mit Löschpulver oder Metallbrandlöschern gelöscht werden.[7]
Verbindungen
Ruthenium bildet Verbindungen in den Oxidationsstufen −2 bis +8, die stabilsten und häufigsten sind dabei +3 und +4. Es zählt damit zusammen mit Osmium und Xenon zu den Elementen, bei denen die höchste Oxidationsstufe +8 chemisch erreicht werden kann.
Sauerstoffverbindungen
Ruthenium bildet mit Sauerstoff drei binäre Oxide, Ruthenium(VIII)-oxid, Ruthenium(VI)-oxid und Ruthenium(IV)-oxid. Dazu sind noch Ruthenium(III)-oxid, dieses jedoch nur als Hydrat, und verschiedene Ruthenate, Salze deren Anion eine Ruthenium-Sauerstoffverbindung ist, bekannt. Ruthenium(VIII)-oxid ist, wie Osmium(VIII)-oxid, eine gelbe, leicht flüchtige und giftige Verbindung, die durch Reaktion von Ruthenium oder dessen Verbindungen mit starken Oxidationsmitteln gewonnen wird und die als starkes Oxidationsmittel und für die Abtrennung von Ruthenium von anderen Platinmetallen von Bedeutung ist. Während Ruthenium(VI)-oxid nur in der Gasphase bekannt ist, ist Ruthenium(IV)-oxid ein stabiles, in der Rutilstruktur kristallisierendes Salz, das unter anderem in Widerständen verwendet wird und zur Beschichtung von Elektroden dient.
Im Gegensatz zu Osmium ist vom Ruthenium kein achtwertiges Ruthenat bekannt, in wässrigen Lösungen entsteht bei Reaktion mit starken Oxidationsmitteln ein siebenwertiges, dem Permanganat entsprechendes Perruthenat. Dieses wirkt ebenfalls als Oxidationsmittel, ist jedoch milder und damit selektiver als Ruthenium(VIII)-oxid oder Osmium(VIII)-oxid. So werden primäre Alkohole durch Perruthenate nicht zu Carbonsäuren, sondern nur zu Aldehyden oxidiert. Häufig wird es in organischen Synthesen in Form von Tetrapropylammoniumperruthenat (TPAP) eingesetzt. Es wird dabei zu vierwertigem Ruthenium reduziert.[39]
Komplexe
Vom Ruthenium sind zahlreiche Komplexverbindungen sowohl mit anorganischen als auch organischen Liganden bekannt. Diese können in sehr unterschiedlichen Oxidationsstufen von −2 bis +8 vorliegen. In mittleren Stufen, wie +2, +3 und +4, sind auch nichtklassische Komplexe synthetisiert worden, die Metallcluster mit Ruthenium-Ruthenium-Bindungen enthalten.
Einige Rutheniumkomplexe haben Anwendung als Katalysatoren in verschiedenen organischen Synthesen gefunden. So ist Ruthenium das Zentralmetall in den Komplexen der Grubbs-Katalysatoren, die zu den wichtigsten Katalysatoren für die Olefinmetathese zählen. Ein weiterer, in der organischen Synthese bedeutender Komplex ist der Noyori-Katalysator, ein Ruthenium-Chlor-BINAP-Komplex, der eine effiziente asymmetrische Hydrierung von β-Keto-Estern ermöglicht.[40]

Rutheniumkomplexe sind in der Lage, Polymerisationen zu katalysieren. Neben der auf der Metathese beruhenden Ringöffnungspolymerisation (ROMP) können auch lebende freie radikalische Polymerisationen durch Rutheniumkomplexe ermöglicht werden. Ein Beispiel hierfür ist die Polymerisation von Methylmethacrylat mit RuCl2(PPh3)3 als Katalysator.[41]
Zu den bekanntesten Rutheniumkomplexen zählt der Ammin-Komplex Rutheniumrot, der in der Histologie als Färbemittel sowie als Redoxindikator und zur Untersuchung von Textilfasern verwendet wird.[42]
Weitere Rutheniumverbindungen
Mit den Halogenen Fluor, Chlor, Brom und Iod bildet Ruthenium eine Reihe von Verbindungen. Am stabilsten sind dabei die dreiwertigen Rutheniumhalogenide, diese sind auch von allen Halogenen bekannt. In höheren Oxidationsstufen sind lediglich die Fluoride bis zum Ruthenium(VI)-fluorid sowie das instabile Ruthenium(IV)-chlorid bekannt. Die wichtigste dieser Verbindungen ist Ruthenium(III)-chlorid, die ein Ausgangsstoff für die Synthese vieler anderer Rutheniumverbindungen ist.
Einen Überblick über Rutheniumverbindungen bietet die Kategorie:Rutheniumverbindung.
Einzelnachweise
- ↑ Harry H. Binder: Lexikon der chemischen Elemente, S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3.
- ↑ Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Ruthenium) entnommen.
- ↑ Weast, Robert C. (ed. in chief): CRC Handbook of Chemistry and Physics. CRC (Chemical Rubber Publishing Company), Boca Raton 1990. Seiten E-129 bis E-145. ISBN 0-8493-0470-9. Werte dort sind auf g/mol bezogen und in cgs-Einheiten angegeben. Der hier angegebene Wert ist der daraus berechnete maßeinheitslose SI-Wert.
- ↑ 4,0 4,1 Yiming Zhang, Julian R. G. Evans, Shoufeng Yang: Corrected Values for Boiling Points and Enthalpies of Vaporization of Elements in Handbooks. In: Journal of Chemical & Engineering Data. 56, 2011, S. 328–337, doi:10.1021/je1011086.
- ↑ 5,0 5,1 Datenblatt Ruthenium bei Sigma-Aldrich, abgerufen am 22. April 2011.
- ↑ Seit 1. Dezember 2012 ist für Stoffe ausschließlich die GHS-Gefahrstoffkennzeichnung zulässig. Bis zum 1. Juni 2015 dürfen noch die R-Sätze dieses Stoffes für die Einstufung von Zubereitungen herangezogen werden, anschließend ist die EU-Gefahrstoffkennzeichnung von rein historischem Interesse.
- ↑ 7,0 7,1 Eintrag zu Ruthenium in der GESTIS-Stoffdatenbank des IFA, abgerufen am 27. April 2008 (JavaScript erforderlich).
- ↑ 8,0 8,1 John Emsley: Nature’s Building Blocks. An A–Z Guide to the Elements. Oxford University Press, Oxford 2001, ISBN 978-0-19-850341-5, S. 368–369.
- ↑ G. Osann: Fortsetzung der Untersuchung des Platins vom Ural. In: Poggendorffs Annalen der Physik und Chemie. 14, 1828, S. 329–257 (Volltext auf Gallica).
- ↑ G. Osann: Berichtigung, meine Untersuchung des uralschen Platins betreffend. In: Poggendorffs Annalen der Physik und Chemie. 15, 1829, S. 158 (Volltext auf Gallica).
- ↑ Helvi Hödrejärv: Gottfried Wilhelm Osann and ruthenium. In: Proceedings of the Estonian Academy of Sciences, Chemistry. 53, Nr. 3, 2004, S. 125–144 (eingeschränkte Vorschau in der Google Buchsuche).
- ↑ V. N. Pitchkov: The Discovery of Ruthenium. In: Platinum Metals Review. 1996, 40, 4, S. 181–188.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. CRC, Boca Raton 2009, ISBN 978-1-4200-9084-0 (Section 14, Geophysics, Astronomy, and Acoustics; Abundance of Elements in the Earth's Crust and in the Sea).
- ↑ 14,0 14,1 14,2 Hermann Renner u. a.: Platinum Group Metals and Compounds. In: Ullmann’s Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2001, doi:10.1002/14356007.a21_075.
- ↑ IMA/CNMNC List of Mineral Names - Ruthenium (englisch, PDF 1,8 MB; S. 247).
- ↑ Jolyon Ralph und Ida Chau: Ruthenium. In: mindat.org. abgerufen am 12. April 2010 (engl.).
- ↑ Webmineral - Mineral Species sorted by the element Ru (Ruthenium) (englisch)
- ↑ Zdenek Kolarik, Edouard V. Renard: Potential Applications of Fission Platinoids in Industry. In: Platinum Metals Review. 2005, 49, S. 79–90.
- ↑ 19,0 19,1 United States Geological Survey (Hrsg.): 2008 Minerals Yearbook – Platinum-Group Metals. 2007.
- ↑ J. W. Arblaster: Vapour Pressure Equations for the Platinum Group Elements. In: Platinum Metals Review. 51, Nr. 3, 2007, S. 130–135, doi:10.1595/147106707X213830.
- ↑ Mark Winter: Ruthenium: physical properties. In: Webelements.com. Abgerufen am 28. April 2010.
- ↑ K. Schubert: Ein Modell für die Kristallstrukturen der chemischen Elemente. In: Acta Crystallographica. 30, 1974, S. 193–204, doi:10.1107/S0567740874002469.
- ↑ 23,0 23,1 Joseph A. Rard: Chemistry and thermodynamics of ruthenium and some of its inorganic compounds and aqueous species. In: Chemical Reviews. 85, Nr. 1, 1985, S. 1–39, doi:10.1021/cr00065a001.
- ↑ G. Audi, O. Bersillon, J. Blachot, A. H. Wapstra: The NUBASE evaluation of nuclear and decay properties. In: Nuclear Physics. A729, 2003, S. 3–128.
- ↑ R .P. Bush: Recovery of Platinum Group Metals from High Level Radioactive Waste. In: Platinum Metals Review. 35, Nr. 4, 1991, S. 202–208.
- ↑ Martin Volkmer: Basiswissen Kernenergie. Informationskreis Kernenergie, Bonn 1996, ISBN 3-925986-09-X, S. 80.
- ↑ J. Z. Shi u. a.: Influence of dual-Ru intermediate layers on magnetic properties and recording performance of CoCrPt–SiO2 perpendicular recording media. In: Applied Physics Letters. 87, 2005, S. 222503–222506, doi:10.1063/1.2137447.
- ↑ Paul C. Hydes: Electrodeposited Ruthenium as an Electrical Contact Material. In: Platinum Metals Review. 24, Nr. 2,1980, S. 50–55.
- ↑ 29,0 29,1 29,2 Helmut Sitzmann: Ruthenium. In: Römpp Chemie Lexikon. Thieme, Stand Dezember 2006.
- ↑ Yvonne Traa, Jens Weitkamp: Kinetik der Methanisierung von Kohlendioxid an Ruthenium auf Titandioxid. In: Chemie Ingenieur Technik. 70, Nr. 11, 1998, S. 1428–1430, doi:10.1002/cite.330701115.
- ↑ Heinz Hiller u. a.: Gas Production. In: Ullmann’s Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2001, doi:10.1002/14356007.a12_169.pub2.
- ↑ Max Appl: Ammonia. In: Ullmann’s Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2006, doi:10.1002/14356007.a02_143.pub2.
- ↑ Hubert Bielawa, Olaf Hinrichsen, Alexander Birkner, Martin Muhler: Der Ammoniakkatalysator der nächsten Generation: Barium-promotiertes Ruthenium auf oxidischen Trägern. In: Angewandte Chemie. 113, Nr. 6, 2001, S. 1093–1096, doi:10.1002/1521-3757(20010316)113:6<1093::AID-ANGE10930>3.0.CO;2-3.
- ↑ Karl Eichner, Heinrich F. Kappert: Zahnärztliche Werkstoffe und ihre Verarbeitung. 8. Auflage, Thieme, Stuttgart 2005, ISBN 3-13-127148-5, S. 93.
- ↑ R. W. Schutz: Ruthenium Enhanced Titanium Alloys. In: Platinum Metals Reviews. 40, Nr. 2, 1996, S. 54–61.
- ↑ Yutaka Koizumi u. a.: Development of a Next-Generation Ni-base Single Crystal Superalloy. In: Proceedings of the International Gas Turbine Congress 2003 Tokyo. 2003.
- ↑ 37,0 37,1 Claire S. Allardyce, Paul J. Dyson: Ruthenium in Medicine: Current Clinical Uses and Future Prospects. In: Platinum Metals Review. 45, Nr. 2, 2001, S. 62–69.
- ↑ Emmanuel S. Antonarakis, Ashkan Emadi: Ruthenium-based chemotherapeutics: are they ready for prime time? In: Cancer Chemotherapy and Pharmacology. 66, Nr. 1, 2010, S. 1–9, doi:10.1007/s00280-010-1293-1.
- ↑ Steven V. Ley, Joanne Norman, William P. Griffith, Stephen P. Marsden: Tetrapropylammonium Perruthenate, Pr4N+RuO4−, TPAP: A Catalytic Oxidant for Organic Synthesis. In: Synthesis. 7, 1994, S. 639–666, doi:10.1055/s-1994-25538.
- ↑ Christoph Elschenbroich: Organometallchemie. 6. Auflage. Teubner, Wiesbaden 2008, ISBN 978-3-8351-0167-8, S. 632–633, 642.
- ↑ Ruthenium in Living Radical Polymerisation. In: Platinum Metals Review. 43, Nr. 3, 1999, S. 102.
- ↑ Helmut Sitzmann: Ruthenium-Verbindungen. In: Römpp Chemie-Lexikon. Thieme, Stand April 2009.
Literatur
- Helmut Sitzmann: Ruthenium. In: Römpp Chemie Lexikon. Thieme, Stand Dezember 2006.
- Hermann Renner u. a.: Platinum Group Metals and Compounds. In: Ullmann’s Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2001, doi:10.1002/14356007.a21_075.
- Arnold F. Holleman, Nils Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. De Gruyter, Berlin 2007, ISBN 978-3-11-017770-1.
Weblinks
- EnvironmentalChemistry.com – Ruthenium
- Abbildung in der Elementansammlung von Pniok.de
- Mineralienatlas:Ruthenium (Wiki)
| Alkalimetalle | Erdalkalimetalle | Lanthanoide | Actinoide | Übergangsmetalle | Metalle | Halbmetalle | Nichtmetalle | Halogene | Edelgase | unbekannt |
| Dieser Artikel wurde am 4. Juli 2010 in dieser Version in die Liste der exzellenten Artikel aufgenommen. |