Promethium
| Eigenschaften | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemein | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name, Symbol, Ordnungszahl | Promethium, Pm, 61 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie | Lanthanoide | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppe, Periode, Block | La, 6, f | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aussehen | metallisch | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS-Nummer | 7440-12-2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massenanteil an der Erdhülle | 1,5 · 10−15 ppm[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomar [2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atommasse | (147Pm) 146,9151 u | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomradius (berechnet) | 185 (205) pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalenter Radius | 199 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronenkonfiguration | [Xe] 4f5 6s2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. Ionisierungsenergie | 540 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. Ionisierungsenergie | 1050 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. Ionisierungsenergie | 2150 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physikalisch [2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aggregatzustand | fest | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dichte | 7,2 g/cm3[1] (25 °C)[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzpunkt | 1353 K (1080[4] °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Siedepunkt | 3273 K[5] (3000 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molares Volumen | 20,10 · 10−6[1] m3/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Verdampfungswärme | 290 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzwärme | 7,7 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektrische Leitfähigkeit | 1,33 · 106 A/(V · m) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Wärmeleitfähigkeit | 15 W/(m · K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemisch [2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidationszustände | 3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Normalpotential | −2,423 V (Pm3+ + 3 e− → Pm)[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotope | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Weitere Isotope siehe Liste der Isotope | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| weitere Sicherheitshinweise | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radioaktivität | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
Radioaktives Element | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
Promethium (von Prometheus, einem Titanen der griechischen Mythologie) ist ein chemisches Element mit dem Elementsymbol Pm und der Ordnungszahl 61. Im Periodensystem steht es in der Gruppe der Lanthanoide und zählt damit auch zu den Metallen der seltenen Erden. Promethium wurde 1945 als Spaltprodukt des Urans entdeckt. Durch seine Entdeckung wurde die letzte Lücke im Periodensystem geschlossen.
Alle Promethium-Isotope sind radioaktiv, das heißt, sämtliche Atomkerne, die 61 Protonen enthalten, sind instabil und zerfallen. Promethium und das leichtere Technetium (43) sind die einzigen Elemente mit kleinerer Ordnungszahl als Bismut (83), die diese Eigenschaft besitzen.
Geschichte
Fehlgeschlagene Entdeckungen
Die erste Entdeckung wurde von den italienischen Wissenschaftlern Luigi Rolla und Lorenzo Fernandes aus Florenz veröffentlicht. Nach der Trennung eines Didym-Nitrat-Konzentrats durch fraktionierte Kristallisation aus dem brasilianischen Mineral Monazit, welches zu 70 % Dysprosium und Neodym sowie zu 30 % aus den anderen Lanthanoiden besteht, erhielten sie eine Lösung, die hauptsächlich Samarium enthielt. Diese Lösung ergab Röntgenspektren, die sie als Samarium und Element 61 interpretierten. Sie benannten das Element 61 zu Ehren ihrer Stadt Florentium. Die Ergebnisse wurden im Jahr 1926 veröffentlicht, doch die Wissenschaftler behaupteten, dass die Experimente im Jahr 1924 durchgeführt worden seien.[7][8][9][10][11][12]
Im selben Jahr 1926 veröffentlichten Smith Hopkins und Len Yntema an University of Illinois in Urbana-Champaign die Entdeckung des Elements 61. Sie nannten es nach der Universität Illinium.[13][14][15]
Keine der beiden Entdeckungen konnte überprüft werden. So behaupteten mehrere Gruppen, das Element erzeugt zu haben, aber sie konnten ihre Entdeckungen aufgrund der Schwierigkeiten bei der Trennung von Promethium von den anderen Elementen nicht bestätigen.
Nachweis durch Marinsky, Glendenin und Coryell
Promethium wurde 1945 im Oak Ridge National Laboratory (ORNL) (Tennessee, USA) von Jacob A. Marinsky, Lawrence E. Glendenin und Charles D. Coryell als Spaltprodukt des Urans entdeckt. Bedingt durch die militärischen Forschungen während des Zweiten Weltkriegs wurde ihre Entdeckung erst 1947 veröffentlicht.[16][17] Den Namen Promethium wählten sie in Anlehnung an den griechischen Titanen Prometheus, der den Menschen das Feuer brachte und so den Zorn der Götter erweckte. Dies war als Warnung an die Menschheit gedacht, die zu diesem Zeitpunkt mit dem nuklearen Wettrüsten begann. Der Name wurde von Grace Mary Coryell, Charles Coryells Frau, vorgeschlagen.
-
Jacob A. Marinsky
-
Lawrence E. Glendenin
-
Charles D. Coryell
Vorkommen
Irdisches Vorkommen
In der Natur findet sich Promethium zumeist als Produkt der Spontanspaltung von Uran sowie durch Alphazerfall des Europiumisotops 151Eu. In Spuren findet es sich in Pechblende in einer Konzentration von (4±1)·10−15 Gramm 147Pm pro kg.[18] Das gleichmäßige Vorkommen von Promethium in der Erdkruste beträgt etwa 560 g durch Uranspaltung und etwa 12 g durch Alphazerfall von 151Eu.[19]
- Spontanspaltung von Uran:
- Alphazerfall von 151Eu:
Außerirdisches Vorkommen
Promethium wurde im Jahr 1971 im Spektrum des Sterns HR 465 (GY Andromedae) nachgewiesen;[20][21][22][23][24][25][26] und möglicherweise in HD 101065 (Przybylski's star) und HD 965.[27][28]
Gewinnung und Darstellung
Im Jahr 1963 wurden Ionenaustauscher-Methoden im ORNL verwendet, um etwa 10 Gramm Promethium aus den Brennstoffabfällen von Kernreaktoren zu erhalten.[29][30] 1963 konnte Fritz Weigel erstmals metallisches Promethium durch Erhitzen von Promethium(III)-fluorid (PmF3) mit Lithium im Tantal-Tiegel herstellen.[31]
Eigenschaften
Im Periodensystem steht das Promethium mit der Ordnungszahl 61 in der Reihe der Lanthanoide, sein Vorgänger ist das Neodym, das nachfolgende Element ist das Samarium. Sein Analogon in der Reihe der Actinoide ist das Neptunium.
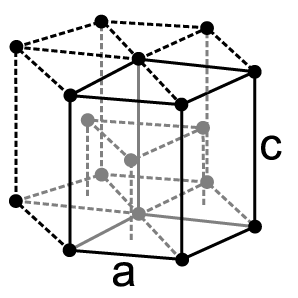
Physikalische Eigenschaften
Da das Isotop 147Pm künstlich als Spaltprodukt in wägbaren Mengen gewonnen werden kann, ist es möglich, die Eigenschaften recht gut zu untersuchen. Promethium ist ein silberweißes duktiles Schwermetall. Es besitzt einen Schmelzpunkt von 1080 °C[4]; für den Siedepunkt gibt es Schätzwerte von 2727 und 3000 °C.[5] Unter Standardbedingungen kristallisiert Promethium in einer hexagonal-dichtesten Kugelpackung mit den Gitterparametern a = 365 pm und c = 1165 pm mit einer berechneten Dichte von 7,26 g/cm3.[32]
Chemische Eigenschaften
Das Metall wird an der Luft recht rasch oxidiert und reagiert langsam mit Wasser. Promethium kommt in seinen Verbindungen ausschließlich in der Oxidationsstufe +3 vor ([Xe] 4f4). Es gibt dabei die beiden 6s-Elektronen und ein 4f-Elektron ab. Die Lösungen sind violettstichig rosa gefärbt. Es bildet unter anderem ein schwerlösliches Fluorid, Oxalat und Carbonat.
Isotope
Das stabilste Isotop ist 145Pm mit einer Halbwertszeit von 17,7 Jahren, es folgt 146Pm mit einer Halbwertszeit von 5,53 Jahren und 147Pm mit 2,6234 Jahren. Letzteres wird zumeist zur Untersuchung verwendet, da es in genügenden Mengen als Spaltprodukt entsteht.
Verwendung
Aufgrund der kurzlebigen Isotope und der sehr geringen Verfügbarkeit findet dieses Element nur in kleinsten Mengen technische Verwendung. Die wichtigste Anwendung ist die als Betastrahler. Promethium wird in Radionuklidbatterien genutzt, die in der Raumfahrt etwa als Wärme- und Energiequelle in Satelliten eingesetzt werden. Das Element ist eine mögliche mobile Quelle für Röntgenstrahlung, die zur radiometrischen Dickenmessung verwendet wird.[33][34]
Das Nuklid 147Pm dient außer als Betastrahlenquelle auch als Zusatz für Leuchtfarbe, die in Leuchtziffern von Uhren eingesetzt wird.[33]
Das Licht von Lasern, die mit Promethium dotiert sind, durchdringt Wasser. Es kann daher für die Kommunikation von Satelliten mit U-Booten verwendet werden.[35]
Verbindungen
→ Kategorie: Promethiumverbindung
Oxide
Promethium(III)-oxid (Pm2O3) besitzt drei verschiedene Modifikationen: eine hexagonale A-Form (violettbraun), eine monokline B-Form (violettrosa) und eine kubische C-Form (korallenrot). Der Schmelzpunkt beträgt 2130 °C.[36][37]
Halogenide
Sämtliche Halogenide von Fluor bis Iod sind für die Oxidationsstufe +3 bekannt.
Promethium(III)-fluorid (PmF3) ist in Wasser schwerlöslich; man erhält es aus einer salpetersauren Pm3+-Lösung durch Zugabe von HF-Lösung, der Niederschlag besitzt eine blassrosa Farbe.[38] Kristallines wasserfreies Promethium(III)-fluorid ist ein violettrosafarbenes Salz[39] mit einem Schmelzpunkt von 1338 °C[40].
Promethium(III)-chlorid (PmCl3) ist violett und hat einen Schmelzpunkt von 655 °C.[40] Wird PmCl3 in Gegenwart von H2O erhitzt, so erhält man das blassrosa gefärbte Promethium(III)-oxichlorid (PmOCl).[41][42]
Promethium(III)-bromid (PmBr3) entsteht aus Pm2O3 durch Erhitzen im trockenen HBr-Strom.[43][44] Es ist rot und hat einen Schmelzpunkt von 660 °C.[40]
Promethium(III)-iodid (PmI3) ist nicht aus Pm2O3 durch Reaktion mit HI-H2-Gemischen darstellbar, es bildet sich stattdessen Promethium(III)-oxiiodid (PmOI). Durch Reaktion von Pm2O3 mit geschmolzenem Aluminiumiodid (AlI3) bei 500 °C entsteht das gewünschte Produkt.[45][46] Es ist rot und hat einen Schmelzpunkt von 695 °C.[40]
Weitere Verbindungen
Promethium(III)-hydroxid (Pm(OH)3) erhält man aus einer salzsauren Pm3+-Lösung durch Einleiten von NH3. Seine Farbe ist Violettrosa.[47]
Sicherheitshinweise
Einstufungen nach der Gefahrstoffverordnung liegen nicht vor, weil diese nur die chemische Gefährlichkeit umfassen und eine völlig untergeordnete Rolle gegenüber den auf der Radioaktivität beruhenden Gefahren spielen. Auch Letzteres gilt nur, wenn es sich um eine dafür relevante Stoffmenge handelt.
Einzelnachweise
- ↑ 1,0 1,1 1,2 1,3 Harry H. Binder: Lexikon der chemischen Elemente, S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3, S. 487–491.
- ↑ Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Promethium) entnommen.
- ↑ N. N. Greenwood und A. Earnshaw: Chemie der Elemente. 1. Auflage, VCH, Weinheim 1988, ISBN 3-527-26169-9, S. 1579.
- ↑ 4,0 4,1 Weigel: "Chemie des Promethiums", S. 577.
- ↑ 5,0 5,1 Weigel: "Chemie des Promethiums", S. 578.
- ↑ Dieses Element wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Luigi Rolla, Lorenzo Fernandes: "Über das Element der Atomnummer 61", in: Zeitschrift für anorganische und allgemeine Chemie, 1926, 157 (1), S. 371–381; doi:10.1002/zaac.19261570129.
- ↑ Luigi Rolla: "Florentium or Illinium?", in: Nature, 1927, 119, S. 637–638; doi:10.1038/119637a0.
- ↑ W. A. Noyes: "Florentium or Illinium?", in: Nature, 1927, 120, S. 14; doi:10.1038/120014c0.
- ↑ Luigi Rolla: "Über das Element der Atomnummer 61 (Florentium)", in: Zeitschrift für anorganische und allgemeine Chemie, 1927, 160, S. 190–192; doi:10.1002/zaac.19271600119.
- ↑ Luigi Rolla: "Florentium", in: Zeitschrift für anorganische und allgemeine Chemie, 1927, 163, S. 40–42; doi:10.1002/zaac.19271630104.
- ↑ Luigi Rolla: "Florentium. II", in: Zeitschrift für anorganische und allgemeine Chemie, 1928, 169, S. 319–320; doi:10.1002/zaac.19281690128.
- ↑ J. A. Harris: "The Element of Atomic Number 61; Illinium", in: Nature, 1926, 117, S. 792–793; doi:10.1038/117792a0.
- ↑ Bohuslav Brauner: "The New Element of Atomic Number 61: Illinium", in: Nature, 1926, 118, S. 84–85; doi:10.1038/118084b0.
- ↑ R. J. Meyer: "Über das Element 61 (Illinium)", in: Naturwissenschaften, 1926, 14, S. 771–772; doi:10.1007/BF01490264.
- ↑ Jacob A. Marinsky, Lawrence E. Glendenin, Charles D. Coryell: "The Chemical Identification of Radioisotopes of Neodymium and of Element 61", in: J. Am. Chem. Soc., 1947, 69 (11), S. 2781–2785; doi:10.1021/ja01203a059.
- ↑ Oak Ridge National Laboratory: "Discovery of Promethium", in: ORNL Review, 2003, 36 (1), eingesehen am 17. September 2006.
- ↑ Moses Attrep, Jr., P. K. Kuroda: "Promethium in Pitchblende", in: Journal of Inorganic and Nuclear Chemistry, 1968, 30 (3), S. 699–703; doi:10.1016/0022-1902(68)80427-0.
- ↑ P. Belli, R. Bernabei, F. Cappella, R. Cerulli, C. J. Dai, F. A. Danevich, A. d’Angelo, A. Incicchitti, V. V. Kobychev, S. S. Nagorny, S. Nisi, F. Nozzoli, D. Prosperi, V. I. Tretyak, S. S. Yurchenko: "Search for α Decay of Natural Europium", in: Nuclear Physics A, 2007, 789, S. 15–29; doi:10.1016/j.nuclphysa.2007.03.001.
- ↑ Anonymous: "Michigan astronomers discover promethium in star", in: Eos Trans. AGU, 1971, 52 (1), S. 10; Abstract; doi:10.1029/EO052i001p00010-01.
- ↑ M. F. Aller: "Promethium in the star HR 465", in: Sky & Telescope, 1971, 41, S. 220–222.
- ↑ D. N. Davis: "The Possible Identification of Promethium in S Stars", in: Astrophysical Journal, 1971, 167, S. 327–330; Volltext.
- ↑ S. C. Wolff, N. D. Morrison: "Remarks on the Proposed Identification of Promethium in HR 465", in: Astrophysical Journal, 1972, 175, S. 473–475; Volltext.
- ↑ C. R. Cowley, M. F. Aller: "Comments on the Identification of Promethium in HR 465", in: Astrophysical Journal, 1972, 175, S. 477–480: Volltext.
- ↑ O. Havnes, E. P. J. van den Heuvel, M. F. Aller, C. R. Cowley: "Is there Promethium in HR 465?", in: Astronomy and Astrophysics, 1972, 19, S. 283–286; Volltext.
- ↑ R. Mitalas, J. M. Marlborough: "Some tests and consequences of the identification of promethium in HR 465", in: Astrophysical Journal, 1973, 181, S. 475–480; Volltext.
- ↑ C. R. Cowley, W. P. Bidelman, S. Hubrig, G. Mathys, D. J. Bord: "On the possible presence of promethium in the spectra of HD 101065 (Przybylski's star) and HD 965", in: Astronomy and Astrophysics, 2004, 419, S. 1087–1093; doi:10.1051/0004-6361:20035726.
- ↑ V. Fivet, P. Quinet, É. Biémont, A. Jorissen, A. V. Yushchenko, S. Van Eck: "Transition probabilities in singly ionized promethium and the identification of Pm II lines in Przybylski's star and HR 465", in: Monthly Notices of the Royal Astronomical Society, September 2007, 380 (2), S. 771–780; doi:10.1111/j.1365-2966.2007.12118.x.
- ↑ Chung-Sin Lee: "Chemical Study on the Separation and Purification of Promethium-147", in: Journal of Radioanalytical and Nuclear Chemistry Articles, 1989, 130, S. 21; doi:10.1007/BF02037697.
- ↑ Ion Exchange Purification of Promethium-147 and its Separation from Americium-241, with Diethylenetriaminepenta-acetic acid as the Eluant. Abgerufen am 31. Januar 2011.
- ↑ Fritz Weigel: "Darstellung von metallischem Promethium", in: Angewandte Chemie, 1963, 75 (10), S. 451–451; doi:10.1002/ange.19630751009.
- ↑ P. G. Pallmer, T. D. Chikalla: "The crystal structure of promethium", in: Journal of the Less Common Metals, 1971, 24 (3), S. 233–236; doi:10.1016/0022-5088(71)90101-9.
- ↑ 33,0 33,1 Robert E. Krebs: The history and use of our earth's chemical elements: a reference guide. 2. Auflage. Greenwood Publishing Group, 2006, ISBN 978-0-313-33438-2, S. 286 (eingeschränkte Vorschau in der Google Buchsuche).
- ↑ Thieme Chemistry (Hrsg.): Eintrag zu Promethium im Römpp Online. Version 3.29. Georg Thieme Verlag, Stuttgart 2012, abgerufen am 15. August 2011.
- ↑ Leland Johnson, Daniel Schaffer: Oak Ridge National Laboratory: the first fifty years. Univ. of Tennessee Press, 1994, S. 229 (eingeschränkte Vorschau in der Google Buchsuche).
- ↑ Weigel: "Chemie des Promethiums", S. 591–594.
- ↑ Gmelin, 39 C 1, S. 312–313.
- ↑ Gmelin, 39 C 3, S. 194.
- ↑ Weigel: "Chemie des Promethiums", S. 587–588.
- ↑ 40,0 40,1 40,2 40,3 Arnold F. Holleman, Nils Wiberg: Lehrbuch der Anorganischen Chemie, 102. Auflage, de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1942.
- ↑ Weigel: "Chemie des Promethiums", S. 588–589.
- ↑ Gmelin, 39 C 5, S. 31.
- ↑ Weigel: "Chemie des Promethiums", S. 590.
- ↑ Gmelin, 39 C 6, S. 61–62.
- ↑ Weigel: "Chemie des Promethiums", S. 591.
- ↑ Gmelin, 39 C 6, S. 192.
- ↑ Gmelin, 39 C 2, S. 56–57.
Literatur
- Fritz Weigel: "Chemie des Promethiums", in: Fortschr. Chem. Forsch., 1969, 12 (4), S. 539–621; doi:10.1007/BFb0051097.
- Gmelins Handbuch der anorganischen Chemie, System Nr. 39:
- Teil B 1, S. 1–16, 119, 144–145, 158, 184
- Teil B 2, S. 46, 94–96, 149, 215
- Teil B 3, S. 69, 74–75
- Teil B 5, S. 131–145
- Teil B 6, S. 131–133, 156, 160
- Teil B 7, S. 193
- Teil C 1, S. 312–313
- Teil C 2, S. 56–57, 261
- Teil C 3, S. 194, 257
- Teil C 4 b, S. 181–183
- Teil C 5, S. 31
- Teil C 6, S. 61–62, 192
- Römpp Lexikon Chemie, Band 5, 1996, 10. Auflage, S. 3566–3567.
- CRC Handbook of Chemistry and Physics, 90. Auflage, Taylor & Francis, Boca Raton 2009, ISBN 978-1-4200-9084-0, Section 4, The Elements, p. 4-28.
- Comprehensive Inorganic Chemistry, The Lanthanides, S. 42–44.
- James E. Huheey: Anorganische Chemie, 1. Auflage, de Gruyter, Berlin 1988, ISBN 3-11-008163-6, S. 873–900.
- John Emsley: Nature's building blocks: an A-Z guide to the elements, Oxford University Press, 2001, ISBN 0-19-850340-7, S. 343–346 (eingeschränkte Vorschau in der Google Buchsuche).
Weblinks
- Periodensystem für den Schulgebrauch: Promethium (Namensgebung, Entdeckung)
- Peter van der Krogt: Elementymology & Elements Multidict
- Generalic, Eni. "Promethium." EniG. Periodensystem der Elemente. 31. März 2008. KTF-Split
- www.webelements.com (Promethium)


