Praseodym
| Eigenschaften | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemein | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name, Symbol, Ordnungszahl | Praseodym, Pr, 59 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie | Lanthanoide | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppe, Periode, Block | La, 6, f | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aussehen | silbrig weiß, gelblicher Farbton | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS-Nummer | 7440-10-0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massenanteil an der Erdhülle | 5,2 ppm[1] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomar [2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atommasse | 140,90765 u | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomradius (berechnet) | 185 (247) pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalenter Radius | 203 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronenkonfiguration | [Xe] 4f3 6s2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. Ionisierungsenergie | 527 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. Ionisierungsenergie | 1020 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. Ionisierungsenergie | 2086 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4. Ionisierungsenergie | 3761 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physikalisch [2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aggregatzustand | fest | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristallstruktur | hexagonal | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dichte | 6,475 g/cm3 (25 °C)[3] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetismus | paramagnetisch ( = 2,9 · 10−3)[4] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzpunkt | 1208 K (935 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Siedepunkt | 3403 K[5] (3130 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molares Volumen | 20,80 · 10−6 m3/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Verdampfungswärme | 331 kJ/mol[5] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzwärme | 6,9 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schallgeschwindigkeit | 2280 m/s bei 293,15 K | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektrische Leitfähigkeit | 1,43 · 106 A/(V · m) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Wärmeleitfähigkeit | 13 W/(m · K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemisch [2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidationszustände | 3, 4 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Normalpotential | −2,35 V (Pr3+ + 3 e− → Pr) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativität | 1,13 (Pauling-Skala) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotope | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Weitere Isotope siehe Liste der Isotope | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NMR-Eigenschaften | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Praseodym ist ein chemisches Element mit dem Elementsymbol Pr und der Ordnungszahl 59. Im Periodensystem steht es in der Gruppe der Lanthanoide und zählt damit auch zu den Metallen der seltenen Erden. Von der Grünfärbung seiner Verbindungen kommt auch der Name: das griechische Wort prásinos bedeutet „lauchgrün“, didymos „doppelt“ oder „Zwilling“.
Geschichte

1841 extrahierte Carl Gustav Mosander die seltene Erde Didym aus Lanthanoxid. 1874 bemerkte Per Teodor Cleve, dass es sich bei Didym eigentlich um zwei Elemente handelte. Im Jahr 1879 isolierte Lecoq de Boisbaudran Samarium aus Didym, das er aus dem Mineral Samarskit gewann. 1885 gelang es Carl Auer von Welsbach, Didym in Praseodym und Neodym zu trennen, die beide Salze mit verschiedenen Farben bilden.
Vorkommen
Praseodym kommt als Begleiter in den typischen Seltenen-Erd-Mineralien Cerit, Monazit und Bastnäsit vor. Die weltweiten Reserven werden auf 4 Millionen Tonnen geschätzt.
Gewinnung und Herstellung
Wie bei allen Lanthanoiden werden zuerst die Erze durch Flotation angereichert, danach die Metalle in entsprechende Halogenide umgewandelt und durch fraktionierte Kristallisation, Ionenaustausch oder Extraktion getrennt. Das Metall wird durch Schmelzflusselektrolyse oder Reduktion mit Calcium gewonnen.
Eigenschaften
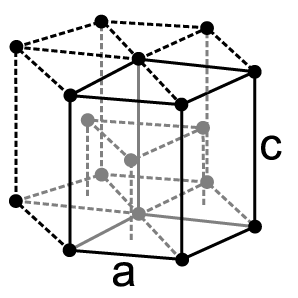
Physikalische Eigenschaften
Praseodym ist ein weiches, silberweißes paramagnetisches Metall, welches zu den Lanthanoiden und Metallen der Seltenen Erden gehört. Es ist in Luft etwas korrosionsbeständiger als Europium, Lanthan oder Cer, bildet aber leicht eine grüne Oxidschicht aus, die an Luft abblättert. Bei 798 °C wandelt sich das hexagonale α-Pr in das kubisch-raumzentrierte β-Pr um.
Chemische Eigenschaften
Praseodym tritt in seinen Verbindungen drei- und vierwertig auf, wobei die dreiwertige Oxidationszahl die häufigere ist. Pr(III)-Ionen sind gelbgrün, Pr(IV)-Ionen farblos. Unter besonderen reduktiven Bedingungen kann auch zweiwertiges Praseodym realisiert werden, z. B. im Pr2I5.
Verwendung
- Praseodym wird in Legierungen mit Magnesium zur Herstellung von hochfestem Metall für Flugzeugmotoren verwendet.
- Legierungen mit Cobalt und Eisen sind starke Dauermagnete.
- Praseodymverbindungen werden zum Färben von Glas und Emaille verwendet (zum Beispiel in grün gefärbten Scheinwerfergläsern in der Beleuchtungstechnik[8]).
- Die Verbindungen verbessern auch die UV-Absorption und werden für Augenschutzgläser beim Schweißen benutzt.
Isotope
Natürliches Praseodym besteht nur aus dem stabilen Isotop 141Pr. 38 weitere radioaktive Isotope sind bekannt, wobei 143Pr und 142Pr mit einer Halbwertszeit von 13,57 Tagen beziehungsweise 19,12 Stunden die langlebigsten sind. Alle anderen Isotope haben Halbwertszeiten von weniger als 6 Stunden, die meisten sogar weniger als 33 Sekunden. Es gibt auch 6 metastabile Zustände, wobei 138mPr (t½ 2,12 Stunden), 142mPr (t½ 14,6 Minuten) und 134mPr (t½ 11 Minuten) die stabilsten sind.
Die Isotope bewegen sich einem Atommassenbereich von 120,955 (121Pr) bis 158,955 (159Pr).
Sicherheitshinweise
Wegen seiner Luftempfindlichkeit sollte Praseodym unter Benzin oder in Kunststoff oder Glas versiegelt aufbewahrt werden.
Eine biologische Bedeutung ist nicht bekannt, Praseodymverbindungen sollen aber leicht leberschädigend wirken. Es gibt allerdings keine Toxizitätswerte.
Verbindungen
Bekannt sind von allen Oxidationsstufen mehrere Halogenide beispielsweise PrF3, PrF4, PrCl3, PrBr3, PrI3, Pr2I5. Die dreiwertigen Halogenide bilden verschiedene Hydrate.
Es gibt auch diverse Verbindungen mit Chalkogenen: das normale braun-schwarze Praseodym(III,IV)-oxid Pr6O11, das fast schwarze PrO2, das grüne Pr2O3, Pr2S3, Pr2Te3 und andere binäre Verbindungen wie PrN, PrP. Daneben ist Praseodym in diversen Salzen, wie dem hygroskopischem Praseodym(III)-nitrat Pr(NO3)3 · x H2O, dem schön kristallisierenden Praseodym(III)-sulfat Pr2(SO4)3 · 8 H2O und anderen vertreten.
Außerdem bildet es mehrere Fluoridokomplexe wie z. B. das K2[PrF6] mit vierwertigem Pr.
-
Praseodym(III)-sulfat Oktahydrat
-
Praseodym(III)-chlorid Heptahydrat
Einzelnachweise
- ↑ Harry H. Binder: Lexikon der chemischen Elemente, S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3.
- ↑ Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Praseodym) entnommen.
- ↑ N. N. Greenwood und A. Earnshaw: Chemie der Elemente, 1. Auflage, VCH, Weinheim 1988, ISBN 3-527-26169-9, S. 1579.
- ↑ Weast, Robert C. (ed. in chief): CRC Handbook of Chemistry and Physics. CRC (Chemical Rubber Publishing Company), Boca Raton 1990. Seiten E-129 bis E-145. ISBN 0-8493-0470-9. Werte dort sind auf g/mol bezogen und in cgs-Einheiten angegeben. Der hier angegebene Wert ist der daraus berechnete maßeinheitslose SI-Wert.
- ↑ 5,0 5,1 Yiming Zhang, Julian R. G. Evans, Shoufeng Yang: Corrected Values for Boiling Points and Enthalpies of Vaporization of Elements in Handbooks. In: Journal of Chemical & Engineering Data. 56, 2011, S. 328–337, doi:10.1021/je1011086.
- ↑ 6,0 6,1 6,2 Datenblatt Praseodymium bei Sigma-Aldrich, abgerufen am 21. April 2011.
- ↑ Seit 1. Dezember 2012 ist für Stoffe ausschließlich die GHS-Gefahrstoffkennzeichnung zulässig. Bis zum 1. Juni 2015 dürfen noch die R-Sätze dieses Stoffes für die Einstufung von Zubereitungen herangezogen werden, anschließend ist die EU-Gefahrstoffkennzeichnung von rein historischem Interesse.
- ↑ "Special Effects – The History and Technique" von Richard Rickitt - Billboard Books, 2000, ISBN 0-8230-7733-0.

