Strontium
| Eigenschaften | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemein | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name, Symbol, Ordnungszahl | Strontium, Sr, 38 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie | Erdalkalimetalle | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppe, Periode, Block | 2, 5, s | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aussehen | silbrig weiß metallisch | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS-Nummer | 7440-24-6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massenanteil an der Erdhülle | 0,014 %[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomar [2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atommasse | 87,62 u | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomradius (berechnet) | 200 (219) pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalenter Radius | 195 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van-der-Waals-Radius | 249[3] pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronenkonfiguration | [Kr] 5s2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Austrittsarbeit | 2,59 eV[4] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. Ionisierungsenergie | 549,5 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. Ionisierungsenergie | 1064,2 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physikalisch [2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aggregatzustand | fest | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristallstruktur | kubisch flächenzentriert | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dichte | 2,63 g/cm3 (20 °C)[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohshärte | 1,5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetismus | paramagnetisch ( = 3,5 · 10−5)[6] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzpunkt | 1050 K (777 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Siedepunkt | 1653 K[7] (1380 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molares Volumen | 33,94 · 10−6 m3/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Verdampfungswärme | 141 kJ/mol[7] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzwärme | 8 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektrische Leitfähigkeit | 7,41 · 106 A/(V · m) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Wärmeleitfähigkeit | 35 W/(m · K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemisch [2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidationszustände | +2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxide (Basizität) | SrO (stark basisch) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Normalpotential | −2,89 V (Sr2+ + 2 e− → Sr) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativität | 0,95 (Pauling-Skala) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotope | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Weitere Isotope siehe Liste der Isotope | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NMR-Eigenschaften | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Strontium ist ein chemisches Element mit dem Elementsymbol Sr und der Ordnungszahl 38. Im Periodensystem steht es in der 5. Periode sowie der 2. Hauptgruppe und gehört damit zu den Erdalkalimetallen. Es ist ein weiches (Mohshärte: 1,5) und sehr reaktionsfreudiges Metall.
Das Element wurde 1790 von Adair Crawford entdeckt und nach seinem ersten Fundort Strontian in Schottland benannt. Elementar, allerdings noch durch Fremdbeimengungen verunreinigt, konnte es 1808 mittels Elektrolyse durch Humphry Davy dargestellt werden. Robert Bunsen gelang 1855 auch die Darstellung reinen Strontiums. Das Element wird nur in geringen Mengen, vor allem für Kathodenstrahlröhren, Pyrotechnik (rote Flammenfarbe), Dauermagnete und in der Aluminiumverhüttung verwendet.
Strontium kommt in geringen Mengen im menschlichen Körper vor, hat jedoch keine bekannte biologische Bedeutung und ist nicht essentiell. Eine medizinische Wirkung von Strontiumsalzen, insbesondere Strontiumranelat gegen Osteoporose, wird untersucht.
Geschichte

Erste Hinweise auf die Existenz des Elements fanden Adair Crawford und William Cruickshank im Jahr 1790, als sie ein aus Strontian in Schottland stammendes Mineral, das zunächst für „lufthaltigen Baryt“ (Bariumcarbonat, Witherit) gehalten wurde, genauer untersuchten. Sie stellten das Chlorid her und verglichen mehrere Eigenschaften des späteren Strontiumchlorides mit denen des Bariumchlorides. Dabei stellten sie unter anderem verschiedene Löslichkeiten in Wasser und andere Kristallformen fest. 1791 benannte Friedrich Gabriel Sulzer (1749-1830)[10] das Mineral nach seinem Fundort Strontian Strontianit. Er und Johann Friedrich Blumenbach untersuchten das Mineral genauer und fanden so weitere Unterschiede zum Witherit, wie die unterschiedliche Giftigkeit und Flammenfarbe.[11] In den folgenden Jahren wurden durch Chemiker wie Martin Heinrich Klaproth, Richard Kirwan, Thomas Charles Hope oder Johann Tobias Lowitz das Strontianit weiter untersucht und andere Strontiumverbindungen daraus gewonnen.[12]
1808 gelang Humphry Davy durch elektrolytische Reduktion in Anwesenheit von rotem Quecksilberoxid die Darstellung von Strontiumamalgam, das er anschließend durch Destillation reinigte und so das – wenn auch noch verunreinigte – Metall erhielt.[13] Er benannte es nach dem Strontianit analog zu den anderen Erdalkalimetallen Strontium. Reines Strontium gewann Robert Bunsen 1855 durch Elektrolyse einer Strontiumchloridschmelze. Er bestimmte auch Eigenschaften des Metalls wie etwa die spezifische Dichte des Elements.[14]
Vorkommen

Strontium ist mit einem Anteil von 370 ppm an der kontinentalen Erdkruste[15] auf der Erde verhältnismäßig häufig, die Elementhäufigkeit in der Erdkruste ist vergleichbar mit der von Barium, Schwefel oder Kohlenstoff. Auch im Meerwasser ist eine größere Menge Strontium vorhanden. Das Element kommt nicht gediegen, sondern stets in verschiedenen Verbindungen vor. Entsprechend der geringen Löslichkeiten sind die wichtigsten Strontiumminerale das Strontiumsulfat oder Coelestin mit einem Strontiumgehalt von bis zu 47,7 %[16] sowie das Strontiumcarbonat oder Strontianit mit einem Strontiumgehalt von bis zu 59,4 %[16]. Insgesamt sind bisher (Stand: 2011) rund 200 strontiumhaltige Minerale bekannt[17].
Die Lagerstätten des wichtigsten Strontiumminerals, Coelestin, entstanden durch Fällung des schwerlöslichen Strontiumsulfats aus Meerwasser. Auch eine hydrothermale Bildung des Minerals ist möglich. Strontianit bildet sich ebenfalls hydrothermal oder als Sekundärmineral aus Coelestin. Die wichtigsten Strontiumlagerstätten und Abbauorte liegen in Spanien, Mexiko, der Türkei, China und im Iran. Großbritannien war ebenfalls über lange Zeit ein wichtiger Förderstaat, die Produktion endete jedoch 1992.[18] Dabei betrug die Förderung an Strontiummineralen im Jahr 2008 weltweit 496.000 Tonnen.[19]
Gewinnung und Darstellung

Ausgangsmaterial für die Herstellung von Strontium und Strontiumverbindungen ist meist Coelestin (Strontiumsulfat). Aus diesem wird in der Regel zunächst Strontiumcarbonat gewonnen. Dieses ist die industriell wichtigste Strontiumverbindung und Grundstoff für die Gewinnung des Metalls und anderer Verbindungen.
Um Strontiumcarbonat herzustellen, wird zunächst Strontiumsulfat mit Kohlenstoff bei 1100–1200 °C umgesetzt. Dabei wird das Sulfat zum Sulfid reduziert und es entstehen Strontiumsulfid und Kohlenstoffdioxid. Das Strontiumsulfid wird durch Extraktion mit heißem Wasser gereinigt.[18]
Anschließend wird entweder Kohlenstoffdioxid durch die Strontiumsulfidlösung geleitet oder das Strontiumsulfid wird mit Natriumcarbonat umgesetzt. Dabei entstehen neben Strontiumcarbonat Schwefelwasserstoff beziehungsweise Natriumsulfid. Welche der beiden Varianten genutzt wird, hängt von der Verfügbarkeit der Ausgangsstoffe und der Möglichkeit, die Beiprodukte zu verkaufen, ab.[18]
Feingemahlenes Strontiumsulfat kann auch direkt mit Natrium- oder Ammoniumcarbonat zu Strontiumcarbonat umgesetzt werden. Dabei sind jedoch aufwändige Reinigungsschritte notwendig.
Um Strontiummetall zu erhalten, wird Strontiumoxid mit Aluminium reduziert (Aluminothermie). Dabei entsteht neben elementarem Strontium eine Mischung aus Aluminium- und Strontiumoxid. Die Reaktion findet im Vakuum statt, da unter diesen Bedingungen das Strontium gasförmig vorliegt, einfach abgetrennt und in einem Kühler aufgefangen werden kann.[18]
Eigenschaften
Physikalische Eigenschaften
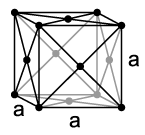
Strontium ist ein im höchstreinen Zustand hellgoldgelb-glänzendes[20], sonst silberweißes Erdalkalimetall. Mit einem Schmelzpunkt von 777 °C und einem Siedepunkt von 1380 °C steht es beim Siedepunkt zwischen dem leichteren Calcium und dem schwereren Barium, wobei Calcium einen höheren und Barium einen niedrigeren Schmelzpunkt besitzt. Strontium besitzt nach Magnesium und Radium den niedrigsten Siedepunkt aller Erdalkalimetalle. Mit einer Dichte von 2,6 g/cm3 zählt es zu den Leichtmetallen. Strontium ist mit einer Mohshärte von 1,5[21] sehr weich und lässt sich leicht biegen oder walzen.
Wie Calcium kristallisiert Strontium bei Raumtemperatur in einer kubisch-flächenzentrierten Kristallstruktur in der Raumgruppe (Kupfer-Typ) mit dem Gitterparameter a = 608,5 pm sowie vier Formeleinheiten pro Elementarzelle. Daneben sind auch zwei weitere Hochtemperaturmodifikationen bekannt. Bei Temperaturen von größer 215 °C wandelt sich die Struktur in eine hexagonal-dichteste Kugelpackung (Magnesium-Typ) mit den Gitterparametern a = 432 pm und c = 706 pm um. Oberhalb von 605 °C ist schließlich eine kubisch-innenzentrierte Struktur (Wolfram-Typ) am stabilsten.[22]
Chemische Eigenschaften
Strontium ist nach Barium und Radium das reaktivste Erdalkalimetall. Es reagiert direkt mit Halogenen, Sauerstoff, Stickstoff und Schwefel. Dabei bildet es immer Verbindungen, in denen es als zweiwertiges Kation vorliegt. Beim Erhitzen an der Luft verbrennt das Metall mit der typischen karminroten Flammenfärbung zu Strontiumoxid und Strontiumnitrid.
Als sehr unedles Metall reagiert Strontium mit Wasser unter Wasserstoff- und Hydroxidbildung. Strontiumhydroxid bildet sich auch schon beim Kontakt des Metalls mit feuchter Luft. Auch in Ammoniak ist Strontium löslich, dabei bilden sich blauschwarze Ammoniakate.
Isotope
Es sind insgesamt 32 Isotope und weitere sieben Kernisomere bekannt. Von diesen kommen vier, 84Sr, 86Sr, 87Sr und 88Sr, natürlich vor. In der natürlichen Isotopenzusammensetzung überwiegt dabei das Isotop 88Sr mit einem Anteil von 82,58 %. 86Sr mit 9,86 % und 87Sr mit 7,0 %, sowie 84Sr mit einem Anteil von 0,56 % sind seltener.[23]
90Sr ist ein Betastrahler mit einer Zerfallsenergie von 0,546 MeV und zerfällt mit einer Halbwertzeit von 28,78 Jahren zu 90Y, das seinerseits rasch (t1/2 = 64,1 h) unter Aussendung von energiereicher Betastrahlung (ZE = 2,282 MeV) und von Gammastrahlung zum stabilen 90Zr zerfällt. Dabei tritt es zumeist als sekundäres Spaltprodukt auf. Es entsteht innerhalb weniger Minuten durch mehrfachen Betazerfall aus primären Spaltprodukten der Massenzahl 90, die bei 5,7 %[24] aller Kernspaltungen von 235U in Kernkraftwerken und Atombombenexplosionen auftreten. Damit ist 90Sr eines der häufigsten Spaltprodukte überhaupt.[21]
Größere Mengen 90Sr gelangen bei allen nuklearen Katastrophen in die Umwelt. Unfälle, bei denen 90Sr in die Umwelt gelangte, waren der Windscale-Brand, bei dem 0,07 TBq 90Sr freigesetzt wurden[25] und die Katastrophe von Tschernobyl, bei der die freigesetzte Aktivität an 90Sr 800 TBq betrug.[26] Nach den oberirdischen Kernwaffentests vor allem in den Jahren 1955–58 und 1961–63 stieg die Belastung der Atmosphäre mit 90Sr stark an. Dies führte zusammen mit der Belastung an 137Cs 1963 zur Verabschiedung des Vertrages über das Verbot von Kernwaffenversuchen in der Atmosphäre, im Weltraum und unter Wasser, der solche Tests in den Unterzeichnerstaaten verbot. Daraufhin sank in den folgenden Jahren die Belastung der Atmosphäre wieder deutlich.[27] Die gesamte, durch Kernwaffen freigesetzte Aktivität an 90Sr betrug etwa 6 · 1017 Bq (600 PBq).[21]
Die Aufnahme von 90Sr, das etwa über belastete Milch in den Körper gelangen kann, ist gefährlich. Durch die energiereiche Betastrahlung des Isotops können Zellen in Knochen oder Knochenmark verändert und somit Knochentumore oder Leukämien ausgelöst werden. Eine Dekorporation des in die Knochen aufgenommenen Strontiums mit Chelatbildnern ist unmöglich, da diese bevorzugt Calcium komplexieren und das Strontium im Knochen verbleibt.[21] Eine Dekorporation mit Bariumsulfat ist nur möglich, wenn sie rasch nach der Inkorporation erfolgt, bevor der Einbau in Knochen erfolgen kann.[28]Auch der Abbau durch biologische Vorgänge verläuft nur sehr langsam, die biologische Halbwertszeit liegt in Knochen bei 49 Jahren, die effektive Halbwertszeit von 90Sr bei 18,1 Jahren.[29] Möglicherweise bindet 90Sr an Zellen der Nebenschilddrüsen. Dies würde die Häufung von Fällen eines Hyperparathyreoidismus bei Liquidatoren des Reaktors in Tschernobyl erklären.[30].
Die Betastrahlung von 90Sr und 90Y kann in Radionuklidbatterien, etwa für abgelegene Leuchttürme und Funkfeuer in der ehemaligen Sowjetunion,[31] zur langlebigen Isotopenmarkierung, zur Dickenmessung von Materialien oder zum Kalibrieren von Geigerzählern genutzt werden.[21]
87Sr ist das Zerfallsprodukt des mit einer Halbwertszeit von 48 Milliarden Jahren sehr langlebigen Rubidiumisotops 87Rb. Aus dem Verhältnis der verschiedenen Strontiumisotope kann im Rahmen einer Strontiumisotopenanalyse daher das Alter von rubidium- und strontiumhaltigen Gesteinen wie Granit bestimmt werden.[32]
Strontium wird unter verschiedenen Bedingungen in unterschiedlichen Mengen in Knochen und Zähnen eingelagert. Gleichzeitig hängt das Isotopenverhältnis von 86Sr und 87Sr von den Gesteinen der Umgebung ab. Daher kann man aus den Isotopenverhältnissen des Strontiums mitunter Rückschlüsse auf Wanderungsbewegungen von prähistorischen Menschen ziehen.[33]
Der kleine deutsche Kugelhaufenreaktor namens AVR neben dem Gelände des Forschungszentrums in Jülich gilt nach Angabe des Betreibers als die am stärksten mit 90Sr kontaminierte Nuklearanlage weltweit.[34] Auch im Boden unter dem Reaktor befindet sich Strontium.[35] Dieses soll beim Rückbau des Reaktors bis 2017 aufwändig entfernt werden.
Verwendung

Strontium wird nur in geringen Mengen produziert und verwendet. Der größte Teil des produzierten Strontiumcarbonats wird für Kathodenstrahlröhren, Dauermagnete sowie die Pyrotechnik verwendet.[19]
Metallisches Strontium wird vor allem in der Aluminiumindustrie (Aluminiumprimär- und Sekundärhütten, sowie Gießereien) ebenso wie Natrium als gefügebeeinflussendes Mittel bei Aluminium-Siliciumlegierungen mit 7–12 % Silicium eingesetzt. Geringe Beimengungen an Strontium verändern das Eutektikum in Silicium-Aluminium-Legierungen und verbessern so die mechanischen Eigenschaften der Legierung. Dies liegt daran, dass Aluminium-Silicium-Legierungen ohne Strontium am Eutektikum grobe, nadelförmige, mechanisch wenig belastbare Körner ausfallen, was durch das Strontium verhindert wird.[18] Seine „veredelnde“ Wirkung hält in gießbereiten Schmelzen (Gieß- und Warmhalteöfen) länger an, als die des Natriums, da es weniger leicht oxidierbar ist. Auf dem Gebiet langsam erstarrender Schmelzen (Sandguss) hat es das Jahrzehnte allein gebräuchliche Natrium teilweise bereits verdrängt. Bei rascher Erstarrung in metallischer Dauerform, insbesondere bei Druckguss ist die Anwendung von Strontium nicht in jedem Fall zwingend, die Ausbildung des erwünschten feinen, „veredelten“ Gefüges wird bereits durch die rasche Erstarrung begünstigt.[36]
Strontium wird Ferrosilicium zugesetzt, es reguliert die Struktur des Kohlenstoffs und verhindert beim Gießen ein ungleichmäßiges Erstarren.[18]
Weiterhin kann Strontium als Gettermaterial in Elektronenröhren, zum Entfernen von Schwefel und Phosphor aus Stahl sowie zum Härten von Akku-Platten aus Blei genutzt werden.[21]
Biologische Bedeutung
Nur wenige Lebewesen nutzen Strontium in biologischen Prozessen. Hierzu zählen Acantharia, einzellige eukaryontische Lebewesen, die zu den Strahlentierchen gehören und ein häufiger Bestandteil des Zooplanktons im Meer sind. Diese nutzen als einzige Protisten Strontiumsulfat als Baumaterial für das Skelett. Dadurch bewirken sie auch Veränderungen des Strontiumgehaltes in einzelnen Meeresschichten, indem sie zunächst Strontium aufnehmen und nach dem Absterben in tiefere Schichten sinken, wo sie sich auflösen.[37][38]
Physiologische und therapeutische Bedeutung
Strontium hat in seinen Eigenschaften große Ähnlichkeit mit Calcium. Jedoch wird es im Gegensatz zu Calcium nur in geringen Mengen über den Darm aufgenommen. Verantwortlich hierfür ist möglicherweise der größere Ionenradius des Elementes. Der Gehalt an Strontium beträgt durchschnittlich bei einem 70 Kilogramm schweren Mann nur 0,32 g, im Vergleich dazu enthält der Körper etwa 1000 g Calcium. Das aufgenommene Strontium wird vor allem in den Knochen gespeichert.[39]
Strontium ist nicht essentiell, es sind nur wenige biologische Wirkungen des Elementes bekannt. So ist es möglich, dass Strontium hemmend gegenüber Karies wirkt.[40]
Da Strontium wie Calcium als Bestandteil der Knochen eingebaut werden kann, wird es zur Behandlung der Osteoporose verwendet. Durch Salzbildung mit organischen Säuren wie Ranelicsäure oder Malonsäure wird eine entsprechende Bioverfügbarkeit erreicht. Eine Klinische Studie belegt eine deutliche Erhöhung der Knochendichte und eine deutliche Verringerung des Risikos für Knochenbrüche bei Frauen mit Osteoporose unter der Behandlung mit Strontiumranelat.[41]
89Sr wird als Chlorid (unter dem Handelsnamen „Metastron“) zur Behandlung von durch Knochenmetastasen hervorgerufenen Schmerzen – vor allem bei Prostata- und Mammakarzinomen – verwendet. Die empfohlene Standarddosis beträgt 150 MBq.[42] Zudem existieren vereinzelt Berichte über eine Reduktion von Metastasen unter dieser Behandlung; diese umfassen jedoch eine zu geringe Zahl von Fällen, um daraus eine allgemeine Behandlungsempfehlung ableiten zu können.
Toxische Effekte des Strontiums sind beim Menschen nicht bekannt. Im Tierversuch bei Schweinen zeigten sich durch eine strontiumreiche und calciumarme Ernährung Symptome wie Koordinationsstörungen, Schwachheit und Lähmungserscheinungen.[43]
Sicherheitshinweise
Wie andere Erdalkalimetalle ist Strontium brennbar. Es reagiert mit Wasser oder Kohlenstoffdioxid, so dass diese nicht als Löschmittel verwendet werden können. Zum Löschen sollten Metallbrandlöscher (Klasse D) verwendet werden, zudem ist die Verwendung von trockenem Sand, Salz und Löschpulver möglich. Weiterhin bildet sich bei Kontakt mit Wasser Wasserstoff, der explosionsgefährlich ist. Für die Beseitigung kleiner Mengen kann Strontium mit Isopropanol, tert-Butanol oder Octanol umgesetzt werden.[44]
Verbindungen
Wie alle Erdalkalimetalle kommt Strontium in Verbindungen ausschließlich in der Oxidationsstufe +2 vor. Es handelt sich in der Regel um farblose, häufig gut wasserlösliche Salze.
Halogenide
Mit den Halogenen Fluor, Chlor, Brom und Iod bildet Strontium jeweils ein Halogenid mit der allgemeinen Formel SrX2. Es sind typische, farblose und bis auf Strontiumfluorid gut wasserlösliche Salze. Sie können durch Umsetzung von Strontiumcarbonat mit Halogenwasserstoffsäuren wie Flusssäure oder Salzsäure dargestellt werden. Verwendung findet unter anderen Strontiumchlorid als Zwischenprodukt für die Herstellung anderer Strontiumverbindungen sowie in Zahnpasta, wo es gegen schmerzempfindliche Zähne wirken soll.[45]
Salze von Sauerstoffsäuren
Industriell wichtig sind vor allem die Strontiumsalze von Sauerstoffsäuren wie Strontiumcarbonat, Strontiumnitrat, Strontiumsulfat oder Strontiumchromat. Strontiumcarbonat ist die wichtigste Handelsform von Strontiumverbindungen, der Großteil des abgebauten Coelestins wird zu Strontiumcarbonat umgesetzt. Verwendet wird es vor allem zur Herstellung von röntgenabsorbierendem Glas für Kathodenstrahlröhren, aber auch für die Herstellung von Strontiumferrit für Permanentmagnete oder Elektrokeramiken. Strontiumnitrat wird vorwiegend in der Pyrotechnik für die Strontium-typische rote Flammenfärbung eingesetzt, das gelbe Strontiumchromat dient als Grundierung gegen Korrosion von Aluminium im Flugzeug- oder Schiffbau.[18]
Weitere Strontiumverbindungen
Organische Strontiumverbindungen sind nur in geringem Maße bekannt und untersucht, da sie sehr reaktiv sind und auch mit vielen Lösungsmitteln wie Ethern reagieren können. In unpolaren Lösungsmitteln sind sie dagegen unlöslich. Dargestellt wurde unter anderem ein Metallocen mit Pentamethylcyclopentadienyl-Anionen (Cp*), das in der Gasphase im Gegensatz zu anderen Metallocenen wie Ferrocen gewinkelt ist.[46]
Eine Übersicht über Strontiumverbindungen gibt die Kategorie:Strontiumverbindung
Einzelnachweise
- ↑ Harry H. Binder: Lexikon der chemischen Elemente, S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3.
- ↑ Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Strontium) entnommen.
- ↑ Manjeera Mantina, Adam C. Chamberlin, Rosendo Valero, Christopher J. Cramer, Donald G. Truhlar: Consistent van der Waals Radii for the Whole Main Group. In: J. Phys. Chem. A. 2009, 113, S. 5806–5812, doi:10.1021/jp8111556.
- ↑ Ludwig Bergmann, Clemens Schaefer, Rainer Kassing: Lehrbuch der Experimentalphysik, Band 6: Festkörper. 2. Auflage, Walter de Gruyter, 2005, ISBN 978-3-11-017485-4, S. 361.
- ↑ N. N. Greenwood und A. Earnshaw: Chemie der Elemente, 1. Auflage, VCH, Weinheim 1988, ISBN 3-527-26169-9, S. 136.
- ↑ Weast, Robert C. (ed. in chief): CRC Handbook of Chemistry and Physics. CRC (Chemical Rubber Publishing Company), Boca Raton 1990. Seiten E-129 bis E-145. ISBN 0-8493-0470-9. Werte dort sind auf g/mol bezogen und in cgs-Einheiten angegeben. Der hier angegebene Wert ist der daraus berechnete maßeinheitslose SI-Wert.
- ↑ 7,0 7,1 Yiming Zhang, Julian R. G. Evans, Shoufeng Yang: Corrected Values for Boiling Points and Enthalpies of Vaporization of Elements in Handbooks. In: Journal of Chemical & Engineering Data. 56, 2011, S. 328–337, doi:10.1021/je1011086.
- ↑ 8,0 8,1 8,2 Datenblatt Strontium bei AlfaAesar, abgerufen am 7. Februar 2010 (JavaScript erforderlich).
- ↑ Seit 1. Dezember 2012 ist für Stoffe ausschließlich die GHS-Gefahrstoffkennzeichnung zulässig. Bis zum 1. Juni 2015 dürfen noch die R-Sätze dieses Stoffes für die Einstufung von Zubereitungen herangezogen werden, anschließend ist die EU-Gefahrstoffkennzeichnung von rein historischem Interesse.
- ↑ Hans Lüschen: Die Namen der Steine. Das Mineralreich im Spiegel der Sprache. Ott Verlag, Thun und München 1968, S. 329,381.
- ↑ J. F. Blumenbach: Ueber den Strontianit, ein Schottisches Fossil, das ebenfalls eine neue Grunderde zu enthalten scheint; und über einige andere naturhistorische Merkwürdigkeiten. Aus einem Briefe des Hrn. Rath Sulzer zu Ronneburg mitgetheilt von J. F. Blumenbach. In: Johann Heinrich Voigt (Ed.), Magazin für das Neueste aus der Physik und Naturgeschichte. 1891, 8, 3, S. 68–72 (Volltext).
- ↑ J. R. Partington: The early history of strontium. In: Annals of Science. 1942, 5, 2, S. 157–166, doi:10.1080/00033794200201411.
- ↑ Humphry Davy: Electro-Chemical Researches, on the Decomposition of the Earths; With Observations on theMetals Obtained from the Alkaline Earths, and on the Amalgam Procured from Ammonia. In: Philosophical Transactions of the Royal Society of London. 1808, 98, S. 333–337 (Abstract).
- ↑ Robert Bunsen: Darstellung des Lithiums. In: Justus Liebigs Annalen der Chemie. 1855, 94, 1, S. 107–111, doi:10.1002/jlac.18550940112.
- ↑ David R. Lide (ed.): CRC Handbook of Chemistry and Physics, 90. Auflage, CRC Press, Boca Raton, Florida, 2009. Section 14, Geophysics, Astronomy, and Acoustics; Abundance of Elements in the Earth's Crust and in the Sea.
- ↑ 16,0 16,1 Webmineral – Celestine
- ↑ Webmineral – Mineral Species sorted by the element Sr (Strontium)
- ↑ 18,0 18,1 18,2 18,3 18,4 18,5 18,6 J. Paul MacMillan, Jai Won Park, Rolf Gerstenberg, Heinz Wagner, Karl Köhler, Peter Wallbrecht: Strontium and Strontium Compounds. In: Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim 2005, doi:10.1002/14356007.a25_321.
- ↑ 19,0 19,1 Marc A. Angulo: Strontium. U.S. Geological Survey, Mineral Commodity Summaries, Januar 2010.
- ↑ Arnold F. Holleman, Nils Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage, de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1238.
- ↑ 21,0 21,1 21,2 21,3 21,4 21,5 Helmut Sitzmann: Strontium. Thieme Chemistry (Hrsg.): RÖMPP Online – Version 3.13. Georg Thieme Verlag KG, Stuttgart 2011.
- ↑ K. Schubert: Ein Modell für die Kristallstrukturen der chemischen Elemente. In: Acta Crystallographica. 1974, B30, S. 193.
- ↑ G. Audi, O. Bersillon, J. Blachot, A. H. Wapstra: The NUBASE evaluation of nuclear and decay properties. In: Nuclear Physics. 2003, Bd. A 729, S. 3–128.
- ↑ Martin Volkmer: Basiswissen Kernenergie. Informationskreis Kernenergie, Bonn 1996, ISBN 3-925986-09-X, S. 30.
- ↑ Windscale-Kernreaktorunfall. In: Römpp Chemie-Lexikon. Thieme Verlag, Stand März 2002.
- ↑ Tschernobyl-Kernreaktorunfall. In: Römpp Chemie-Lexikon. Thieme Verlag, Stand März 2002.
- ↑ Jozef Goldblat, David Cox: Nuclear weapon tests: prohibition or limitation? Stockholm International Peace Research Institute, Oxford University Press, 1988, ISBN 978-0-19-829120-6, S. 83–85 (eingeschränkte Vorschau in der Google Buchsuche).
- ↑ E. Nürnberg, Peter Surmann: Hagers Handbuch der Pharmazeutischen Praxis Series, Band 2. 5. Auflage, Birkhäuser, 1991, ISBN 3-540-52688-9, S. 342.
- ↑ Johannes Friedrich Diehl: Radioaktivität in Lebensmitteln. Wiley-VCH, 2003, ISBN 978-3-527-30722-7, S. 24 (eingeschränkte Vorschau in der Google Buchsuche).
- ↑ Bernhard O. Boehm, Rosinger, Silke, Belyi, David, Dietrich, Johannes W.: The Parathyroid as a Target for Radiation Damage. In: New England Journal of Medicine. 365, Nr. 7, August 2011, S. 676–678. doi:10.1056/NEJMc1104982. PMID 21848480. Abgerufen am 19. August 2011.
- ↑ Rashid Almiov: Radioisotope Thermoelectric Generators. Belonia, April 2005, abgerufen am 20. Dezember 2010.
- ↑ H.-G. Attendorn, Robert Bowen: Isotopes in the Earth Sciences. Springer, 1988, ISBN 978-0-412-53710-3, S. 162–165.
- ↑ Thomas Prohaska, Maria Teschler-Nicola, Patrick Galler, Antonin Přichystal, Gerhard Stingeder, Monika Jelenc and Urs Klötzli: Non-destructive Determination of 87Sr/86Sr Isotope Ratios in Early Upper Paleolithic Human Teeth from the Mladeč Caves – Preliminary Results. In: Early Modern Humans at the Moravian Gate. Springer, Vienna 2006, S. 505–514, doi:10.1007/978-3-211-49294-9, ISBN 3-211-23588-4.
- ↑ E. Wahlen, J. Wahl, P. Pohl: Status of the AVR decommissioning project with special regard to the inspection of the core cavity for residual fuel. In: WM’00 Conference, 27. Februar-2. März 2000, Tucson, Arizona (pdf).
- ↑ Sonderbericht der NRW-Landesregierung zur AVR Boden/Grundwasserkontamination, 2001 (pdf).
- ↑ Gießereilexikon, Stichwort Strontium, 17. Auflage, Verlag Schiele&Schön, Berlin 1997, ISBN 3-7949-0606-3.
- ↑ Colette Febvre, Jean Febvre, Anthony Michaels: Acantharia In: John J. Lee, Gordon F. Leedale, Phyllis Bradbury (Hrsg.): Illustrated Guide to the Protozoa, 2nd Edition. Bd. 2, Society of Protozoologists, Lawrence, Kansas 2000, ISBN 1-891276-23-9, S. 783–803.
- ↑ Patrick De Deckker: On the celestite-secreting Acantharia and their effect on seawater strontium to calcium ratios. In: Hydrobiologia. 517, 2004, S. 1–13, doi:10.1023/B:HYDR.0000027333.02017.50.
- ↑ S. Pors Nielsen: The biological role of strontium. In: Bone. 2004, 35, S. 583–588, doi:10.1016/j.bone.2004.04.026.
- ↑ Strontium And Dental Caries. In: Nutrition Reviews. 1983, 41, 11, S. 342–344, doi:10.1111/j.1753-4887.1983.tb07135.x.
- ↑ Pierre J. Meunier, Christian Roux, Ego Seeman, Sergio Ortolani, Janusz E. Badurski, Tim D. Spector, Jorge Cannata, Adam Balogh, Ernst-Martin Lemmel, Stig Pors-Nielsen, René Rizzoli, Harry K. Genant, Jean-Yves Reginster: The Effects of Strontium Ranelate on the Risk of Vertebral Fracture in Women with Postmenopausal Osteoporosis. In: New England Journal of Medicine. 2004, 35, S. 459–468, doi:10.1056/NEJMoa022436.
- ↑ Pharmazie.com: Metastron-Injektionslösung. (PDF) Arzneimittelinformation, Stand Januar 2002.
- ↑ J. C. Bartley, E. F. Reber: Toxic Effects of Stable Strontium in Young Pigs. In: J. Nutr. 1961, 75, 1, S. 21–28 (Volltext).
- ↑ Eintrag zu Strontium in der GESTIS-Stoffdatenbank des IFA, abgerufen am 10. Dezember 2010 (JavaScript erforderlich).
- ↑ Klaus-Dieter Hellwege: Die Praxis der zahnmedizinischen Prophylaxe: Ein Leitfaden für die Individualprophylaxe, Gruppenprophylaxe und Initiale Parodontaltherapie. 6. Auflage, Thieme Verlag, 2003, ISBN 978-3-13-127186-0, S. 164 (eingeschränkte Vorschau in der Google Buchsuche).
- ↑ Christoph Elschenbroich: Organometallchemie. 6. Auflage, Teubner Wiesbaden, 2008, ISBN 978-3-8351-0167-8, S. 69–70.
Literatur
- J. Paul MacMillan, Jai Won Park, Rolf Gerstenberg, Heinz Wagner, Karl Köhler, Peter Wallbrecht: Strontium and Strontium Compounds. In: Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim 2005, doi:10.1002/14356007.a25_321.
- Thieme Chemistry (Hrsg.): Eintrag zu Strontium im Römpp Online. Version 3.29. Georg Thieme Verlag, Stuttgart 2012, abgerufen am 22. März 2011.
- Arnold F. Holleman, Nils Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage, de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1236-1258.
Weblinks
| Alkalimetalle | Erdalkalimetalle | Lanthanoide | Actinoide | Übergangsmetalle | Metalle | Halbmetalle | Nichtmetalle | Halogene | Edelgase | unbekannt |
| Dieser Artikel wurde am 1. April 2011 in dieser Version in die Liste der lesenswerten Artikel aufgenommen. |