Escherichia coli
| Escherichia coli | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

E. coli (elektronenmikroskopische Aufnahme) | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Escherichia coli | ||||||||||||
| (Migula 1895) Castellani & Chalmers 1919 |

Escherichia coli (abgekürzt E. coli) ist ein gramnegatives, säurebildendes, stäbchenförmiges und peritrich begeißeltes Bakterium, das im menschlichen und tierischen Darm vorkommt. Auf Grund dessen gilt es auch als Fäkalindikator.[1] Innerhalb der Familie der Enterobakterien (griech. „enteron“: Darm) gehört es zur bedeutenden Gattung Escherichia und ist deren Typspezies.[2] Benannt wurde es nach dem deutschen Kinderarzt Theodor Escherich, der es erstmals beschrieb. Coli ist der lateinische Genitiv von colon (Kolon), einem Teil des Dickdarms.[3]
In der menschlichen Darmflora ist es als Vitaminproduzent, insbesondere Vitamin K, bekannt. Die Spezies ist normalerweise nicht krankheitsauslösend, jedoch existieren auch zahlreiche verschiedene pathogene Stämme.[4] Es zählt zu den häufigsten Verursachern von menschlichen Infektionskrankheiten.[1] Die Genomsequenz einiger Stämme ist vollständig aufgeklärt. Als Modellorganismus zählt es zu den am besten untersuchten Prokaryoten[5] und hat eine Rolle als „Arbeitstier“ in Molekularbiologie eingenommen. Der Nobelpreis für Physiologie oder Medizin wurde an zahlreiche Forscher, die sich mit der Biologie von E. coli beschäftigt haben, vergeben.[6]
Merkmale

E. coli hat die Form gerader, zylindrischer Stäbchen mit runden Enden. Der Durchmesser beträgt 1,1–1,5 und die Länge 2,0–6,0 µm. Sie kommen paarweise oder einzeln vor. In der Gram-Färbung lassen sie sich nicht mit Kristallviolett und Iod einfärben (gram-negativ).[2] Es bildet keine Bakteriensporen.[5] Die Zellen bestehen überwiegend (70–85 %) aus Wasser wobei die Trockenmasse zu 96 % aus Polymeren besteht unter denen die Proteine dominieren. Es sind 4288 Proteine annotiert. Im Cytoplasma als auch in der Zellhülle (bestehend aus Zellmembran, Periplasma, äußere Membran) erfüllen sie strukturelle, enzymatische und regulatorische Funktionen. Das Genom umfasst etwa 4600 Kilobasenpaare und kommt als kovalent geschlossenes, ringförmiges Bakterienchromosom vor.[7]
Fimbrien
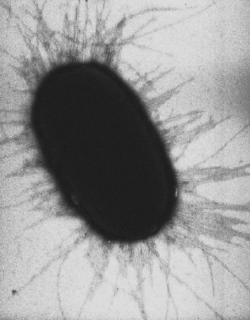
Viele Stämme besitzen Fimbrien (Pili). Eine Zelle des Stammes K-12 enthält typischerweise etwa 100–500 Typ 1 Fimbrien mit einer Länge von 0,2–2,0 µm und einem Durchmesser von ca. 7 nm. Es gibt mehr als 30 verschiedene Arten von Fimbrien, die in zwei nach ihren adhesiven Eigenschaften an rote Blutkörperchen eingeteilt werden: MS (Mannose-sensitive), die in Anwesenheit von Mannose rote Blutkörperchen nicht verklumpen können (Hämagglutination) und MR (Mannose-resistente), denen die Präsenz des Zuckers nichts ausmacht. Typ 1 Fimbrien, die zu den MS-Fimbrien gehören, kommen sowohl in symbiotischen als auch in pathogenen Stämmen vor und werden daher nicht zur Differenzierung herangezogen. MR-Fimbrien sind serologisch divers und fungieren häufig als Virulenzfaktoren. Ihr Anhaften ist sowohl spezies- als auch organspezifisch.[2] Zusätzlich bildet E. coli auch einen Sexpilus aus (auch F-Pilus, F für Fertilität) mit dem Zell-Zell-Kontakte zum Austausch von genetischer Information (Konjugation) möglich sind. Zudem dient der F-Pilus auch einigen Bakteriophagen als Rezeptor nach deren Bindung die Virus-DNA eingeschleust wird (Transduktion).[5]
Bewegung

Zellen von E. coli können durch peritriche Begeißelung beweglich (motil) sein oder selten unbeweglich sein. Motile E. coli bewegen sich mit ihrem proteinösen Flagellum fort wobei sie wiederholt ihre Richtung ändern. Während das Bakterium sich in eine Richtung aktiv fortbewegt bündeln sich die flagellaren Filamente und arbeiten zusammen. Während des Taumelns löst sich das Bündel und reformiert sich um in eine neue Richtung zu beschleunigen. Die Stabilität des Bündels wird durch Chemorezeptoren verstärkt. Bietet man ihnen einen Nährstoff an so wird die Stabilität weiter verstärkt und die Bakterien akkumulieren sich. Schwimmen sie ein Konzentrationsgefälle hinauf so ändern sie weniger häufig ihre Richtung. Schwimmen sie einen Gradienten herunter ist ihr Bewegungsmuster nicht von dem in einer isotropen Lösung zu unterscheiden.[8]
Neben positiver Chemotaxis kann E. coli sich auch aktiv von Schadstoffen entfernen (negative Chemotaxis), wobei niedrige Konzentrationen an Schadstoffen keine Lockstoffe darstellen und hohe Nährstoffkonzentration nicht abstoßend wirken. Es gibt Mutanten, die gewisse Schadstoffe nicht erkennen und nicht-chemotaktische Mutanten, die auch keine Lockmittel erkennen können. Der Prozess benötigt L-Methionin.[9]
Die Signaltransduktion für akkurate chemotaktische Reaktionen hat sich im Laufe der Evolution auf optimale Arbeitsleistung bei minimaler Proteinexpression entwickelt. Aufgrund des hohen Selektionsdrucks ist die Chemotaxis bei E. coli sehr sensitiv, besitzt ein schnelles Ansprechverhalten und ist perfekt angepasst. Zudem scheint die Anordnung innerhalb des bakteriellen chemosensorischen Systems hochkonserviert.[10]
Membranproteine
Zum Stoffaustausch besitzt E. coli Transportproteine in der Zellmembran. Unter den Porinen dominieren outer-membrane-Proteine OmpF und OmpC, welche zwar nicht substrat-spezifisch sind, jedoch kationische und neutrale Ionen bevorzogen und hydrophobe Verbindungen nicht akzeptieren. Die Kopienzahl hängt von der Osmolarität der Umgebung ab und dient der Anpassung an den Lebensraum. Unter den Bedingungen im Dickdarm (Hyperosmolarität, höhere Temperatur) überwiegen OmpC-Kanäle. Verlässt das Bakterium seinen Wirt und findet sich in einem weniger bevorzugten Lebensraum, z.B. einem Gewässer (niedrigere Osmolarität und Temperatur) so wird die OmpF-Synthese gefördert. Für Substrate, die durch die unspezifischen Porine gar nicht oder unzureichend transportiert werden, gibt es substratspezifische Porine. Bei Phosphatmangel exprimiert E. coli das Protein PhoE. Zusammen mit Maltodextrinen entstehen daraus Maltoporine, die auch als Rezeptor für die Lambda-Phage fungieren und daher auch LamB genannt werden. Stämme, die Saccharose verwerten können nehmen diese über das Kanalprotein ScrY auf. Langkettige Fettsäuren werden mit FadL in die Zelle transportiert.[11]
Stoffwechsel
Bei der biochemischen Differenzierung kann mit Methylrot die Glucosefermentation nachgewiesen werden. Neben Säure bildet E. coli aus Glucose auch Gas. Der Indol-Test auf Tryptophanase ist positiv. Die Voges-Proskauer-Reaktion zum Nachweis der Acetoin-Bildung fällt negativ aus. Auf Simmons Citrat-Agar ist keine Verfärbung sichtbar, da E. coli Citrat nicht als alleinige Energiequelle nutzen kann. Zudem kann es Malonat nicht verwerten. Acetat und Tartrat (Test mit Methylrot nach Jordan) können verstoffwechselt werden. Nitrat kann zu Nitrit oxidiert werden. Eine Schwefelwasserstoffbildung auf Triple Sugar Iron-Agar kann nicht beobachtet werden. E. coli kann keinen Harnstoff und keine Gelatine hydrolysieren, manchmal jedoch Esculin. Eine Decarboxylierung von Lysin kann häufig beobachtet werden, seltener von Ornithin. In Kaliumcyanid kann E. coli nicht wachsen. Es besitzt keine Phenylalanindeaminase, keine Lipase und keine DNase im engeren Sinne. Der Oxidase-Test mit Kovacs-Reagenz ist stets negativ. Des Weiteren kann von den meisten Stämmen L-Arabinose, Lactose, Maltose, D-Mannitol, D-Mannose, Mucinsäure, D-Sorbitol, Trehalose und D-Xylose fermentiert werden.[2]
Es gehört zu den fakultativ anaeroben Mikroorganismen und besitzt die Fähigkeit, Energie sowohl durch die Atmungskette als auch durch „Gemischte Säuregärung“ zu gewinnen. Die Gärungsbilanz bei E. coli sieht folgendermaßen aus:[12]
Serotypen
Die Serotypisierung ist eine nützliche Möglichkeit E. coli anhand der zahlreichen Unterschiede in der Antigenstruktur auf der Bakterienoberfläche einzuteilen.[2]
Man unterscheidet vier Gruppen von Serotypen:
- flagellare H-Antigene für die Flagellen, abgeleitet von „mit Hauch wachsende Bakterien“, da sie durch ihre aktive Fortbewegung auf einer Agarplatte ein mattes Kräuselmuster erzeugen, das wie eine angehauchte Glasplatte aussieht.[13] Es handelt sich um Proteinantigene.[14]
- somatische O-Antigene, abgeleitet von „ohne Hauch“[13] für die Lipopolysaccharide, die sich auf der Oberfläche der Zellwand befinden. Ihre Spezifität wird durch Kohlenhydratseitenketten bestimmt.[14]
Selten zur Diagnostik eingesetzt werden:
- K-Antigene für die Kapsel, die aus Polysacchariden aufgebaut sind[14]
- fimbriale F-Antigene für die Fimbrien[14]
Vorkommen
E. coli kommt als universeller und kommensaler Begleiter im unteren Darmtrakt warmblütiger Tiere (inklusive des Menschen) vor. Im Stuhl befinden sich etwa 108–109 koloniebildendende Einheiten pro g.[5] Er kann auch in anderen Habitaten überleben. Bei Neugeborenen spielt er als Erstbesiedler eine wichtige Rolle. Obwohl er selbst nur in geringer Zahl vorhanden ist dient er der Ansiedlung obligater Anaerobier, die physiologische Bedeutung bei der Verdauung besitzen.[15] Trotz des geringen Anteils im Darm nimmt E. coli eine beherrschende Stellung im Darm ein, den er bei Menschen innerhalb von 40 Stunden nach der Geburt über Lebensmittel, Wasser oder anderen Individuen kolonisiert. Die Fähigkeit zum Anhaften an den Mucus erlaubt E. coli lange Zeit im Darm zu verweilen. Obwohl sehr viel über den Organismus bekannt ist, bleibt die Ökologie im Darm relativ unverstanden.[16]
Lebensmittelhygiene
Sporadische durch Trinkwasser übertragene Ausbrüche von enterotoxischen Stämmen (ETEC) sind bekannt. Zudem wird ETEC durch Konsum von Weichkäse und rohem Gemüse übertragen. Ausbrüche von enteropathogenen Stämmen (EPEC) werden häufig mit kontaminiertem Trinkwasser und einigen Fleischprodukten in Verbindung gebracht. Infektionen mit enterohämorrhagischen E. coli (EHEC) stammen häufig von Lebensmitteln oder werden durch Wasser übertragen. Häufig infizierte Lebensmittel sind nicht durchgegartes Rinderhack, Rohmilch, kalte Sandwiches, Wasser, nicht-pasteurisierter Apfelsaft, Sprossen und rohes Gemüse.[17] Zudem wurden Epidemien im Zusammenhang mit Hamburgern, Roastbeef, Kohlrouladen und Rohwurst (Teewurst) aufgeklärt.[18]
In 1–2 % des Rinderkots kann der für Rinder ungefährliche Magensäure-resistente Stamm Escherichia coli O157:H7 (EHEC) nachgewiesen werden, welcher bei der Schlachtung auch das Fleisch kontaminieren und bei Menschen schwere Lebensmittelvergiftungen auslösen kann. Der Grund hierfür ist, dass häufig stärkehaltiges Getreide gefüttert wird, das im Pansen unvollständig abgebaut und zu Säure fermentiert wird, so dass sich acidophile Bakterien dort anreichern. Es konnte gezeigt werden, dass die Fütterung von Heu oder Gras die Anzahl humanpathogener Stämme reduziert.[19]
Da eine komplette EHEC-Sanierung der Tierbestände nicht möglich ist, muss die Prophylaxe bei der Schlachthygiene ansetzen. Rindfleischprodukte sollten mind. 10 Minuten bei mind. 70 °C durchgegart werden. Aufgrund der hohen Umweltresistenz der Erreger sollten Lebensmittelhersteller Belastungstests und HACCP-Analysen durchführen. Risikogruppen (Kinder unter 6 Jahren und immunsupprimierte Personen) sollten rohe Produkte nicht verzehren.[18]
Medizin
Probiotikum
Der Stamm Escherichia coli Nissle 1917 (Handelsname Mutaflor) zählt zu den am häufigsten untersuchten Probiotika. Er wurde während des ersten Weltkrieges vom Stuhl eines Soldaten isoliert, der im Gegensatz zu seinen Kameraden nicht an Durchfall litt. Der Stamm ist mittlerweile sequenziert und besitzt sechs verschiedene Systeme um Eisen aufzunehmen wodurch er Konkurrenten aus dem Feld schlägt. Er besitzt Adhesine für eine effektive Kolonisierung und blockiert das Anhaften und Eindringen von pathogenen Bakterien an die Epithelzellen des Darms. Zudem besitzt es einen entzündungshemmenden Effekt auf die T-Zellen-Proliferation. Des Weiteren wird die Produktion von menschlichem β-Defensin-2 angeregt, das als Breitspektrumantibiokum sowohl gram-positive als -negative Bakterien, Pilze und Viren abtötet.[20]
Humanpathogenität
Die meisten Stämme von E. coli sind nicht pathogen und damit harmlos. Einige Serotypen spielen jedoch eine wichtige Rolle bei Erkrankungen innerhalb und außerhalb des Darms. In Wirten mit Immunschwäche ist E. coli ein opportunistischer Erreger, das heißt, erst durch die Schwächung kann er wirksam werden.[2] Uropathogene E. coli (UPEC) sind für unkomplizierte Harnwegsinfektionen verantwortlich.[21] Neonatale Meningitis auslösende E. coli (NMEC) können die Blut-Hirn-Schranke passieren und bei Neugeborenen eine Hirnhautentzündung auslösen. NMEC und UPEC führen im Blutstrom zur Sepsis.[22]
Es wird vermutet, dass E. coli mit chronisch-entzündlichen Darmerkrankungen wie Morbus Crohn und Colitis ulcerosa assoziiert ist, da neben genetischer Prädisposition und Umweltfaktoren an der Krankheitsentstehung unter anderem auch eine fehlregulierte Immunantwort der Schleimhaut gegen kommensale Bakterien beteiligt sein könnte.[23] Die Schleimhaut der Patienten ist abnormal mit adhärent-invasiven E. coli (AIEC) kolonisiert, welche an den Epithelzellen anhaften und in sie eindringen.[24]
Die darmpathogenen E. coli werden in fünf verschiedene Pathogruppen unterteilt. Weltweit sorgen sie für 160 Mio. Durchfallerkrankungen und 1 Mio. Todesfälle pro Jahr. In den meisten Fällen sind Kinder unter 5 Jahren in den Entwicklungsländern betroffen.[25]
Enteropathogene
Enteropathogene E. coli (kurz EPEC) sorgen bei Kleinkinder für schwere Durchfälle, die in industrialisierten Gesellschaften selten sind, in unterentwickelten Ländern häufig für plötzlichen Kindstod verantwortlich sind. Mithilfe des EPEC Adhäsionsfaktor (EAF) heften sich die EPEC an die Epithelzellen des Dünndarms und injizieren dann Toxine in die Enterozyten mit Hilfe eines Typ-III-Sekretionssystems.[1]
Enterotoxische
Enterotoxische E. coli (kurz ETEC) sind häufiger Erreger der Reisediarrhoe (Montezumas Rache). Grund für diese Erkrankung ist ein hitzelabiles Enterotoxin vom A/B Typ (LT I und LT II), sowie ein hitzestabiles Enterotoxin (ST). Dieses 73 kDa große Protein besitzt zwei Domänen, von denen eine an ein G-Gangliosid der Zielzelle bindet (Bindende Domäne). Die andere Domäne ist die Aktive Komponente, die ähnlich dem Choleratoxin (ca. 80% Genhomologie) die Adenylatcyclase aktiviert. Das ca. 15-20 Aminosäuren langes ST aktiviert die Guanylatcyclase. Die Aktivierung der Adenylatcyclase und der Guanylatcyclase endet in einer sekretorischen Diarrhoe, bei der viel Wasser und Elektrolyte verloren gehen. Die genetische Information erhält das Bakterium von einem lysogenen Phagen durch Transduktion.[25]
Enteroinvasive
Enteroinvasive E. coli penetrieren die Epithelzellen des Kolons und vermehren sich dort. Innerhalb der Zelle kommt es zur Aktionschweifbildung, womit sie wie Listerien und Shigellen in benachbarte Epithelzellen eindringen. Es kommt zu Entzündungen und Geschwürbildung unter Absonderung von Blut, Schleim und weißen Blutkörperchen (Granulozyten). Zudem können EIEC Enterotoxine abgeben, die zu Elektrolyt- und Wasserverlust führen. Das Krankheitsbild ähnelt einer Bakterienruhr mit Fieber und blutig-schleimigen Durchfällen, wobei häufig eine abgeschwächte Symptomatik mit wässriger Diarrhoe einhergeht.[25]
Enterohämorrhagische
Enterohämorrhagische E. coli (kurz EHEC) sind Shigatoxin produzierende E. coli (STEC) mit zusätzlichen Pathogenitätsfaktoren. Das Shigatoxin wirkt enterotoxisch und cytotoxisch und zeigt Ähnlichkeiten mit dem von Shigellen gebildetem Toxin. Analog werden VTEC (Verotoxin produzierende E. coli) benannt. Durch EHEC verursachte Darmerkrankungen wurden vornehmlich unter dem Namen enterohämorrhagische Colitis bekannt. EHEC-Infektionen zählen zu den häufigsten Ursachen für Lebensmittelvergiftungen. Der Erreger ist hoch infektiös: 10–100 Individuen sind für eine Erkrankung ausreichend. Die niedrige Infektionsdosis begünstigt eine Übertragung von Mensch zu Mensch. Eine Infektion kann jedoch auch durch Tierkontakt (Zoonose) oder durch Verschlucken von Badewasser erfolgen. Typische Krankheitsbilder sind die Thrombotisch-thrombozytopenische Purpura (TTP) und ein Hämolytisch-urämisches Syndrom (HUS). Gefürchtet ist vor allem HUS aufgrund der Möglichkeit an einem terminalen Nierenschaden zu sterben. Hierbei sind alle Altersgruppen betroffen, jedoch vor allem Kinder unter 6 Jahren. Das Nierenversagen verläuft in 10-30 % der Fälle mit dem Tod des Patienten innerhalb eines Jahres nach Beginn der Erkrankung.[18]
Enteroaggregative
Enteroaggregative E. coli (EAggEC oder EAEC abgekürzt) besitzen die Fähigkeit zur Autoaggregation. Sie heften sich an das Dünndarmepithel mit spezifischen Fimbrien. Charakteristisch ist die erhöhte Schleimproduktion der Mukosazellen, die eine Ausscheidung verzögert. Es kommt zu einer Diarrhoe vom sekretorischen Typ aufgrund von Enterotoxinen (EAST). Durch EAEC werden sowohl akute als auch chronisch rezidivierende Durchfallerkrankungen, die sich über Wochen hinziehen können verursacht. Neben wässrig schleimigen Durchfall kann es auch zu Fieber und Erbrechen oder blutigem Stuhl kommen. Bei Immunsupprimierten (z.B. HIV-Patienten) ist EAEC der häufigste Erreger einer bakteriellen Enteritis.[25]
Zoopathogenität
E. coli ist für eine Vielzahl von Infektionskrankheiten bei Tieren verantwortlich. Spezifische veterinärmedizinische Krankheitsbilder sind:
- Coliruhr der Saug- und Absatzferkel
- Coliseptikämie der Kälber und Lämmer
- Coliseptikämie des Geflügels
- Colimastitis der Kühe
Beim Hausschwein lösen extraintestinal pathogene (ExPEC) Stämme eine hämorraghische Septikämie aus, die als Differentialdiagnose zur Schweinepest angesehen wird.[26]
Labordiagnose



Coliforme Bakterien werden als Indikator für die sanitäre Gewässergüte und die Hygiene bei der Lebensmittelverarbeitung verwendet. Fäkalcoliforme Keime gelten insbesondere bei Schalentieren der Standardindikator für Verunreinigung. E. coli zeigt fäkale Verunreinigung sowie unhygienische Verarbeitungen an. Klassischerweise basieren die biochemischen Methoden zum Nachweis von E. coli, Gesamtcoliformen oder Fäkalcoliformen auf der Verwertung von Lactose. Eine Auszählung ist mittels MPN-Verfahren möglich. Gebräuchlich ist eine Brillantgrün-Galle-Lactose-Bouillon in denen Gasbildung beobachtet wird. Es gibt jedoch auch spezielle Nährböden wie Eosin-Methylen-Blau, VRB-Agar (Kristallviolett-Neutralrot-Galle-Agar), MacConkey-Agar[17] oder Endo-Agar, die Lactoseverwertung anzeigen. Zur Differenzierung von anderen Enterobakterien kann der IMViC-Test durchgeführt werden.[27]
Pathogene E. coli werden ebenfalls zunächst angereichert. Das hitzelabile Enterotoxin (LT) der ETEC kann durch einen Y-1 Nebennieren-Zell-Assay, Latexagglutinations-Assay und ELISA nachgewiesen werden. Der Nachweis für das hitzestabile Toxin (ST) der ETEC kann ebenfalls mittels ELISA oder Jungmaus-Assay erfolgen. Die Gene für LT und ST sind bekannt und können mittels PCR oder mittels Gensonde nachgewiesen werden. In Verbindung mit ausplatierten Medien kann so eine Auszählung der ETEC-positiven Kolonien erfolgen. EIEC sind nicht-motil und anaerogen, da sie kein Lysin decarboxilieren und keine Lactose fermentieren. Der invasive Phänotyp von EIEC, der durch ein hochmolekulares Plasmid kodiert wird, kann mittels HeLa-Zellen oder Hep-2 Gewebezellkulturen nachgewiesen. Alternativ kann wiederum auf PCR- und Sondenmethoden für die Invasionsgene zurückgegriffen werden. Das Protein Intimin der EPEC wird durch ein eae-Gen kodiert auf das mit PCR getestet werden kann. Des Weiteren wird der EPEC adhärent Faktor (EAF) über ein Plasmid kodiert. Das Protein lässt sich mit Hep-2 Zellen nachweisen. EHEC kann über die Shiga-Toxine (Stx) nachgewiesen werden. Insbesondere Stx1 und Stx2 werden mit menschlichen Erkrankungen in Zusammenhang gebracht wobei zahlreiche Varianten von Stx2 existieren. Die Produktion von Stx1 und Stx2 kann mit Zytotoxizitätstests auf Vero-Zellen oder Hela-Gewebekulturen sowie durch ELISA und Latexaggulationstests erfolgen. Zudem gibt es PCR-Assays für Stx1, Stx2 oder andere charakteristische Marker. EHEC zeichnen sich zudem durch keine oder langsame Fermentation von Sorbitol aus.[17] Eine weitere biochemische Differenzierung ist der LST-MUG-Assay, welcher auf der enzymatischen Aktivität von β-Glucuronidase (GUD) basiert. GUD setzt das Substrat 4-Methylumbelliferyl-β-D-glucuronid (MUG) in 4-Methylumbelliferon um, welches bei 365 nm (UV-Licht) eine blaue Fluoreszenz zeigt. GUD wird von >95 % der E. coli-Stämme produziert (inklusive denen, die kein Gas produzieren), jedoch nicht von EHEC des Serotyps O157:H7 weshalb es hier zur Differenzierung verwendet werden kann.[27]
Therapie
Die Therapie bei fakultativ pathogenen Stämmen sollte immer gezielt nach Antibiogramm erfolgen. E. coli besitzt Antibiotikaresistenzen durch die Bildung zahlreicher β-Lactamasen, die in der Lage sind β-Lactam-Antibiotika zu spalten. Mittel der Wahl sind Aminopenicilline, Ureidopenicilline, Cephalosporine, Carbapeneme, Chinolone, Cotrimoxazol. Aminoglycoside werden in Ausnahmesituationen kombiniert. Bei obligat pathogenen E.-coli-Stämmen sind die Gastroenteritidien selbstlimitierend. Der starke Flüssigkeitsverlust muss jedoch insbesondere bei Säuglingen und Kleinkindern behandelt werden. Für den Wasser- und Salzverlust bieten sich orale Rehydratationslösungen an. Die zweimalige Gabe von Antibiotika (z.B. Ciprofloxacin und Cotrimoxazol) innerhalb von 24 h kann Dauer und Schwere der Erkrankung lindern.[28]
Eine rasche Keimzahlreduktion kann nur bei sehr frühem Einsatz erzielt werden. Bei der Therapie von enterohämorrhagischen E. coli mit Antibiotika kann es durch vermehrte Ausschüttung von Verotoxin zu Komplikationen kommen. Insbesondere bei der Gabe von Fluorchinolonen, Cotrimoxazol, Aminoglycosiden und Fosfomycin überwiegen die ungünstigen Wirkungen. Dies gilt nicht in gleichem Maße für Carbapeneme. Auch der Einsatz neuerer Makrolide und gegebenenfalls von Clindamycin sowie Rifampicin und Rifaximin bei gegebener Indikation (z. B. Sanierung von Meningokokken-Trägern) scheint nicht kontraindiziert. Jedoch bleibt der Einsatz dieser Substanzen im Sinne einer EHEC-Virulenzabschwächung durch Reduktion der Verotoxinproduktion kontrovers.[29]
Forschung
Geschichte
Entdeckt wurde es 1885 von Theodor Escherich, der es damals „Bacterium coli commune“ nannte.[30] 1919 wurde es ihm zu Ehren umbenannt.[31] 1892 wurde von Shardinger vorgeschlagen E. coli als Indikatororganismus für fäkale Verunreinigung zu verwenden. In der Praxis war es jedoch schwierig mit rein biochemischen Nachweismethoden E. coli von anderen Enterobakterien abzugrenzen weshalb die nicht taxonomische Einteilung coliforme Bakterien geprägt wurde.[27] 1997 wurde die DNA-Sequenz aufgeklärt.[7] Hierfür wurden 15 Jahre benötigt.[32]
Phylogenie
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kladogramm mit 26 vollständig sequenzierten E.coli-Stämmen, berechnet durch Orthologiebestimmung aller Gene. Mit Hilfe von Dendroscope[33] aus dem phylogenetischen Baum des OMA Orthologs Project (abgerufen am 11. März 2012) extrahiert. |
Das Kerngenom, dass sich in allen sich in allen Stämmen wiederfindet macht lediglich 6 % der Genfamilien aus. Über 90 % der Gene sind variabel. Die Diversität innerhalb der Spezies und die überlappenden Geninhalte mit verwandten Spezies lassen einen Übergang anstelle einer scharfen Speziesabgrenzung innerhalb der Enterobacteriaceae vermuten.[34] Insbesondere zwischen der Gattung Shigella und enteroinvasiven E. coli gibt es eine enge evolutionäre Verwandtschaft sowohl in der chromosomalen DNA als auch bei dem Virulenzplasmid.[35]
Man unterscheidet anhand von phylogenetischen Analysen vier Hauptgruppen (A, B1, B2, und D) wobei die virulenten extraintestinalen Stämme hauptsächlich zu den Gruppen B2 und D gehören.[36] Innerhalb der Gattung Escherichia ist E. fergusonii die nächste verwandte Art.[37]
Der extraintestinal pathogene (ExPEC) Serotyp O7:K1 (Stamm IAI39) löst beim Hausschwein eine hämorraghaische Septikämie aus. Er hat keine ETEC (enterotoxische) oder EDEC (Ödemkrankheit-verursachende E. coli) Virulenzfaktoren. Stattdessen besitzt er P-Fimbrien und Aerobactin[26] Stamm SMS-3-5 / SECEC wurde in einem küstennahen Industriegebiet, mit Schwermetallen verseuchtem Gebiet isoliert. Es ist gegen zahlreiche Antibiotika in hohen Konzentrationen resistent.[38]
Serotyp O127:H6, Stamm E2348/69 war der erste sequenzierte und am besten untersuchte enteropathogene E. coli (EPEC).[39]
Im Vergleich mit anderen pathogenen Stämmen zeigt CFT073 des Serotyps O6:H1 das Fehlen eines Typ-III-Sekretionssystems und keine Phagen- oder Plasmidkodierten Toxine. Stattdessen besitzt er fimbriale Adhesine, Autotransporter, Eisen-Sequestierungssysteme und Rekombinasen. Schlussfolgernd kann man sagen, dass extraintestinal pathogene E. coli unabhängig voneinander entstanden sind. Die verschiedenen Pathotypen haben hohe Syntenie, die durch vertikalen Gentransfer entstanden ist und ein gemeinsames Rückgrat bildet, das durch zahlreiche Inseln aufgrund von horizontalem Gentransfer unterbrochen wird.[40]
Der Serotyp O45:K1 (Stamm S88 / ExPEC) wurde 1999 aus der Zerebrospinalflüssigkeit eines spät ausbrechenden Meningitisfall in Frankreich isoliert. Er gehört zur phylogenetischen Gruppe B2.[41] Serotyp O1:K1 löst bei Vögeln Krankheiten aus und wird „avian pathogen Escherichia coli“ (APEC) genannt. Er ist mit drei menschlichen uropathogenen (UPEC) eng verwandt.[42] UTI89 ist ein uropathogener E. coli Stamm, der aus einem Patienten mit akuter Blaseninfektion isoliert wurde.[43] Stamm ED1a ist hingegen apathogen und wurden aus dem Stuhl eines gesunden Mannes isoliert.[44] Der uropathogene Stamm 536 (O6:K15:H31) stammt ursprünglich von einem Patienten mit akuter Pyelonephritis. Er ist ein Modellorganismus für extrainstestinale E. coli. Das Genom enthält fünf gut charakterisierte Pathogenitätsinseln und eine neu entdeckte sechste, die den Schlüsselvirulenzfaktor darstellt.[45]
Der gefürchtete Lebensmittelvergifter E. coli O157:H7 wurde vollständig sequenziert um seine Pathogenität zu verstehen. Die Erklärung liefert ein massiver lateraler Gentransfer. Über 1000 neue Gene finden sich in diesem Stamm-spezifischen Cluster. Enthalten sind mögliche Virulenzfaktoren, alternative metabolische Fähigkeiten sowie zahlreiche Prophagen, die für die Lebensmittelüberwachung genutzt werden können.[46] Das Virulenzplasmid pO157 besitzt 100 offene Leserahmen. Ein ungewöhnlich großes Gen hat eine mutmaßliches aktives Zentrum, das mit der Familie des großen clostridialen Toxins (LCT) und Proteinen wie ToxA und B von Clostridium difficile verwandt ist.[47] Der Stamm TW14359 wurde 2006 nach eine Ausbruch von E. coli O157:H7 in den USA aus Spinat isoliert. Es wurden neue Genabschnitte festgestellt, welche die erhöhte Fähigkeit zur Auslösung des Hämolytisch-urämischen Syndroms oder alternativ die Anpassung an Pflanzen erklären. Zudem enthält der Stamm Gene für intakte anaerobe Nitritreduktasen.[48]
Serotyp O139:H28 (Stamm E24377A / ETEC) ist ein enterotoxischer Isolat. Er besitzt colonization factor antigen (CFA) Pili um sich anzuheften. 4 % des Genoms besteht aus Insertionssequenzen. Vermutlich kann der Stamm Propandiol als einzige Kohlenstoffquelle verwerten.[49] Stamm 55989 / EAEC ist ein enteroaggregativer Stamm, der 2002 in der Zentralafrikanischen Republik aus dem Stuhl eines HIV-positiven Erwachsenen, der an stark wässrigem Durchfall litt, isoliert wurde.[50]
Stamm IAI1 vom Serotyp O8 ist ein bei Menschen kommensaler Stamm, der aus dem Fäzes eines gesunden Franzosen in den 1980ern isoliert wurde.[51] Stamm SE11 vom Serotyp O152:H28 wurde ebenfalls aus dem Fäzes eines gesunden Menschen isoliert. Im Vergleich mit dem Laborstamm K-12 MG1655 besitzt er zusätzliche Gene für Autotransporter und Fimbrien um sich an den Darmzellen zu befestigen. Zudem besitzt er mehr Gene, die für den Kohlenhydratstoffwechsel von Bedeutung sind. Alles deutet darauf hin, dass sich dieser Stamm an den menschlichen Darm angepasst hat.[52] Serotyp O103:H2 Stamm 12009 wurde 2001 in Japan von einem Patienten mit sporadisch auftretendem blutigen Durchfall isoliert. Offenbar sind EHEC Stämme mit den gleichen Pathotypen von verschiedener Abstammung unabhängig voneinander durch Lambda-Phagen, Inserationelemente und Virulenzplasmide entstehen.[53]
Crooks (ATCC 8739 / DSM 1576) ist ein fäkaler Stamm, der dazu verwendet wird die Effizienz antimikrobieller Wirkstoffe zu testen. Er besitzt ein Insertionselement innerhalb von ompC und kann daher nur ompF als äußeres Membranporin exprimieren.[54] Stamm B dient als Forschungsmodell für Phagensensitivität, Restriktionsmodifikationssysteme und bakterielle Evolution. Ihm fehlen Proteasen. Zudem produziert er wenig Acetat, wenn ihm viel Glucose angeboten wird. Aufgrund einer einfachen Zelloberfläche ist die selektive Permeabilität verbessert. Daher wird er gerne zur rekombidanten Proteinexpression im Labormaßstab und in industriellen Dimensionen eingesetzt.[55] Stamm K12 von MC4100 ist sehr häufig eingesetzt. Eine Genomsequenzierung zeigte, dass er während seiner Anpassung an die Laborumgebung zusätzliche Unterschiede entwickelt hat, die nicht künstlich herbeigeführt wurden.[56] Stamm K12 wurde 1922 von einem Patienten mit Diphtherie isoliert und 1925 in die Stammsammlung von Stanford überführt. Da er prototroph und in definierten Medium mit kurzen Generationszeiten einfach zu züchten ist, wurde er schnell zum bestuntersuchten Organismus und seit den 1950ern zum Verstehen zahlreicher fundamentaler biochemischer und molekularer Prozesse herangezogen. Zudem besitzt er die unter E. coli Wildtypen seltene Fähigkeit zur Rekombination.[57] Stamm DH10B ist ein Derivat von K12, das aufgrund der leichten Transformation insbesondere großer Plasmide (nützlich bei der Genomsequenzierung) vielfach eingesetzt wird. Die Sequenz wurde aus „Kontaminationssequenzen“ bei der Genomsequenzierung des Rindes zusammengesetzt.[58]
Serotyp O9:H4 Stamm HS wurde von einem Laborwissenschaftler des Walter-Reed-Militärkrankenhaus isoliert. Im Humanexperiment zeigte sich, dass Stamm HS den Gastrointestinaltrakt kolonisiert, aber keine Krankheitsbilder verursacht.[59] Stamm UMN026 ist ein extraintestinal pathogener Stamm (ExPEC), der 1999 in den USA von einem Patienten mit akuter Cystitis isoliert wurde. Er gehört zur phylogenetischen Gruppe D und besitzt den Serotyp O17:K52:H18. Er ist Repräsentant einer kürzlich bekannt gewordenen Gruppe resistenter Erreger.[60]
Der Serotyp O104:H4 Klon HUSEC041 (Sequenztyp 678) enthält Virulenzfaktoren, die sowohl für STEC als auch für EaggEC typisch sind. Im Zusammenhang mit der HUS-Epidemie 2011 in Norddeutschland wird dieser Hybrid für die besonders schwere Verlaufsform verantwortlich gemacht.[61]
Langzeitprojekt

Seit 1988 führt Richard Lenski ein Langzeitexperiment über die Evolution von E. coli durch. Jeden Tag werden die Kulturen in ein frisches Medium überimpft und tiefgefroren. So können neue besser angepasste Stämme wieder gegen ihre Vorfahren antreten und geprüft werden ob sie sich besser an ihre Erlenmeyerkolbenumgebung angepasst haben. Es werden parallel die Veränderungen im Genom ermittelt wobei die Innovationsrate kontinuierlich abnahm je besser sich die Kulturen anpasst hatten. Es wurden auch Parallelversuche mit Myxococcus xanthus gemacht, das E. coli jagt und frisst sowie Temperatur und Medium variiert. Unter konstanten Bedingungen ohne Fressfeinde und nur einem Zucker (Glucose) wurde dem Nährmedium auch Citrat zugegeben, obwohl E. coli dieses nicht verwerten kann. Im Jahr 2003 dominierte plötzlich eine Citrat verwertende Mutante, die nachweislich von der Ursprungskultur abstammte.[62]
Biosensoren
Mittels gentechnisch veränderter E. coli ist es möglich Biosensoren für Schwermetalle wie Arsen herzustellen. Die natürlichen Mechanismen werden hierbei mit Reportergenen wie β-Galactosidase, bakteriellen Luciferasen (lux) oder dem Grün fluoreszierendem Protein (GFP) gekoppelt. Auf diese Weise ist es möglich kostengünstig Arsenite und Arsenate unterhalb eines Mikrogramms zu detektieren.[63]
Gentechnik
Die Kombination von ringförmiger separat in der Bakterienzelle vorliegender DNA, den sogenannten Plasmiden, mit der Entdeckung des Restriktionsenzyms EcoRI, das doppelsträngige DNA spezifisch schneidet und identische überstehende Enden zurücklässt, war die Geburtsstunde der Gentechnik. Um rekombinante DNA (künstlich hergestellte DNA) zu erhalten, wird bei einer typischen Klonierung zunächst das DNA-Fragment der Wahl und anschließend die plasmidische DNA eines so genannten Klonierungsvektors mit Restriktionsenzymen geschnitten. Durch eine Ligation werden die Enden des DNA-Fragmentes und des Plasmides zusammengefügt und anschließend in E. coli transformiert. Auf diese Weise können beispielsweise artfremde Gene in E. coli eingebracht werden, sodass dieses die auf der DNA codierten fremden Proteine synthetisieren kann.[64]

Moderne künstlich hergestellte Plasmide (Vektoren oder „Genfähren“) wie pUC19 enthalten zusätzliche Antibiotika-Resistenzgene um Bakterienzellen ohne einklonierte Plasmide auf Selektivnährböden abzutöten. Eine weitere Möglichkeit zur Selektion transformierter Kolonien ist das blue-white-screening. Das Gen lacZ codiert das Protein β-Galactosidase, welches in Anwesenheit von IPTG synthetisiert wird und das künstliche Glycosid X-Gal in einen blauen Farbstoff spaltet. Nicht-transformierte Zellen erscheinen also blau auf einen Nährboden mit X-Gal. Schneidet ein Restriktionsenzym innerhalb des lacZ-Gens und wird erfolgreich ein Fremdgen eingebracht, so wird die Sequenz zur Expression von β-Galactosidase dermaßen zerstört, dass keine α-Komplementation mehr möglich ist. Erfolgreich transformierte Zellen erscheinen also weiß. Das lacZ dient hierbei somit als Reportergen. Der Test funktioniert nur mit der Deletions-Mutante lacZΔM15 deren defekte β-Galactosidase auf die α-Komplementation angewiesen ist.[65]
ArcticExpress
Zwingt man E. coli zur Überexpression von heterologen Proteinen kann es zu Problemen bei der Proteinfaltung kommen. Es kommt zur Anhäufung fehlgefalteter und somit biologisch inaktiver Proteine (Einschlusskörperchen). Eine Strategie um die Ausbeute an löslichem Protein zu steigern ist die Kultivierung bei niedrigen Temperaturen. Hierfür koexprimiert man im mesophilen E. coli die Faltungshelferproteine (Chaperonine) Cpn10 and Cpn60 aus dem psychrophilen Bakterium Oleispira antarctica, die bei 4–12°C arbeiten. Sie werden unter dem Markennamen ArcticExpress von der Firma Agilent vertrieben. Zusätzlich werden Stämme angeboten, die weitere tRNAs besitzen um dem limitierenden Codon Bias bei der Translation DNA fremder Organismen in rekombinante Proteine entgegenzuwirken.[66]
XL1-Red
E. coli XL1-Red ist ein Stamm, der in der Molekularbiologie und Gentechnik zur ungerichteten Mutagenese genutzt wird. Durch Defekte im DNA-Reparaturmechanismus zeigt der Stamm eine 5000-fache Mutationsrate gegenüber dem Wildtyp jedoch auch eine deutlich geringere Wachstumsrate (Verdopplung alle 90 min. bei 37°C). Die Defekte im Reparaturmechanismus der DNA-Vervielfältigung gehen auf drei Mutationen der genomischen DNA zurück. Das Gen MutS enthält Mutationen der DNA-Mismatch-Reparaturproteine. Durch die Mutation erfolgt keine Fehlbasenreparatur nach der DNA-Replikation. MutD löst einen Defekt der 3'-5'-Exonukleaseaktivität der DNA-Polymerase III aus. MutT ist für die Unfähigkeit zur Hydrolyse des Basenanalogons oxo-dGTP verantwortlich.[67] Zur Mutationsauslösung werden also weder Mutagene noch Karzinogene benötigt. Die Generierung von Genmutationen ist ein klassisches Mittel in der molekularbiologischen Forschung, um generelle oder Teilfunktionen des entsprechenden Gens zu charakterisieren.
Biotechnologie
Die erste kommerzielle biotechnologische Anwendung war die Produktion des menschlichen Hormons Somatostatin von der Firma Genentech mittels genetisch veränderten E. coli. Die großtechnische Herstellung von Insulin und Wachstumshormonen folgte kurz darauf.[64] Das derart hergestellte Insulinpräparat wird in der Behandlung von Diabetes mellitus eingesetzt. Hierfür ist E. coli besonders geeignet, da es zur Darmflora des Menschen gehört und so gut wie keine Allergien verursacht. Auch in der industriellen Herstellung von Aminosäuren, Interferon sowie weiterer Feinchemikalien, Enzyme und Arzneistoffe, werden gentechnisch veränderte E. coli Bakterien verwandt.[68] So wurden neun von 31 therapeutischen Proteinen, die im Zeitraum von 2003 bis 2006 eine Arzneimittelzulassung erhalten haben, in E. coli hergestellt.[69]
Um E. coli in biotechnologischen Anwendungen leichter handhaben zu können, züchtete ein Team um Frederick Blattner (University of Wisconsin) einen Stamm, dessen Genom gegenüber natürlich vorkommenden Varianten um ca. 15 Prozent verkleinert wurde, und der dennoch lebens- und fortpflanzungsfähig ist. Hierfür wurden zwei unterschiedliche E. coli Stämme verglichen, und diejenigen Gene entfernt, die kein Homolog im jeweils anderen Stamm haben und somit entbehrlich scheinen.[70]
Biotreibstoffe
Die Herstellung von Biotreibstoffen aus Proteinen ist mit genetisch veränderte E. coli, die drei exogene Transaminierungs- und Desaminierungszyklen enthalten, möglich. Die Proteine werden zunächst durch Saccharomyces cerevisiae, Bacillus subtilis, Mikroalgen (zur gleichzeitigen CO2-Fixierung) oder E. coli selbst hergestellt. Die Proteine könnten auch aus Abfällen von Fermentationen, Lebensmittelverarbeitung, und Bioethanolherstellung stammen. Anschließend werden die Hydrolysate in C4 und C5 Alkohole mit 56 % der theoretischen Ausbeute umgewandelt. Der entstehende Stickstoff kann in Düngemittel umgewandelt werden.[71]
Durch Veränderungen im Stoffwechsel von E. coli können höhere Alkohole wie Isobutanol, 1-Butanol, 2-Methyl-1-butanol, 3-Methyl-1-butanol und 2-Phenylethanol aus der C-Quelle Glucose produziert werden. Hierfür wird der hochaktive Biosyntheseweg für Aminosäuren verwendet und die 2-Ketosäureintermediate zur Alkoholsynthese verwendet. Verglichen mit dem klassischen Biotreibstoff Ethanol ist die höhere Energiedichte und die niedrige Hygroskopie hervorzuheben. Zudem haben verzweigtkettige Alkohole höhere Octanzahlen.[72]
Raumfahrt
Im Zuge der GeneSat-1 Mission wurden am 16. Dezember 2006 E. coli mittels eines CubeSat in den Orbit befördert, um genetische Änderungen aufgrund von Strahlungen im All und der Schwerelosigkeit zu untersuchen.[73]
Weblinks
Einzelnachweise
- ↑ 1,0 1,1 1,2 Fritz H. Kayser: Medical Microbiology. Thieme, 2005, ISBN 9781604061222, S. 292.
- ↑ 2,0 2,1 2,2 2,3 2,4 2,5 Don J. Brenner, Noel R. Krieg, James R. Staley, George Garrity: The Proteobacteria, The Gammaproteobacteria. In: Bergey’s Manual of Systematic Bacteriology. 2. Auflage. 2, Nr. B, Springer US, 2005, ISBN 978-0-387-24144-9.
- ↑ Escherichia Coli. Duden, abgerufen am 3. März 2012.
- ↑ Katharina Munk (Hrsg.), Katharina Munk (Hrsg.): Taschenlehrbuch Biologie: Mikrobiologie. Thieme, Stuttgart 2008, ISBN 978-3-13-144861-3, S. 90.
- ↑ 5,0 5,1 5,2 5,3 Hans G. Schlegel, Georg Fuchs (Hrsg.): Allgemeine Mikrobiologie. 8 Auflage. Thieme, Stuttgart 2007, ISBN 3-13-444608-1, S. 49. Referenzfehler: Ungültiges
<ref>-Tag. Der Name „Fuchs“ wurde mehrere Male mit einem unterschiedlichen Inhalt definiert. - ↑ Jörg Hacker, Gabriele Blum-Oehler: In appreciation of Theodor Escherich. In: Nature Reviews Microbiology. 5, 902, 2007, doi:10.1038/nrmicro1810
- ↑ 7,0 7,1 Hans G. Schlegel, Georg Fuchs (Hrsg.): Allgemeine Mikrobiologie. 8 Auflage. Thieme, Stuttgart 2007, ISBN 3-13-444608-1, S. 38-41.
- ↑ Howard C. Berg, Douglas A. Brown: Chemotaxis in Escherichia coli analysed by Three-dimensional Tracking. In: Nature. 239, S. 500–504 (27 October 1972); doi:10.1038/239500a0
- ↑ Wung-Wai Tso, Julius Adler: Negative Chemotaxis in Escherichia coli. In: J. Bacteriol. May 1974 vol. 118 no. 2, S. 560–576 Abstract
- ↑ Markus Kollmann, Linda Løvdok, Kilian Bartholomé, Jens Timmer, Victor Sourjik: Design principles of a bacterial signalling network. In: Nature. 438, (2005), S. 504–507, doi:10.1038/nature04228
- ↑ Hans G. Schlegel, Georg Fuchs (Hrsg.): Allgemeine Mikrobiologie. 8 Auflage. Thieme, Stuttgart 2007, ISBN 3-13-444608-1, S. 137.
- ↑ Hans G. Schlegel, Georg Fuchs (Hrsg.): Allgemeine Mikrobiologie. 8 Auflage. Thieme, Stuttgart 2007, ISBN 3-13-444608-1, S. 366.
- ↑ 13,0 13,1 Helmut Hahn, Stefan H. E. Kaufmann, Thomas F. Schulz, Sebastian Suerbaum: Medizinische Mikrobiologie Und Infektiologie. 6. Auflage. Springer, 2008, ISBN 978-3-540-46359-7, S. 183, doi:10.1007/978-3-540-46362-7.
- ↑ 14,0 14,1 14,2 14,3 P. J. Quinn, B. K. Markey, F. C. Leonard, P. Hartigan, S. Fanning, E. S. FitzPatrick: Veterinary Microbiology and Microbial Disease. 2. Auflage. John Wiley & Sons, 2011, ISBN 978-1-118-25116-4, S. 266.
- ↑ Angelika Fruth: Biodiversität der O- und H-Antigene von Escherichia coli: serologische und molekulare Identifizierung, Dissertation, 2005, URN: nbn:de:gbv:3-000009394
- ↑ K. Todar: Pathogenic E. coli. Online Textbook of Bacteriology. University of Wisconsin–Madison, Department of Bacteriology
- ↑ 17,0 17,1 17,2 Peter Feng, Stephen D. Weagant: Bacteriological Analytical Manual Chapter 4A: Diarrheagenic Escherichia coli', Februar 2011
- ↑ 18,0 18,1 18,2 Johannes Krämer: Lebensmittel-Mikrobiologie. 5. Auflage. UTB, Stuttgart 2002, ISBN 3-8252-1421-4, S. 53–54.
- ↑ Acid relief for O157:H7 Simple change in cattle diets could cut E. coli infection, USDA and Cornell scientists report.
- ↑ Christoph A. Jacobi, Peter Malfertheiner: Escherichia coli Nissle 1917 (Mutaflor): New Insights into an Old Probiotic Bacterium. In: Digestive Diseases. 2011, S. 600–607, doi:10.1159/000333307.
- ↑ Erin C Hagan, Harry L T Mobley: Uropathogenic Escherichia coli outer membrane antigens expressed during urinary tract infection. In: Infection and Immunity. 75, Nr. 8, 2007, S. 3941–3949, doi:10.1128/IAI.00337-07, PMID 17517861.
- ↑ Matthew A. Croxen & B. Brett Finlay: Molecular mechanisms of Escherichia coli pathogenicity. In: Nature Reviews Microbiology. 2010, S. 26–38, doi:10.1038/nrmicro2265.
- ↑ Asgar Ergin: Periphere CD4-positive T-Zellantworten bei Morbus Crohn und Spondylitis ankylosans nach in vitro-Stimulation mit evolutionär konservierten Proteinen oder mit Pathogenitätsfaktoren von Escherichia coli. Dissertation, 2009, URN: nbn:de:kobv:83-opus-22155
- ↑ Nicolas Barnich u. a.: CEACAM6 acts as a receptor for adherent-invasive E. coli, supporting ileal mucosa colonization in Crohn disease. In: The Journal of Clinical Investigation. 117, Nr. 6, 2007, S. 1566–1574, doi:10.1172/JCI30504, PMID 17525800.
- ↑ 25,0 25,1 25,2 25,3 Helmut Hahn, Stefan H. E. Kaufmann, Thomas F. Schulz, Sebastian Suerbaum: Medizinische Mikrobiologie Und Infektiologie. 6. Auflage. Springer, 2008, ISBN 978-3-540-46359-7, S. 241f, doi:10.1007/978-3-540-46362-7.
- ↑ 26,0 26,1 G. Reiner u. a.: Durch Extraintestinal pathogene Escherichia coli (ExPEC) bedingte haemorrhagische Septikaemie beim Schwein als Differentialdiagnose zur Klassischen Schweinepest – Fallbericht und Literaturübersicht. Haemorrhagic septicaemia in a pig caused by extraintestinal pathogenic Escherichia coli (ExPEC) as a differential diagnosis in classical swine fever–case report and review of the literature.. In: Berl. Münch. Tierärztl. Wschr.. 6, Nr. 3–4, 2010, S. 119–124, doi:10.2376/0005-9366-123-119.
- ↑ 27,0 27,1 27,2 Peter Feng, Stephen D. Weagant, Michael A. Grant: BAM: Enumeration of Escherichia coli and the Coliform Bacteria, Bacteriological Analytical Manual, Chapter 4, Enumeration of Escherichia coli and the Coliform Bacteria, September 2002, FDA
- ↑ Gholamreza Darai, Michaela Handermann, Hans-Günther Sonntag und Lothar Zöller: Lexikon der Infektionskrankheiten des Menschen Erreger, Symptome, Diagnose, Therapie und Prophylaxe. 4. Auflage. Springer, 2012, ISBN 978-3-642-17158-1, S. 295, doi:10.1007/978-3-642-17158-1.
- ↑ Deutsche Gesellschaft für Infektiologie: EHEC und Antibiotikabehandlung, 1. Juni 2011
- ↑ Escherich, T.: Die Darmbakterien des Neugeborenen und Säuglings. In: Fortschr. Med. (1885) 3, S. 515–528, 547-554.
- ↑ Escherichia coli - E. coli. Ole Daniel Enersen, abgerufen am 4. März 2012.
- ↑ Elizabeth Pennisi: Laboratory Workhorse Decoded. In: Science. 277, Nr. 5331, 1997, S. 1432–1434, doi:10.1126/science.277.5331.1432.
- ↑ Daniel H Huson, Daniel C Richter, Christian Rausch, Tobias Dezulian, Markus Franz and Regula Rupp. Dendroscope: An interactive viewer for large phylogenetic trees. In: BMC Bioinformatics. 2007 Nov 22;8(1), S. 460.
- ↑ Oksana Lukjancenko, Trudy Wassenaar, David Ussery: Comparison of 61 Sequenced Escherichia coli Genomes. In: Microbial Ecology. 60, Nr. 4, 2010, S. 708–720, doi:10.1007/s00248-010-9717-3.
- ↑ Patricia Escobar-Páramo, Catherine Giudicelli, Claude Parsot, Erick Denamur: The Evolutionary History of Shigella and Enteroinvasive Escherichia coli Revised. In: Journal of Molecular Evolution. 57, Nr. 2, 2003, S. 140–148, doi:10.1007/s00239-003-2460-3.
- ↑ Olivier Clermont, Stéphane Bonacorsi, und Edouard Bingen: Rapid and Simple Determination of the Escherichia coli Phylogenetic Group, Appl Environ Microbiol. 2000 October; 66(10): 4555–4558. PMC 92342
- ↑ Touchon M, Hoede C, Tenaillon O, Barbe V, Baeriswyl S, et al. (2009) Organised Genome Dynamics in the Escherichia coli Species Results in Highly Diverse Adaptive Paths. PLoS Genet 5(1): e1000344. doi:10.1371/journal.pgen.1000344
- ↑ J. Craig Venter Institute Genomic Sequencing Center for Infectious Diseases: Escherichia coli SECEC SMS-3-5.
- ↑ Atsushi Iguchi, Nicholas R. Thomson, Yoshitoshi Ogura, David Saunders, Tadasuke Ooka, Ian R. Henderson, David Harris, M. Asadulghani, Ken Kurokawa, Paul Dean, Brendan Kenny, Michael A. Quail, Scott Thurston, Gordon Dougan, Tetsuya Hayashi, Julian Parkhill, Gad Frankel: Complete Genome Sequence and Comparative Genome Analysis of Enteropathogenic Escherichia coli O127:H6 Strain E2348/69. In: J. Bacteriol.. 2009, S. 347–354, doi:10.1128/JB.01238-08, PMID 18952797.
- ↑ R. A Welch u. a.: Extensive Mosaic Structure Revealed by the Complete Genome Sequence of Uropathogenic Escherichia Coli. In: Proceedings of the National Academy of Sciences. 99, Nr. 26, 2002, S. 17020–17024, doi:10.1073/pnas.252529799.
- ↑ HAMAP: Escherichia coli O45:K1 (strain S88 / ExPEC) complete proteome.
- ↑ Johnson TJ, Kariyawasam S, Wannemuehler Y, Mangiamele P, Johnson SJ, Doetkott C, Skyberg JA, Lynne AM, Johnson JR, Nolan LK: The genome sequence of avian pathogenic Escherichia coli strain O1:K1:H7 shares strong similarities with human extraintestinal pathogenic E. coli genomes.. In: J Bacteriol.. 2007, PMID 17293413.
- ↑ Kulasekara BR, Jacobs M, Zhou Y, Wu Z, Sims E, Saenphimmachak C, Rohmer L, Ritchie JM, Radey M, McKevitt M, Freeman TL, Hayden H, Haugen E, Gillett W, Fong C, Chang J, Beskhlebnaya V, Waldor MK, Samadpour M, Whittam TS, Kaul R, Brittnacher M, Miller SI: Analysis of the Genome of the Escherichia coli O157:H7 2006 Spinach-Associated Outbreak Isolate Indicates Candidate Genes That May Enhance Virulence. In: Infect. Immun.. 2009, doi:10.1128/IAI.00198-09, PMID 16585510.
- ↑ HAMAP: Escherichia coli O81 (strain ED1a) complete proteome
- ↑ HAMAP: Escherichia coli O6:K15:H31 (strain 536 / UPEC) complete proteome.
- ↑ Perna NT, Plunkett G 3rd, Burland V, Mau B, Glasner JD, Rose DJ, Mayhew GF, Evans PS, Gregor J, Kirkpatrick HA, Pósfai G, Hackett J, Klink S, Boutin A, Shao Y, Miller L, Grotbeck EJ, Davis NW, Lim A, Dimalanta ET, Potamousis KD, Apodaca J, Anantharaman TS, Lin J, Yen G, Schwartz DC, Welch RA, Blattner FR: Genome sequence of enterohaemorrhagic Escherichia coli O157:H7. In: Nature. 409, Nr. 6819, 2001, S. 529–533, doi:10.1038/35054089.
- ↑ Valerie Burland, Ying Shao, Nicole T Perna, Guy Plunkett, Frederick R Blattner, Heidi J Sofia: The Complete DNA Sequence and Analysis of the Large Virulence Plasmid of Escherichia Coli O157:H7. In: Nucleic Acids Research. 26, Nr. 18, 1998, S. 4196–4204, doi:10.1093/nar/26.18.4196.
- ↑ Kulasekara BR, Jacobs M, Zhou Y, Wu Z, Sims E, Saenphimmachak C, Rohmer L, Ritchie JM, Radey M, McKevitt M, Freeman TL, Hayden H, Haugen E, Gillett W, Fong C, Chang J, Beskhlebnaya V, Waldor MK, Samadpour M, Whittam TS, Kaul R, Brittnacher M, Miller SI: Analysis of the Genome of the Escherichia coli O157:H7 2006 Spinach-Associated Outbreak Isolate Indicates Candidate Genes That May Enhance Virulence. In: Infect. Immun.. 2009, doi:10.1128/IAI.00198-09, PMID 16585510.
- ↑ HAMAP: Escherichia coli O139:H28 (strain E24377A / ETEC) complete proteome.
- ↑ HAMAP: Escherichia coli (strain 55989 / EAEC) complete proteome
- ↑ HAMAP: Escherichia coli O8 (strain IAI1) complete proteome
- ↑ Kenshiro Oshima u. a.: Complete Genome Sequence and Comparative Analysis of the Wild-Type Commensal Escherichia Coli Strain SE11 Isolated from a Healthy Adult. In: DNA Research. 15, Nr. 6, 2008, S. 375–386, doi:10.1093/dnares/dsn026.
- ↑ Yoshitoshi Ogura u. a.: Comparative Genomics Reveal the Mechanism of the Parallel Evolution of O157 and Non-O157 Enterohemorrhagic Escherichia Coli. In: Proceedings of the National Academy of Sciences. 106, Nr. 42, 2009, S. 17939–17944, doi:10.1073/pnas.0903585106.
- ↑ HAMAP: Escherichia coli (strain ATCC 8739 / DSM 1576 / Crooks) complete proteome
- ↑ HAMAP: Escherichia coli (strain B / BL21-DE3) complete proteome
- ↑ Thomas Ferenci u. a.: Genomic Sequencing Reveals Regulatory Mutations and Recombinational Events in the Widely Used MC4100 Lineage of Escherichia Coli K-12. In: Journal of Bacteriology. 191, Nr. 12, 2009, S. 4025–4029, doi:10.1128/JB.00118-09.
- ↑ Koji Hayashi u. a.: Highly accurate genome sequences of Escherichia coli K-12 strains MG1655 and W3110. In: Molecular Systems Biology. 2, Nr. 1, 2006, doi:10.1038/msb4100049.
- ↑ HAMAP: Escherichia coli (strain K12 / DH10B) complete proteome
- ↑ HAMAP: Escherichia coli O9:H4 (strain HS) complete proteome.
- ↑ HAMAP: Escherichia coli O17:K52:H18 (strain UMN026 / ExPEC) complete proteome.
- ↑ Martina Bielaszewska u. a.: Characterisation of the Escherichia coli strain associated with an outbreak of haemolytic uraemic syndrome in Germany, 2011: a microbiological study. In: The Lancet Infectious Diseases. 2011, doi:10.1016/S1473-3099(11)70165-7.
- ↑ R. E. Lenski: Evolution in action: a 50,000-generation salute to Charles Darwin. In: Microbe. 6, 2011, S. 30–33. PDF
- ↑ Roberto, Francisco F., Joni M. Barnes, und Debby F. Bruhn: Evaluation of a GFP reporter gene construct for environmental arsenic detection. In: Talanta. 2002, S. 181–188, doi:10.1016/S0039-9140(02)00266-7.
- ↑ 64,0 64,1 Eugene Russo: Special Report: The birth of biotechnology. In: Nature Jobs. 2003, S. 456, 456–457, doi:10.1038/nj6921-456a.
- ↑ Fermentas: pUC18, pUC19 DNA
- ↑ Agilent Technologies Genomics: ArcticExpress Competent Cells - Details & Specifications
- ↑ Alan Greener, Marie Callahan und Bruce Jerpseth: An Efficient Random Mutagenesis Technique Using an E. coli Mutator Strain, In Vitro Mutagenesis Protocols. In: Methods in Molecular Biology. 1996, Volume 57, S. 375–385, doi:10.1385/0-89603-332-5:375
- ↑ T. A. Brown: Gentechnologie für Einsteiger. 3. Auflage. Spektrum Verlag, Heidelberg 2002, ISBN 3-8274-1302-8.
- ↑ G. Walsh: Biopharmaceutical benchmarks. In: Nat Biotechno. (2006) 24, S. 769–776. PMID 16841057
- ↑ Scaled-down genome may power up E. coli's ability in lab, industry. In: Biology News Net. 28. April 2006 (englisch)
- ↑ Yi-Xin Huo, Kwang Myung Cho, Jimmy G Lafontaine Rivera, Emma Monte, Claire R Shen, Yajun Yan, James C Liao: Conversion of proteins into biofuels by engineering nitrogen flux. In: Nature Biotechnology. 29 (2011), S. 346–351, doi:10.1038/nbt.1789
- ↑ Shota Atsumi, Taizo Hanai, James C. Liao1: Non-fermentative pathways for synthesis of branched-chain higher alcohols as biofuels. In: Nature. 451, (3 January 2008), S. 86–89, doi:10.1038/nature06450
- ↑ NASA: Bigelow Spacecraft Carries NASA 'GeneBox' to Orbit.