Polychlorierte Dibenzodioxine und Dibenzofurane
Polychlorierte Dibenzo-p-dioxine und Dibenzofurane (PCDD/PCDF) sind zwei Gruppen von chemisch ähnlich aufgebauten chlorierten organischen Verbindungen. Sie werden im allgemeinen Sprachgebrauch und teilweise auch in der Literatur als Dioxine – oder fälschlich als Dioxin (Singular) – zusammengefasst.
Genese
Dioxine entstehen unvermeidlich als Nebenprodukte bei der Herstellung chlororganischer Chemikalien oder bei beliebigen Oxidationsreaktionen von Kohlenwasserstoffverbindungen in Anwesenheit von Chlorverbindungen (beispielsweise Kochsalz NaCl). In der Regel entstehen nachweisbare Konzentrationen von Dioxinen bei Verbrennungen mit Temperaturen oberhalb 300°C (Assoziation der Dioxinmoleküle) und unterhalb von 700°C (Dissoziation der Dioxinmoleküle).
Durch technische Maßnahmen, beispielsweise den Einbau von Filtern in Müllverbrennungsanlagen und durch Nachverbrennung in den Abgasströmen, kann der Ausstoß von PCDD/PCDF erheblich verringert werden. Allerdings ist die Verbreitung solcher Maßnahmen von Land zu Land unterschiedlich. Die gesetzlichen Anforderungen zur Überwachung der Dioxingehalte in Mischprodukten sind in den meisten Ländern schwach.
Als langlebige organische Schadstoffe werden sie in der Umwelt bei niedrigen Temperaturen kaum abgebaut. Spuren von polychlorierten Dioxinen und Furanen kommen überall auf der Welt vor.[1] Über die Nahrungskette reichern sich Dioxine in lebenden Organismen, bei Wirbeltieren vor allem in der Leber als dem Entgiftungsorgan der Stoffwechselkreisläufe an.
Der Mensch nimmt Dioxine vor allem über tierische Nahrungsmittel (Fisch, Fleisch, Eier, Milchprodukte) auf. Ein wichtiger Indikator für die Belastung von Menschen ist die Konzentration in der Muttermilch.[2]
Überblick über die Gruppe
Die giftigste Einzelverbindung unter den Dioxinen ist das sogenannte „Sevesodioxin“ (2,3,7,8-Tetrachlordibenzodioxin, kurz 2,3,7,8-TCDD). Die akute Giftigkeit der übrigen polychlorierten Dibenzodioxine und Dibenzofurane wird relativ zu 2,3,7,8-TCDD angegeben. Polychlorierte Dioxine und Furane können bereits in geringen Mengen die Entstehung von Krebs aus vorgeschädigten Zellen fördern.
Die Mitglieder der beiden Stoffgruppen besitzen entweder ein Dibenzodioxin- (zwei Benzolringe, die über zwei Sauerstoffbrücken verknüpft sind) oder ein Dibenzofuran-Grundgerüst (zwei Benzolringe sind über ein Sauerstoffatom sowie direkt verbunden; dies entspricht einer zentralen Furan-Einheit). An diese Grundkörper können jeweils bis zu 8 Chlor- oder andere Halogen-Atome gebunden sein. Die Anzahl der Chloratome und ihre Position an den Benzolringen beeinflussen die Toxizität, die krebserzeugende Wirkung und die Abbaubarkeit von polychlorierten Dibenzodioxinen und Dibenzofuranen.
| Chloratome | PCDD-Isomere | PCDF-Isomere |
|---|---|---|
| 1 | 2 | 4 |
| 2 | 10 | 16 |
| 3 | 14 | 28 |
| 4 | 22 | 38 |
| 5 | 14 | 28 |
| 6 | 10 | 16 |
| 7 | 2 | 4 |
| 8 | 1 | 1 |
| Total | 75 | 135 |
„Dioxine“ kommen meist als Gemisch verschiedener halogenierter Dibenzodioxine und Dibenzofurane vor. Dieses Gemisch kann ein bestimmtes Häufigkeitsmuster (Kongenerenmuster) aufweisen, aus dem sich Rückschlüsse auf die Entstehungsursachen ziehen lassen.
Neben den polychlorierten Dibenzodioxinen und Dibenzofuranen (PCDD/PCDF) gibt es Dioxine, an deren Benzolringe andere Halogenatome gebunden sind. Von Bedeutung sind die polybromierten Dibenzodioxine und -furane (PBDD/PBDF). Dagegen werden polyfluorierte und polyiodierte Dibenzodioxine und Dibenzofurane unter Praxisbedingungen so gut wie nicht gebildet. All diese Verbindungen werden unter dem Oberbegriff polyhalogenierte Dibenzodioxine und Dibenzofurane (PXDD/PXDF) zusammengefasst. Berücksichtigt man alle denkbaren Kombinationen, umfassen die polychlorierten Dibenzodioxine 75 und die polychlorierten Dibenzofurane 135 verschiedene Einzelstoffe, sogenannte Kongenere. Werden alle möglichen Kombinationen von mit Chlor- und Bromatomen mischhalogenierten Kongeneren mit einbezogen, gibt es 1700 verschiedene Dibenzodioxine und 3320 Dibenzofurane.[3]
Schreibweisen
Nach IUPAC wird das Grundgerüst der Dioxine mit Dibenzo[b,e][1,4]dioxin, abgekürzt Dibenzo-p-dioxin, das der Furane mit Dibenzofuran bezeichnet. Diesen Bezeichnungen werden die Positionen der Chlor- oder Halogenatome (siehe Abbildungen ganz oben), gefolgt von ihrer Anzahl und Art vorgestellt (Beispiel: 1,2,4,6,8,9-Hexachlordibenzo[b,e][1,4]dioxin).
Eine vereinfachte Schreibweise lehnt sich an die IUPAC-Nomenklatur an und kürzt Dibenzo-p-dioxin mit DD, Dibenzofuran mit DF ab. Das mischhalogenierte 1,3,6,8-Tetrabrom-2,7-dichlordibenzo-p-dioxin wird danach verkürzt als 1,3,6,8-Br4-2,7-Cl2-DD geschrieben. In der Literatur wird das wegen seiner Giftigkeit besonders interessierende Kongener 2,3,7,8-Cl4DD oft mit 2,3,7,8-TCDD oder TCDD abgekürzt.
Einem anderen Vorschlag zufolge kann chlorierten Dioxinen (D) und Furanen (F) aufsteigend nach der Anzahl ihrer Chlorsubstituenten eine fortlaufende Nummer zugewiesen werden. Danach wird 2,3,7,8-Cl4DD als D 48, 2,3,7,8-Cl4DF als F 83 bezeichnet. Auch die Gruppen mit gleicher Anzahl an Chloratomen (Homologengruppen) können nach diesem System benannt werden, indem dem D oder F eine Zahl für den Chlorierungsgrad nachstellt wird. Die Gruppe der vierfach chlorierten Dioxine wird so zu D4 (keine Leerstelle), die Gruppe der fünffach chlorierten Furane zu F5. Dieses System wird gelegentlich zur Beschriftung von Tabellen und Chromatogrammen verwendet.[3]
Geschichte
Die erste Synthese von Oktachlordibenzodioxin wurde vermutlich 1872 durchgeführt. In den 1950er Jahren wurde nachgewiesen, dass 2,3,7,8-Tetrachlordibenzodioxin Chlorakne verursacht.[4][5][6]
Während des Vietnam-Kriegs setzten die Streitkräfte der Vereinigten Staaten dioxinverunreinigte Entlaubungsmittel wie Agent Orange ein, die bei der vietnamesischen Bevölkerung und bei den eigenen Soldaten zu gesundheitlichen Problemen geführt haben sollen. Berichte über eine erhöhte Anzahl an Missbildungen bei Neugeborenen in der vietnamesischen Bevölkerung und bei den Kindern von Vietnam-Veteranen sowie ein erhöhtes Krebsrisiko als Folge der Entlaubungsaktionen sind in der wissenschaftlichen Literatur umstritten.[7][8] Eine neuere Analyse existierender Studien kommt allerdings zu dem Schluss, dass elterliche Agent-Orange-Exposition tatsächlich und dosisabhängig kindliche Missbildungen hervorruft.[9]
Massenvergiftungen (Yusho-Krankheit) durch mit polychlorierten Dibenzofuranen und PCBs belastetes Reisöl traten 1968 in Japan (Yusho) und 1979 in Taiwan (Yucheng) auf.
Mit dem Austritt von 2,3,7,8-Tetrachlordibenzodioxin aus einem Reaktor der Chemiefabrik Icmesa im italienischen Seveso am 10. Juli 1976 (Sevesounglück) erlangte die Stoffgruppe der Dioxine allgemeine Bekanntheit. Ursache für das Unglück war ein durch Überhitzung entstandener Überdruck im Produktionssystem.[10] Tage nach dem Unglück starben in der näheren Umgebung Vögel und Kleintiere. Bei etwa 190 exponierten Personen wurden Fälle von Chlorakne festgestellt. Als Folge des Unfalls mussten die Häuser von 40 Familien abgerissen werden.[11] Viele Seveso-Opfer erkrankten später an Krebs oder Diabetes. Die Lebenserwartung der Giftopfer liegt im Schnitt um 15 Jahre unter dem Landesdurchschnitt in Italien.
In den USA erregten die Giftmüllskandale von Love Canal (ab 1978) und Times Beach (ab 1982) großes Aufsehen in den Medien.
Vor 1968 wurden in Deutschland mehr als 400.000 Tonnen Schlacke aus der Kupfergewinnung unter der Handelsbezeichnung Kieselrot als Belag für Sport- und Spielplätze verwendet. Erst 1991 entdeckte man, dass Kieselrot stark mit polychlorierten Dibenzodioxinen und Furanen belastet ist. Die Grenzwerte, die das Umweltbundesamt für Dioxine vorgibt, wurden bei diesem Material um das bis zu 10.000-fache überschritten. Sportflächen mit Kieselrot-Deckschicht können bedeutende Dioxinquellen für die nähere Umgebung gewesen sein.[12]
In der süd-slowenischen Region Bela krajina wurde der Fluß Krupa durch unsachgemäß gelagerte Abfälle aus einer Kondensatorenfabrik (Isolatorenmaterial) mit Dioxinen verseucht. Es kam unter anderem zu Mißgeburten unter Tieren. Die Verschmutzung wurde im Jahre 1984 rein zufällig von Wissenschaftlern des Gesundheitsamtes in Maribor und später auch in Ljubljana erkannt, als man die Quelle der Krupa untersuchte, um diese zur Trinkwassergewinnung für die Bela krajina zu nutzen. Besonders problematisch ist die Tatsache, dass es sich hier um eine Karstlandschaft handelt. Noch heute ist die Belastung alarmierend hoch und kann im Rahmen des regelmäßigen Monitorings in Bodenproben, Fischen, im Wasser, in Haustieren usw. nachgewiesen werden.[13]
Nach dem Inkrafttreten der Stockholmer Konvention 2004 sind die Emission von PCDD/PCDF in die Umwelt durch die Anwendung der besten verfügbaren Techniken so weit wie möglich zu verringern oder zu verhindern.[14]
Im Juni 1998 wurde bei zwei Mitarbeiterinnen des Wiener Textilforschungsinstituts eine schwere Dioxinvergiftung festgestellt, drei weitere Mitarbeiter wiesen erhöhte Dioxinkonzentrationen im Blut auf. Die Umstände des Vorfalls konnten bisher nicht geklärt werden.[15] Im September 2004 wurde der ukrainische Oppositionspolitiker Wiktor Juschtschenko Opfer einer Dioxinvergiftung.
Jährlich findet DIOXIN, ein internationaler wissenschaftlicher Kongress über Dioxine und andere langlebige Organohalogene statt, 2011 bereits zum 31. Mal.[16]
Eigenschaften

Dioxin- und Furan-Moleküle sind fast vollkommen planar. Bei den 2,3,7,8-substituierten Dioxinen ähnelt das Molekül einem flachen, länglichen Rechteck mit einer Länge von 10 Å und einer Breite von 3 Å. Mit Ausnahme der Wasserstoff-Atome ragt beim 2,3,7,8-Cl4DD kein Atom mehr als 0,018 Å aus der Molekülebene heraus.
Bei Raumtemperatur sind Dioxine farblose, kristalline Feststoffe. Sie sind schwerflüchtig, wobei der Sättigungsdampfdruck noch weiter zurückgeht, je mehr Halogenatome im Molekül enthalten sind. Ihre Löslichkeit in Wasser ist äußerst gering, sie nimmt mit zunehmendem Halogenierungsgrad ab und steigt mit zunehmender Temperatur an. Dioxine lösen sich einigermaßen gut in organischen Lösungsmitteln wie Benzol, Anisol und Xylol. Sie sind lipophile (fettlösliche) Substanzen und reichern sich aufgrund ihres hohen Oktanol-Wasser-Verteilungskoeffizienten (KOW) im Fettgewebe, aber auch in Sedimenten und Böden an.[3] Ihre chemische Persistenz, beispielsweise gegenüber Säuren und Basen, ist sehr hoch.[5]
| 1-Cl1DD | 2-Cl1DD | 2,3-Cl2DD | 2,3,7,8-Cl4DD | Cl8DD | |
|---|---|---|---|---|---|
| Schmelzpunkt | 105 °C | 163 °C | 305 °C | 330 °C | |
| Siedepunkt | 315 °C | 358 °C | 447 °C | 510 °C | |
| Sättigungsdampfdruck über der unterkühlten Schmelze (25 °C) | 1,0 · 10−1 Pa | 9,3 · 10−3 Pa | 1,2 · 10−4 Pa | 2,8 · 10−7 bzw. 1,2 · 10−7 Pa | |
| Wasserlöslichkeit (25 °C) | 278.000–318.000 ng/l | 8–200 bzw. 690 ng/l | 0,074 bzw. 0,4 (20 °C) ng/l | ||
| log KOW | 5,00 | 5,60 | 6,80 bzw. 6,64 | 8,20 bzw. 8,60 |
Entstehung
Dioxine werden, außer für Forschung und Analytik, nicht gezielt hergestellt. Sie entstehen als Nebenprodukte bei einer Vielzahl von thermischen Prozessen. Es gibt keinerlei technische Verwendung von Dioxinen.
Bei der Verbrennung von organischen (kohlenstoffhaltigen) Verbindungen in Gegenwart von organischen oder anorganischen Halogenverbindungen (speziell Chlor oder Brom) können sie sich in einem bestimmten Temperaturbereich (Dioxin-Fenster: etwa 300–600 °C) bilden.[17] Verbrennungsprozesse mit möglicher Dioxinbildung sind beispielsweise die Feuerbestattung in Krematorien und die Müllverbrennung, die bis in die 1980er Jahre eine der Hauptursachen für die Dioxinerzeugung war. Derlei Immissionen sind im Bundes-Immissionsschutzgesetz bzw. den resultierenden Bundes-Immisionschutz-Verordnungen (BImSchV) geregelt. Mit der 17. Verordnung von 1990 (17. BImSchV, für Anlagen zur thermischen Abfallbehandlung) und der 27. Verordnung (27. BImSchV, für Anlagen zur Feuerbestattung) zur Durchführung des Bundes-Immissionsschutzgesetzes wurden jedoch für industrielle Verbrennungsanlagen und Krematorien neue Grenzwerte eingeführt, wodurch die Dioxinbelastung durch Müllverbrennungsanlagen und die Feuerbestattung heute praktisch null ist.
Bis Anfang der 1990er-Jahre enthielten auch die Abgase von Benzinmotoren in Kraftfahrzeugen und Flugzeugen polychlorierte (aber auch andere polyhalogenierte) Dibenzodioxine und Dibenzofurane. Grund dafür waren die den verbleiten Ottokraftstoffen zugesetzten Verflüchtigungszusätze auf Basis von 1,2-Dichlorethan oder 1,2-Dibromethan, die Bleiablagerungen im Motor („Brückenbildung“ an den Zündkerzen) durch die bei der Verbrennung der Bleialkyle entstehenden Bleioxide verhindern sollten. Erst mit der 19. Verordnung zum Bundes-Immissionsschutzgesetz (19. BImSchV) vom 17. Januar 1992 wurde diese Dioxinquelle durch das Verbot der Beimischung von Chlor- und Bromverbindungen als Kraftstoffzusätze beseitigt.
Weitere industrielle Prozesse, bei denen Dioxine entstehen können, sind beispielsweise:
- Bleichprozesse mit Chlor in der Papierherstellung
- die Herstellung von Pflanzenschutzmitteln
- metallurgische Prozesse (z. B. Eisen- und Stahlherstellung)
- Herstellung von Chlorphenolen.
Kritisch ist vor allem die Hitzeeinwirkung auf polychlorierte Phenole. Besonders leicht kondensieren diese in Gegenwart von Alkali über die Phenolate zu Dioxin, wie am Beispiel des Seveso-Giftes 2,3,7,8-TCDD, gebildet aus dem Natriumsalz von 2,4,5-Trichlorphenol (2,4,5-TCP):
Auch natürliche Prozesse können zur Bildung von Dioxinen führen, z. B. durch Blitzschlag verursachte Wald- oder Steppenbrände sowie mikrobielle Tätigkeiten oder Vulkanausbrüche. Es wird geschätzt, dass bei einem Waldbrand etwa 20 ng Toxizitätsäquivalente an Dioxinen pro kg Biomasse entstehen. Im Vergleich zu den anthropogenen Emissionen tragen natürliche Quellen nur in geringem Maß zur Dioxinbelastung der Umwelt bei.[3]
Beim mikrobiellen Abbau des Holzgerüststoffes Lignin und von Huminsäuren entstehen chlorierte Phenole, welche sowohl unter den Zersetzungbedingungen als auch im Fall von Feuereinwirkung zu Dioxinen kondensieren können.
Emissionen
Dioxine entweichen aus Anlagen der Metallindustrie, aus Müllverbrennungsanlagen und privaten Kaminen in die Luft. Die Emissionen haben in den letzten Jahren jedoch deutlich abgenommen. Dieser Erfolg ist vor allem auf die verbesserte Rauchgasreinigung in den Müllverbrennungsanlagen zurückzuführen. Die – illegale – Abfallverbrennung im Kamin oder im Garten macht heute den bedeutendsten Anteil der Dioxinemissionen aus. Die wilde Verbrennung von einem Kilogramm Abfall belastet die Umwelt so stark wie die Entsorgung von zehn Tonnen in einer modernen Müllverbrennungsanlage.[18]
| Prozess | Emissionen | Anteil | |
|---|---|---|---|
| 2004 | 2008 | ||
| Metallindustrie und Röst- oder Sinteranlagen für Metallerz, Anlagen zur Gewinnung von Eisenmetallen und Nichteisenmetallen | 575 g/Jahr | 47 % | |
| Herstellung und Verarbeitung von Metallen | 361 g | ||
| Organische chemische Grundstoffe | 202 g/Jahr | 17 % | |
| Chemische Industrie | 6,6 g | ||
| Anlagen zur Entsorgung oder Verwertung von gefährlichen Abfällen oder Siedlungsmüll | 178 g/Jahr | 15 % | |
| Abfall- und Abwasserbewirtschaftung | 52,9 g | ||
| Verbrennungsanlagen | 163 g/Jahr | 13 % | |
| Energiesektor | 661 g | ||
| Anlagen zur Herstellung von Zementklinkern, Kalk, Glas, Mineralien oder keramischen Erzeugnissen | 63 g/Jahr | 5 % | |
| Mineral verarbeitende Industrie | 42,6 g | ||
| Sonstiges | 38 g/Jahr | 66,3 g | 3 % |
Das unsachgemäße Recycling von Elektrogeräten kann zu bedeutenden Emissionen von Dioxinen führen. In Guiyu, dem größten Elektronikschrott-Recyclinggebiet von China[21], wurden mit bis zu 2765 pg/m3 oder 48,9 pg TEQ/m3 die höchsten je gemessenen Dioxinkonzentrationen in der Atmosphäre festgestellt.[22]
Umweltverhalten
Dioxine sind persistent (langlebig) und werden hauptsächlich über den Luftpfad, gebunden an Staubpartikel, in der Umwelt verteilt. Sie sind ubiquitär nachzuweisen, kommen also überall auf der Welt in Böden, Gewässern, Sedimenten, Pflanzen, Tieren, Menschen etc. vor.
Der Eintrag von Dioxinen und Furanen in die Atmosphäre erfolgt in erster Linie mit dem Rauch von Verbrennungsprozessen. Daneben spielt die Verdampfung von an Böden angelagerten (adsorbierten) oder im Wasser gelösten Molekülen eine Rolle. Über die Atmosphäre werden Dioxine und Furane großflächig verteilt (Ferntransport), so dass sie selbst in Umweltproben aus entlegenen Regionen gefunden werden können. Niedrig halogenierte Dioxine kommen in der Atmosphäre überwiegend in der Gasphase vor, höher halogenierte sind zum größten Teil an Aerosol-Partikel gebunden. Das Mengenverhältnis von gasförmigen zu partikelgebundenen Molekülen wird für die Cl4DF mit 13, für Cl8DF mit 0,05 angegeben.
Ein Abbau in der Atmosphäre findet lediglich bei gasförmig vorliegenden Dioxinen und Furanen statt. Durch UV-Strahlen kommt es zur direkten Photolyse, daneben sind auch Reaktionen mit Hydroxyl-Radikalen von Bedeutung. Den atmosphärischen Abbaureaktionen unterliegen vor allem an den peri-Positionen (1,4,6,9) substituierte PCDD sowie an Position 1 und 9 substituierte PCDF. Mit zunehmendem Halogenierungsgrad sinkt dagegen die Anfälligkeit für diese Abbaumechanismen.
Als Austragsweg aus der Atmosphäre überwiegt die trockene Deposition durch Absetzen (Fall Out) von Partikeln gegenüber der nassen Deposition etwa im Verhältnis 5:1. Bei der nassen Deposition überwiegt das Ausregnen (Particle Scavenging) gegenüber dem Auswaschen (Gas Scavenging).
In Gewässer gelangen Dioxine und Furane vor allem durch Deposition aus der Atmosphäre und mit dem Abwasser. Als lipophile Verbindungen lagern sie sich zu einem großen Teil an im Wasser gelöste Kolloide wie Huminstoffe, an im Wasser schwebende (suspendierte) organische Partikel oder die lipophile Kahmhaut auf dem Wasser an. Frei im Wasser gelöste PCDD/PCDF können sich in die Atmosphäre verflüchtigen, unmittelbar an der Wasseroberfläche findet ein Abbau durch Photolyse statt. An Partikel gebundene Dioxine und Furane werden zum größten Teil in den Sedimenten abgelagert. Anhand von zeitlichen Trends der Konzentrationen in datierten Sedimentkernen können Rückschlüsse auf historische Emissionen gemacht werden. Allerdings muss beachtet werden, dass sich die Kongenerenmuster durch verschiedene Abbauprozesse (z. B. reduktive Dehalogenierung) verändern können. Der Anteil von niedrig chlorierten PCDD/PCDF kann daher über längere Zeiträume zunehmen. Trotzdem kann aufgrund der vor dem Jahr 1900 dominierenden niedrig chlorierten PCDDs geschlossen werden, dass in dieser Zeit der Eintrag durch die Dimerisierung von 2,4-Dichlorphenol groß war. Seit etwa den 1960er Jahren sind die Einträge von PCDD und PCDF in das Esthwaite Water in Nordengland rückläufig (siehe Grafiken rechts).[23] Dies ist vor allem auf technische Maßnahmen in der Industrie und bei der Müllverbrennung zurückzuführen.
Die Belastung des Bodens geht überwiegend auf atmosphärische Deposition zurück, auf Wiesen und Feldern können daneben das Ausbringen von Klärschlamm oder Pflanzenschutzmitteln beigetragen haben. Dioxine und Furane adsorbieren an die organische Bodensubstanz und werden dort weitgehend zurückgehalten. Sie sind vor allem in den obersten fünf Zentimetern anzutreffen, eine Verlagerung in die Tiefe findet wegen der geringen Wasserlöslichkeit kaum statt. Böden sind neben den Sedimenten die wichtigste Senke für PCDD/PCDF. Die Halbwertszeiten im Boden liegen im Bereich von Jahren bis Jahrzehnten. Austrags- oder Abbauprozesse, wie etwa Verflüchtigung, Photolyse an der Bodenoberfläche, Abbau durch Mikroorganismen und Pilze oder die Aufnahme in Pflanzen verlaufen sehr langsam. Der Dehalococcoides-Stamm CBDB1 baute in Laborversuchen beispielsweise in 56 Tagen 60 % von 1,2,3-Trichlordibenzodioxin zu 2-Monochlordibenzodioxin ab, was in der Umwelt jedoch nicht erreicht wird.[24] Durch Bodenerosion können adsorbierte Dioxine in nennenswertem Umfang ausgetragen werden.
In oder auf Pflanzen gelangen Dioxine und Furane hauptsächlich über die Luft, durch Diffusion aus der Gasphase oder die bereits erwähnten Mechanismen der trockenen und nassen Deposition. Sie befinden sich hauptsächlich in den Blättern und Nadeln. Pflanzenfressende Tiere nehmen Dioxine über das Futter auf. Da sie dabei oft geringe Mengen der meist stärker als die Pflanzen belasteten Bodenpartikel mitfressen, kann das merklich zur Gesamtaufnahme beitragen. Dioxine und Furane werden überwiegend in Leber und Fettgewebe eingelagert und reichern sich im Verlauf der Nahrungskette immer stärker an. Im Wasser sind gelöste oder an Schwebstoffe gebundene Dioxine besonders gut für Kleinlebewesen verfügbar, daher reichern sie sich dort über die Nahrungsketten stark an.[3]
Belastung von einzelnen Lebensmitteln und Muttermilch
Hühner in Freilandhaltung nehmen Dioxine und Furane hauptsächlich durch das Aufpicken von Bodenpartikeln auf. In den Eiern kommen diese Substanzen aufgrund ihrer Fettlöslichkeit überwiegend im Eidotter vor, das zu einem Drittel aus Fett besteht. Seit Januar 2005 gilt für Eier EU-weit ein Dioxin-Grenzwert von 3 pg TEQ Dioxinen/g Fett oder 6 pg TEQ/g Fett für Dioxine und dioxinähnliche PCB. Bei Stichproben waren Eier von Hühnern in Freilandhaltung meist stärker mit Dioxinen belastet als Eier aus Boden- oder Käfighaltung. Die Grenzwerte werden bei Freilandhaltung gelegentlich überschritten.[25][26]
Daneben können Nutztiere Dioxine durch verunreinigte Futtermittel aufnehmen. So mussten im Mai 2010 in Deutschland mehrere Legehennenbetriebe geschlossen werden, nachdem kontaminierter Mais zu Biofutter verarbeitet wurde.[27] Im Dezember 2010 wurden erneut belastete Proben von Eiern und Geflügelfleisch gefunden.[28] Als Quelle der Dioxinkontamination erwies sich der Futtermittelproduzent Harles und Jentzsch, der für die Herstellung von Tierfutterfetten technische Fette aus der Biodieselproduktion verwendet hatte. Nach Schätzungen der Bundesregierung wurden bis zu 3000 Tonnen belastetes Tierfutterfett hergestellt und an Legehennen, Mastschweine und Mastgeflügel verfüttert.[29]
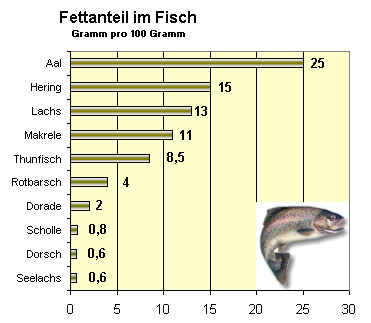
Fische sind oft stark mit Dioxinen belastet, das gilt insbesondere für Fische mit einem hohen Fettgehalt. Besonders häufig werden die EU-Grenzwerte (4 pg TEQ Dioxine/g Frischgewicht oder 8 pg TEQ der Summe aus Dioxinen und dioxinähnlichen PCB) bei Fischen aus dem Ostseegebiet überschritten. In Schweden und Finnland gilt eine Ausnahmeregelung, nach der Lachs, Hering, Flussneunauge, Bachforelle, Saiblinge sowie Rogen der Kleinen Maräne in den Verkehr gebracht werden dürfen, selbst wenn sie die Dioxingrenzwerte der EU überschreiten. Die Verbraucher müssen über das damit verbundene Gesundheitsrisiko informiert werden. Außerdem muss sichergestellt werden, dass die Ware nicht in andere Länder gelangt.[30]
Da Dioxine sehr lipophil (fettlöslich) sind, reichern sie sich bei Menschen und Tieren insbesondere im Fettgewebe an. Als Indikator für die Dioxin-Belastung von Menschen wird häufig Muttermilch untersucht,[2] da sich aufgrund des hohen Fettgehaltes Dioxine darin anreichern und Proben leicht zu bekommen sind. Der Nachweis von Dioxinen in Muttermilch gelang schwedischen Wissenschaftlern erstmals 1984, die Kieler Bundesanstalt für Milchforschung stellte 1985 fest, dass in Muttermilch die Dioxin-Richtwerte für Kuhmilch häufig überschritten wurden. Es wurde empfohlen, Säuglinge nicht länger als ein halbes Jahr zu stillen.[31] Bedingt durch gesetzliche Regelungen und daraus resultierende technische Maßnahmen ist in Mitteleuropa die Gesamtbelastung durch Dioxine deutlich zurückgegangen.
1988 betrug in urbanen Gegenden der EU die durchschnittliche Belastung von Muttermilch mit PCDD/PCDF 29,5 pg I-TEQ pro Gramm Milchfett. Bis 1993 sank die Belastung um ein Drittel auf 19,2 pg I-TEQ pro Gramm Milchfett.[32]
Toxikologie
Aufnahme und Stoffwechsel
Da Dioxine allgegenwärtig sind, lässt sich ihre Aufnahme nicht vermeiden. Beim Menschen erfolgt die Aufnahme von Dioxinen zu 90–95 % über die Nahrung[33], besonders über fetthaltige tierische Lebensmittel wie Milchprodukte, Fleisch und Fisch, aber auch Gemüse.[34] In Schweden beträgt die Aufnahme durch die Nahrung rund 100 pg I-TEQ/Tag, wovon die Hälfte auf den Verzehr von Fisch und Meeresfrüchten zurückzuführen ist.[35] Die durchschnittliche Dioxin-Aufnahme von US-Amerikanern liegt heute mit etwa 1 pg TEQ/kg Körpergewicht und Tag in derselben Größenordnung. Säuglinge nehmen im Schnitt täglich 35–53 pg TEQ/kg Körpergewicht auf. Dank einer höheren Ausscheidungsrate und durch ihr Wachstum sind die Dioxin-Gehalte im Gewebe von Säuglingen aber nur etwa dreimal höher als bei Erwachsenen.[36]
Dioxine können über die Lunge aufgenommen werden, insbesondere wenn sie an Feinstaub gebunden sind. Aus der Luft nehmen Menschen täglich normalerweise 2–6 pg I-TEQ auf, etwa 5 % der Gesamtaufnahme. Beim Rauchen einer Zigarette entstehen etwa 0,1 pg I-TEQ PCDD/PCDF, weshalb starke Raucher über die Lunge etwas mehr resorbieren. Eine Aufnahme über die Haut ist zwar möglich, sie spielt aber nur bei außergewöhnlich hoher Dioxinbelastung eine Rolle.[3]
Im Körper werden aufgenommene Dioxine und Furane an die Lipide und Lipoproteine des Blutes angelagert und weiterverteilt. Sie reichern sich vor allem im Fettgewebe und in der Leber an. Beim Menschen enthält das Fettgewebe etwa 30 ng I-TEQ/kg. Im Fett eingelagerte Dioxine sind biologisch inaktiv, sie werden erst beim Abbau des Fetts wieder freigesetzt. Das ist insbesondere für die Belastung von Säuglingen über die Muttermilch von Bedeutung.
Die Metabolisierung von Dioxinen in der Leber geschieht durch reduktive Dehalogenierung oder als Hydroxylierung durch den Cytochrom P450 Enzymkomplex. Über epoxidische Zwischenstufen werden Halogenatome abgespalten und Hydroxygruppen in das Dioxinmolekül eingebracht. An einen Hydroxyrest kann in einem weiteren Schritt beispielsweise Glucuronsäure angehängt werden. Die Abbaurate ist bei den 2,3,7,8-substituierten Kongeneren am geringsten, wodurch ihr relativer Anteil im Körper steigt. Kongenere mit drei und mehr Halogenatomen je Phenylring werden ebenfalls kaum abgebaut. Metabolisierte und unmetabolisierte Dioxine werden mit dem Kot ausgeschieden. Die biologischen Halbwertszeiten können von Art zu Art stark unterschiedlich sein, so betragen sie für 2,3,7,8-Cl4DD bei der Ratte 17–31 Tage, beim Menschen 6–10 Jahre.[3]
Empfehlungen und Grenzwerte
Die Festlegung von Höchstgehalten orientiert sich nicht direkt an der Toxizität, sondern „im Wesentlichen an der nicht vermeidbaren Belastung der Lebensmittel durch Dioxine aus der Umwelt, der so genannten Hintergrundbelastung“.[37]
Aufgrund von Tierversuchen wurden NOAEL-Werte ermittelt, aus denen verschiedene Staaten und Organisationen unter Berücksichtigung eines Sicherheitsfaktors Empfehlungen für die tolerierbare tägliche Aufnahme (TDI) von Dioxinen hergeleitet haben. Die Weltgesundheitsorganisation empfahl 1991 eine TDI von 1 bis 10 pg I-TEQ/kg Körpergewicht und Tag,[3] 1998 wurde die empfohlene TDI auf 1–4 pg I-TEQ/kg gesenkt. Ein im Auftrag der EU-Kommission tätiger Ausschuss veröffentlichte 2001 eine tolerierbare wöchentliche Aufnahme (TWI) von 14 pg TEQ/kg, was der gesenkten WHO-TDI entspricht.[38] In Deutschland entspricht die Aufnahme von Dioxinen der zulässigen Aufnahme: Das Bundesinstitut für Risikobewertung geht von „einer täglichen Aufnahme von 1–2 Picogramm WHO-PCDD/F-PCB-TEQ pro kg Körpergewicht über die Nahrung aus“.[39]
Seit 2006 sind in der EU die Grenzwerte in einzelnen Lebensmitteln sowohl als Toxizitätsäquivalente Dioxine wie auch für die Summe der TEQ aus Dioxinen und dioxinähnlichen PCB festgelegt. Für eine Übergangszeit gelten beide Grenzwerte parallel. Die Grenzwerte gelten pro Gramm Fettanteil (bei Fisch pro Gramm Muskelfleisch) und betragen demnach:[40]
- 1 pg bei Schweinefleisch
- 2 pg bei Geflügel
- 3 pg bei Hühnereiern, Eiprodukten, Rindern und Schafen
- 4 pg bei Fisch
- 6 pg bei Leber
Bei einem Fettanteil im Eigelb von 32 %, einem mittleren Eiergewicht von 63 g und einem angenommenen Dottergewicht von 30 g dürfte man also mit fünf Eiern bis zu 150 pg Dioxin aufnehmen – ebenso wie mit knapp 40 g Fisch.
Bis Ende 2008 sollte geprüft werden, ob die separaten Grenzwerte für Dioxine entfallen können.[30]
Akute Toxizität
Polychlorierte Dibenzodioxine und -furane sind sehr giftig, das 2,3,7,8-TCDD wird teilweise als „die giftigste vom Menschen hergestellte Verbindung“ bezeichnet.[36] Bei Mäusen beträgt die Dosis, bei der 50 % der Tiere sterben (sogenannte LD50) etwa 100 µg 2,3,7,8-TCDD/kg Körpergewicht. Allerdings kann die Giftwirkung von TCDD selbst für nahe verwandte Tiere stark unterschiedlich sein, beim Hamster wirken erst etwa 1.000 µg/kg tödlich, während es für Meerschweinchen mit etwa 1 µg/kg extrem giftig ist. Für den Menschen ist die tödliche Grenzdosis nicht bekannt, sie liegt aber deutlich höher als beim Meerschweinchen.[36] Bei dem Chemieunfall im italienischen Seveso 1976 starben durch das ausgetretene 2,3,7,8-Tetrachlordibenzo-p-dioxin (seitdem „Sevesodioxin“ genannt) nur Vögel und Kleintiere. Bei etwa 190 Menschen wurde Chlorakne, eine schwere Form von chronischer Akne, festgestellt, die bei akuter Dioxinvergiftung auftreten kann. Die Konzentrationen von Sevesodioxin im Blutserum betrugen bis zu 56 ppb.[41] Der bisher höchste Wert von 144 ppb wurde im Blutfett einer Frau in Österreich gemessen.[42] Bei Wiktor Juschtschenko wurde eine Konzentration von 100 ppb festgestellt.[43]
Die toxische Wirkung von Dioxinen beruht auf ihrer Bindung an ein in Tieren und Menschen weit verbreitetes Zellprotein, den Arylhydrocarbonrezeptor (AhR). Das Dioxin bindet in der Zelle an diesen Rezeptor, der Enzym-Substrat-Komplex lagert sich an die DNA an und löst damit die verstärkte Bildung von fremdstoffabbauenden Enzymen, insbesondere von Cytochrom P450-Monooxygenasen aus. Die Stärke der Bindung und damit die Toxizität der Substanz hängt von dem jeweiligen Dioxin oder Furan (Anzahl und Stellung der Halogenatome) ab. Die Neigung zur Bindung an den Ah-Rezeptor ist bei den 2,3,7,8-substituierten Dioxinen und Furanen am höchsten.
Als weitere Wirkmechanismen der Dioxine und Furane wurden ihre Bindung an den Rezeptor für den epidermalen Wachstumsfaktor (EGF), ihre agonistische Wirkung für Schilddrüsenhormone und Auswirkungen auf den Vitamin A-Stoffwechsel diskutiert.

Beim Menschen ist die Chlorakne das Leitsymptom schwerer akuter Dioxinvergiftungen. Sie wird durch Hautkontakt mit Dioxinen oder durch Dioxin-Konzentrationen im Blutserum von mehr als 800 ng/kg ausgelöst. Durch Schädigung der Leber wird der Stoffwechsel gestört, wodurch die Gehalte an Lipiden, Cholesterin und Transaminasen im Blut ansteigen. Im Tierversuch führen Dioxine und Furane zu anhaltender Übelkeit, Erbrechen und Appetitlosigkeit. Es kommt zu starkem Gewichtsverlust, dem „Wasting-Syndrom“. An neurologischen Störungen können sie unter anderem Übelkeit, Schlafstörungen, Kopfschmerzen, Reizbarkeit, Depressionen und eine allgemeine Veränderung der Psyche verursachen. Bei höheren Dosen können über Veränderungen der Schilddrüse immuntoxische Effekte ausgelöst werden, wofür Menschen weniger anfällig zu sein scheinen als einige Säugetiere.[3]
Chronische Toxizität
Zur chronischen Toxizität geringerer PCDD/PCDF-Konzentrationen gehört ihre fetotoxische und fruchtschädigende (teratogene) Wirkung. Bei der Maus führen bereits sehr niedrige Dosierungen von 1 ng/kg Körpergewicht/Tag zur Bildung von Gaumenspalten oder Schäden an Niere und Schilddrüse. Bei Affen traten bei dieser Dosierung keine fruchtschädigenden Wirkungen auf, allerdings war die Zahl der Fehlgeburten erhöht. Ein Anstieg der Konzentrationen bestimmter Enzyme (Enzyminduktion) durch Binden an den Ah-Rezeptor ist bei Nagetieren schon bei geringer Dosis möglich. Dioxine und Furane haben keine direkte gentoxische Wirkung. Sie können die Entstehung von Krebs aus einer vorgeschädigten Zelle beschleunigen (tumorpromovierende Wirkung). Das 2,3,7,8-TCDD gilt als eine der am stärksten tumorpromovierenden Substanzen überhaupt. Bei Ratten können Dioxine Leberkrebs, aber auch Karzinome in Lunge, Schilddrüse und Nebenniere auslösen. Ob Dioxine beim Menschen Krebs auslösen können, ist nicht abschließend gesichert. Verschiedene Studien fanden bei stark exponierten Personen ein erhöhtes Auftreten von Leukämie, Tumoren der Atmungsorgane und der Gallenblase sowie des Weichteilsarkoms. Für eine statistisch abgesicherte Aussage waren die Fallzahlen der einzelnen Studien zu klein, außerdem wurden die Einwirkung anderer Chemikalien und des Rauchens nicht berücksichtigt.[3] Fachgremien der Weltgesundheitsorganisation (WHO), der amerikanischen Gesundheitsbehörden und der US-Umweltbehörde EPA stufen 2,3,7,8-TCDD als für Menschen krebserregend ein.[36] Jüngste Untersuchungen an Eiern von Wachteln (Coturnix japonica), Fasanen und Weißen Leghorn Hühnern belegen die sehr unterschiedliche speziesabhängige Toxizität von TCDD, 2,3,4,7,8-Pentachlorodibenzofuran (PeCDF) und TCDF.[44]
Toxizitätsäquivalente
Da die Giftigkeit der einzelnen Dioxin- und Furan-Kongenere unterschiedlich ist, wurde zur besseren Abschätzung der Gefährlichkeit von „Dioxingemischen“ das System der Toxizitätsäquivalente (TEQ) eingeführt. Das Konzept wurde in den 1980er Jahren entwickelt, um die Belastung eines nach einem Transformatorenbrand mit Dioxinen, Furanen und PCBs verseuchten New Yorker Bürogebäudes einschätzen zu können.[36] Die Toxizität des 2,3,7,8-TCDD, der giftigsten Verbindung unter den polychlorierten Dibenzodioxinen, wird dabei willkürlich als 1 gesetzt. Die übrigen Kongenere erhalten, abhängig von ihrer Toxizität und dem angewandten Berechnungsmodell Toxizitätsäquivalentfaktoren (TEF) zwischen 0,0001 und 1. Ein Dioxin/Furan mit einem Toxizitätsäquivalent von 0,5 wird als halb so giftig angesehen wie das 2,3,7,8-TCDD.
| Kongener | BGA 1985[45] | NATO (I-TEF) 1988[46] | WHO 1997[30] | WHO 2005[47] |
|---|---|---|---|---|
| 2,3,7,8-Cl4DD | 1 | 1 | 1 | 1 |
| 1,2,3,7,8-Cl5DD | 0,1 | 0,5 | 1 | 1 |
| 2,3,7,8-subst. Cl6DD | 0,1 | 0,1 | 0,1 | 0,1 |
| 1,2,3,4,6,7,8-Cl7DD | 0,01 | 0,01 | 0,01 | 0,01 |
| Cl8DD | 0,001 | 0,001 | 0,0001 | 0,0003 |
| 2,3,7,8-Cl4DF | 0,1 | 0,1 | 0,1 | 0,1 |
| 1,2,3,7,8-Cl5DF | k.A. | k.A. | 0,05 | 0,03 |
| 2,3,4,7,8-Cl5DF | 0,01 | 0,05 | 0,5 | 0,3 |
| 2,3,7,8-subst. Cl6DF | 0,01 | 0,01 | 0,01 | 0,01 |
| 2,3,7,8-subst. Cl7DF | 0,01 | 0,01 | 0,01 | 0,01 |
| andere Cl7DF | 0,001 | 0 | 0 | 0 |
| Cl8DF | 0,001 | 0,001 | 0,0001 | 0,0003 |
| andere PCDD und PCDF | 0,01 | 0 | 0 | 0 |
Der Gesamt-TEQ-Wert eines Dioxine-Furane-Gemisches errechnet sich durch Multiplizieren jeder einzelnen PCDD- oder PCDF-Konzentrationen mit ihrem Toxizitätsäquivalentfaktor (TEF). Die so erhaltenen Werte werden zum TEQ-Wert aufsummiert.
Historisch existieren unterschiedliche Toxizitätsäquivalentfaktoren. Die Werte der NATO-Forschungsgruppe Committee on the Challenges of Modern Society (I-TEF) sind am Weitesten verbreitet und zum Beispiel in der Europäischen Union zur Berechnung von Dioxinen und Furanen aus Müllverbrennungsanlagen und Müll mitverbrennenden Anlagen vorgeschrieben.[48] In Deutschland sind Dioxine und Furane auch bei Kraftwerken mit I-TEF-Werten zu bestimmen, wenn die Kraftwerke feste oder flüssige Brennstoffe einsetzen.[49]
Die aktuellste Einstufung stammt von der WHO aus dem Jahr 2005.[50] Das Bundesamt für Risikoforschung warnt vor eine Übernahme der WHO-TEF von 2005, da diesen keine neuen toxikologischen Erkenntnisse zugrunde liegen und die Absenkung mehrerer Faktoren zur Folge hätte, dass bei unverändertem Grenzwert eine höhere Dioxine- und Furane-Menge in Lebensmitteln zulässig wäre. Außerdem wäre eine Vergleichbarkeit von Messwerten mit historischen Messreihen nicht mehr gegeben.[51]
Das System der Toxizitätsäquivalente wird nur für chlorierte Dioxine und Furane sowie für einige PCBs angewendet, die dem 2,3,7,8-TCDD stereochemisch ähneln ("dioxin-like" dlPCBs). Bei bromhaltigen oder gemischthalogenierten Kongeneren gibt es noch zu wenig Daten für ihre Einstufung. Von ihrer Giftigkeit her sind sie mit den chlorierten Dioxinen und Furanen vergleichbar. Sie zählen zu den dioxin-like compounds (DLC), also den dioxin-ähnlichen Verbindungen, für die vorläufig eine Relative Potenz (REP) die Gefährlichkeit im Verhältnis zu 2,3,7,8-TCDD angibt. Zu den DLCs werden unter anderem auch Vertreter der Polychlorierten Naphthalene (PCN), methylsubstituierten PCDDs/PCDFs oder polycyclischen aromatischen Kohlenwasserstoffe (PAK) gezählt.[52]
Bei biologischen Proben werden für die Berechnung des TEQ meist nur die 2,3,7,8-substituierten PCDD/PCDF (17 Kongenere) berücksichtigt.[53] Bei den internationalen Berechnungsverfahren werden teilweise zusätzlich die nicht nachweisbaren Kongenere mit dem Wert ihrer halben Nachweisgrenze berücksichtigt und der Gesamtwert als ITEQ(½ NWG) angegeben. Neben der Angabe der Konzentration in TEQ wird auch eine andere Bestimmungsmethode verwendet, bei der die Gesamtsumme aller nachgewiesenen vier- bis achtfach chlorierten Dioxine und Furane berechnet wird. Bei beiden Berechnungen (TEQ und Gesamtsummen) werden die ein- bis dreifach chlorierten Dioxine und Furane nicht berücksichtigt, da ihr toxikologischer Wirkungsmechanismus nicht mit dem der höher chlorierten Dioxine vergleichbar ist. In der Regel werden diese Verbindungen deshalb nicht bestimmt.[3]
Eine Studie der Europäischen Kommission über Verbesserungen der Richtlinie zur Verbrennung und Mitverbrennung von Abfall (2000/76/EG) hat im Jahr 2007 empfohlen:[54]
- eine Messvorschrift für dioxin-ähnliche PCBs einzuführen, um aus den Ergebnissen einen geeigneten Grenzwert abzuleiten;
- eine einheitliche Vorschrift zur Einbeziehung von Messwerten einzuführen, die unterhalb der Bestimmungsgrenze liegen;
- eine Umstellung von I-TEF (1988) auf WHO-TEF (2005) zu prüfen, unter der Voraussetzung, dass die Berechnungsfaktoren stets angegeben werden müssen und unter Berücksichtigung der daraus resultierenden niedrigeren Messwerte sowie der nicht mehr gegebenen Vergleichbarkeit mit früheren Messwerten.
Die Europäische Kommission hat im Jahr 2010 bei Überführung der Abfallverbrennungs- und Abfallmitverbrennungsrichtlinie in die Industrieemissionsrichtlinie (2010/75/EU) keine Änderungen der bisherigen Vorschrift zur Anwendung der NATO (I-TEF)-Werte vorgenommen. Der Deutsche Bundesrat hat an Stelle der bisher gültigen NATO (I-TEF)-Werte am 14. Dezember 2012 vorgeschlagen, künftig in Kraftwerken, Müllverbrennungsanlagen und Müll mitverbrennenden Zement- und Kalkwerken die WHO-TEF 2005 sowie die Faktoren für zwölf dioxinähnliche PCBs einzuführen.[55][56]
Behandlung
Bei einer akuten Vergiftung ist keine Möglichkeit zur raschen Entgiftung bekannt.[57] Wegen der Einlagerung im Fettgewebe des Körpers können sie selbst durch Blutwäsche nicht oder nur langsam ausgeschieden werden. Auch für die in der medizinischen Literatur vorgeschlagene Gabe von Paraffin-Öl und medizinischem Alkohol gibt es bislang keinen Erfolgsbeweis, jedoch lassen neuere Erkenntnisse sowie Vergleiche mit anderen Schadstoffen und Giften diesen Ansatz erfolgversprechend erscheinen. Eine erfolgreiche Therapie wäre demnach durch das Verabreichen bestimmter Fettersatzstoffe möglich, wie z. B. Olestra. Diese Fettersatzstoffe werden vom Darm nicht aufgenommen, lösen aber bei der Darmpassage einen Teil des im Körper vorhandenen Dioxins, das mit ausgeschieden wird.[58]
Daten und Messprogramme
Das Umweltbundesamt (UBA) betreibt in Zusammenarbeit mit dem Bundesinstitut für Risikobewertung (BfR) und dem Bundesamt für Verbraucherschutz und Lebensmittelsicherheit (BVL) die Dioxin-Datenbank des Bundes und der Länder.[59] Die Messprogramme werden in Kompartimente unterteilt, die sich in die folgenden Kategorien gliedern lassen: Boden, Luft, Biota, Wasser, Abfall, Lebensmittel und Humanproben. Es sind – somit möglich – kompartiment- und standortbezogen Aussagen über den aktuellen Belastungszustand von „Material“ mit Dioxinen und PCBs zu treffen. Auch in Österreich (Kuhmilch[33]) und der Schweiz (Boden[60]) wurden in den letzten Jahren Messprogramme durchgeführt. Zwischen 2004 und 2007 wurde von den Alpenländern Deutschland, Italien, Österreich und Slowenien und der Schweiz das EU-Projekt MONARPOP (MOnitoring Network in the Alpine Region for Persistent and other Organic Pollutants) durchgeführt. Dabei wurden für PCDD/PCDF sowie weitere Substanzen aus dem Dreckigen Dutzend die Langstreckenverfrachtung in entlegene alpine Regionen, die vorrangigen Quellgebiete, das Ausmaß der Belastung im Alpenraum und die in Bergwäldern akkumulierten Lager sowie die biologischen Wirkungen der gemessenen Belastungen untersucht.[61][62]
Analytik
Die spurenanalytische Bestimmung der Dioxine ist aufwändig und wird von spezialisierten Analyselaboren durchgeführt.[63] Probenahme und Aufarbeitung hängen von der Art der untersuchten Probe ab. Der Dioxingehalt kann beispielsweise in Luft, Abgas, Asche, Wasser, Klärschlamm, Boden, Pflanzen, Blut, Fettgewebe, Lebensmitteln und Textilien bestimmt werden. Bei der Probenvorbereitung und Extraktion wird zwischen den Verfahren der Flüssig/Flüssig-Verteilung und der Fest/Flüssig-Extraktion unterschieden. Für die Letztere wurde lange Zeit die Soxhlet-Extraktion verwendet. In den vergangenen Jahren gewann die Extraktion mit überkritischen Fluiden (SFE) an Bedeutung. Für die Dioxin-Extraktion wird vor allem Kohlendioxid oder Lachgas bei Drücken von mehreren hundert Bar verwendet.
Um mitextrahierte Substanzen abzutrennen, die bei der weiteren Analyse stören würden, ist vor der eigentlichen Bestimmung oft eine Matrixabtrennung (Clean-Up) notwendig. Dazu kann der Extrakt mit Hilfe einer Flüssigchromatographie-Säule gereinigt werden, auch die Gel-Permeations-Chromatographie wird hierzu angewandt. Mit Hilfe der Kapillar-Gaschromatographie können die einzelnen Kongenere der PCDD und PCDF voneinander getrennt werden. Zur Detektion wird standardmäßig ein Massenspektrometer eingesetzt. Vorzugsweise sollten zur zuverlässigen Identifizierung hochauflösende Massenspektrometer verwendet werden.[64] Auch Ionenfallensysteme, die im MS/MS-Modus arbeiten, können verlässliche Informationen liefern.[65] In jedem Fall ist eine Zertifizierung der Laboranalytik durch regelmäßige Teilnahme an Ringversuchen zur Qualitätssicherung erforderlich. Lediglich bei ersten orientierenden Übersichtsanalysen können auch Elektroneneinfangdetektoren (ECD) oder Flammenionisationsdetektoren (FID) zum Einsatz kommen. Zur sicheren Quantifizierung werden häufig isotopenmarkierte 13C-Dioxin-Kongenere als interne Standards verwendet. Sie werden den Proben möglichst frühzeitig im Aufarbeitungsgang in einer bekannten Menge beigemischt, durchlaufen die weitere Aufarbeitung und erscheinen gleichzeitig mit den zu analysierenden Dioxinen im Chromatogramm.[3]
Literatur
- Karlheinz Ballschmiter, Reiner Bacher: Dioxine : Chemie, Analytik, Vorkommen, Umweltverhalten und Toxikologie der halogenierten Dibenzo-p-dioxine und Dibenzofurane, Weinheim ; New York, Basel, Cambridge, Tokyo : VCH, 1996, ISBN 3-527-28768-X
- Otto Hutzinger, Margot Fink, Heinz Thoma: PCDD und PCDF: Gefahr für Mensch und Umwelt? Chemie in unserer Zeit 20(5), S. 165–170 (1986), ISSN 0009-2851.
- Heidelore Fiedler: Existierende Dioxininventare weltweit und neue Methodik zur Erstellung von vergleichbaren und vollständigen Emissionsinventaren. Umweltwissenschaften und Schadstoff-Forschung 13(2), S. 88–94 (2001), ISSN 0934-3504.
- Heinz Köser: Dioxine – Eine Aufgabe für die Umwelttechnik. Chemie Ingenieur Technik 70(12), S. 1517–1525 (1998), ISSN 0009-286X.
- Dieter Lenoir, Stefan Leichsenring: Konzepte und Methoden des Umweltschutzes: das Beispiel Dioxine. Chemie in unserer Zeit 30(4), S. 182–191 (1996), ISSN 0009-2851.
- Peter Luthardt: Dioxin-Inventare WLB Wasser, Luft und Boden 6/2002, S. 60-62 (2002).
- Karl-Heinz van Pée: Bakterieller Dioxinabbau – Dehalogenierung polyhalogenierter Dioxine. Angewandte Chemie 115(32), S. 3846–3848 (2003), ISSN 0044-8249.
- Dieter Schrenk: Ultragifte oder Panikmache? Toxizität der Dioxine. Biologie in unserer Zeit 41(3), S. 174 - 180 (2011), ISSN 0045-205X
Weblinks
- POP-Dioxin-Datenbank des Bundes und der Länder
- Immissionskataster: Dioxine und Furane
- EPA’s Reanalysis of Key Issues Related to Dioxin Toxicity and Response to NAS Comments, Volume 1, Februar 2012, 344 S., 3,8 MB.
- U.S. Environmental Protection Agency: Exposure and Human Health Reassessment of 2,3,7,8-Tetrachlorodibenzo-p-Dioxin (TCDD) and Related Compounds National Academy Sciences (NAS) Review Draft
- Bundesinstitut für Risikobewertung: Dioxine Übersicht über verschiedene aktuelle Stellungnahmen zum Thema Dioxine
- Umweltbundesamt: Dioxine – Daten aus Deutschland (2007, PDF, 1,1 MiB)
- Aktuelle Wochenschau der GDCh, Thorsten Bernsmann: „Wie kommen Dioxine ins Futtermittel?“, 27. August 2009
Einzelnachweise
- ↑ Karlheinz Ballschmiter: Transport und Verbleib organischer Verbindungen im globalen Rahmen Angewandte Chemie 104(5), S. 501–528 (1992), ISSN 0044-8249
- ↑ 2,0 2,1 Barbara Brune, Heidelore Fiedler: Chlororganische Verbindungen in Muttermilch – Neue Methoden und Regularien Umweltwissenschaften und Schadstoff-Forschung 8(1), S. 37–42 (1996), ISSN 0934-3504.
- ↑ 3,00 3,01 3,02 3,03 3,04 3,05 3,06 3,07 3,08 3,09 3,10 3,11 3,12 Karlheinz Ballschmiter, Reiner Bacher: Dioxine. Verlag Chemie (VCH), Weinheim 1996, ISBN 3-527-28768-X.
- ↑ W. Sandermann, H. Stockmann, R. Casten (1957): Über die Pyrolyse des Pentachlorphenols. Chemische Berichte, 90(5), Seiten 690–692, doi:10.1002/cber.19570900506.
- ↑ 5,0 5,1 Dieter Lenoir, Heinrich Sandermann Jr.: Entstehung und Wirkung von Dioxinen. Biologie in unserer Zeit 23(6), S. 363–369 (1993), ISSN 0045-205X.
- ↑ K. H. Schulz (1957): Klinische und experimentelle Untersuchungen zur Ätiologie der Chlorakne. Archiv für klinische und experimentelle Dermatologie, Band 206 (1957), Bericht über die 23. Tagung der Deutschen Dermatologischen Gesellschaft vom 24.–27. Mai 1956.
- ↑ J. M. Friedmann: Does Agent Orange cause birth defects? in: Teratology 29(2), S. 193–221 (1984) PMID 6377557
- ↑ J. David Erickson, Joseph Mulinare: Agent Orange and risks to reproduction. The limits of epidemiology in: Teratogenesis, Carcinogenesis, and Mutagenesis 7(2), S. 197–200 (1987) PMID 2885942
- ↑ Ngo AD, Taylor R, Roberts CL, Nguyen TV: Association between Agent Orange and birth defects: systematic review and meta-analysis. International Journal of Epidemiology 2006:1220-30 doi: 10.1093/ije/dyl038
- ↑ Boy Cornils: Zwischenfall in Seveso. Angewandte Chemie, 117(12), S. 1785–1786 (2005), ISSN 0044-8249
- ↑ Römpp Chemie Lexikon, 5. Auflage, 1982.
- ↑ Ekkehard Schuller, Harald Heinz, Helmut Stoffers: PCDD/PCDF-Kontaminationen aus Kieselrot von Sport- und Spielanlagen. Umweltwissenschaften und Schadstoff-Forschung 7(1), S. 9–14 (1995), ISSN 0934-3504.
- ↑ S Polič, H. Leskošek, M. Horvat: PCB pollution of the karstic environment (Krupa River, Slovenia), Acta Carsologica, SAZU, 29/1, S. 141–152, Ljubljana, 2000.
- ↑ Stockholmer Konvention vom 22. Mai 2001, deutsche Übersetzung.
- ↑ Anfrage der Abgeordneten Petrovic, Freundinnen und Freunde an die Bundesministerin für Arbeit, Gesundheit & Soziales betreffend ausständige Aufklärung der Dioxin-Vergiftung von Arbeitnehmern/innen in Wien im Jahr 1998.
- ↑ DIOXIN – International Symposium on Halogenated Persistent Organic Pollutants (2011).
- ↑ Gordon McKay (2002): Dioxin, formation and minimisation during municipal solid waste (MSW) incineration: review. Chemical Engineering Journal, 86, S. 343–368, doi:10.1016/S1385-8947(01)00228-5.
- ↑ Tages-Anzeiger: Grundbelastung durch Dioxine ist noch zu hoch – Trotz Fortschritten in der Lufthygiene nimmt die Schweizer Bevölkerung teilweise mehr Dioxine auf als empfohlen. 30. Juli 2007.
- ↑ Europäisches Schadstoffemissionsregister, Daten für 2004.
- ↑ Europäisches Schadstofffreisetzungs- und verbringungsregister, Daten für 2008.
- ↑ The Seattle Times (2006): E-waste dump of the world.
- ↑ Huiru Li, Liping Yu, Guoying Sheng, Jiamo Fu, Ping'an Peng: Severe PCDD/F and PBDD/F Pollution in Air around an Electronic Waste Dismantling Area in China. Environ. Sci. Technol. 2007, doi:10.1021/es0702925.
- ↑ Nicholas J. L. Green, Joanne L. Jones, Kevin C. Jones: PCDD/F Deposition Time Trend to Esthwaite Water, U.K., and Its Relevance to Sources. Environ. Sci. Technol., 2001, 35, (14), S. 2882–2888, doi:10.1021/es000225+.
- ↑ Karl-Heinz van Pée: Bakterieller Dioxinabbau – Dehalogenierung polyhalogenierter Dioxine. Angewandte Chemie 115(32), S. 3846–3848 (2003), doi:10.1002/ange.200301662.
- ↑ Hessisches Ministerium für Umwelt, ländlichen Raum und Verbraucherschutz: Ergebnisse der Amtlichen Lebensmittelüberwachung in Hessen für das Jahr 2005.
- ↑ Ministerium für Umwelt und Naturschutz, Landwirtschaft und Verbraucherschutz des Landes Nordrhein-Westfalen Untersuchung von Hühnereiern aus verschiedenen Haltungsformen auf Dioxine und PCB.
- ↑ Spiegel Online: Kontrolleure finden Dioxin-Eier in mehreren Bundesländern, 7. Mai 2010.
- ↑ Spiegel Online: 14 Hühnerställe nach Dioxin-Fund gesperrt, 31. Dezember 2010.
- ↑ Frankfurter Allgemeine Zeitung: 3000 Tonnen verseuchtes Futterfett hergestellt, 5. Januar 2011.
- ↑ 30,0 30,1 30,2 Amtsblatt der Europäischen Union: Verordnung (EG) Nr. 1881 der Kommission vom 19. Dezember 2006 zur Festsetzung der Höchstgehalte für bestimmte Kontaminanten in Lebensmitteln. L 364/5 - L 364/24, 20. Dezember 2006.
- ↑ Stefan Böschen: Risikogenese - Prozesse gesellschaftlicher Gefahrenwahrnehmung: FCKW, DDT, Dioxin und Ökologische Chemie. Leske + Budrich, Opladen, 2003, S. 196, ISBN 3-8100-2691-3.
- ↑ G. M. Solomon, P. M. Weiss: Chemical contaminants in breast milk: time trends and regional variability. Environmental Health Perspectives 110(6): A339–A347.
- ↑ 33,0 33,1 Umweltbundesamt: Österreichische Kuhmilch auf dem Prüfstand
- ↑ A. Schecter, P. Cramer, K. Boggess, J. Stanley, O. Päpke, J. Olson, A. Silver, M. Schmitz (2001): Intake of dioxins and related compounds from food in the U.S. population. Journal of Toxicology and Environmental Health, Part A, 11.
- ↑ E. Ankarberg, G. Concha, P. O. Darnerud, M. Aune, A. Törnkvist, A. Glynn: Dietary intake of polychlorinated dibenzo-p-dioxins, dibenzofurans and polychlorinated biphenyls in Swedish consumers. Organohalogen Compounds Vol 69 (2007), 1965–68.
- ↑ 36,0 36,1 36,2 36,3 36,4 A. Schecter, L. Birnbaum, J.J. Ryan, J.D. Constable: Dioxins: An overview. Environmental Research 101 (2006), S. 419–428.
- ↑ Bundesinstitut für Risikobewertung: Warum gelten für verschiedene Lebensmittel unterschiedliche Dioxin-Höchstgehalte? FAQs vom 10. Januar 2011
- ↑ NAS Review Draft: Exposure and Human Health Reassessment of 2,3,7,8-Tetrachlorodibenzo-p-Dioxin (TCDD) and Related Compounds. Dezember 2003.
- ↑ Bundesinstitut für Risikobewertung: Wie hoch ist die Dioxinaufnahme in Deutschland? FAQs vom 10. Januar 2011
- ↑ European Commission: Commission Regulation (EC) n°199/2006 of 3 February 2006 amending Regulation (EC) n°466/2001 setting maximum levels for certain contaminants in foodstuffs as regards dioxins and dioxin-like PCBs. Off. J. Eur. Community, L 32, 4. Februar 2006, 34.
- ↑ P. Mocarelli, L. Needham, A. Marocchi, D. Patterson, P. Brambilla, P. Gerthoux, L. Meazza, V. Carreri (1991): Serum Concentrations of 2,3,7,8-Tetrachlorodibenzo- p-dioxin and Test Results from Selected Residents of Seveso, Italy. J Toxicol Environ Health 32: S. 357–366, PMID 1826746.
- ↑ Alexandra Geusau, Klaus Abraham, Klaus Geissler, Michael O. Sator, Georg Stingl, Erwin Tschachler (2001): Severe 2,3,7,8-Tetrachlorodibenzo-p-dioxin (TCDD) Intoxication: Clinical and Laboratory Effects, Environmental Health Perspectives 109 (8): S. 865–869.
- ↑ Alvin L. Young, James Regens (2005): Serum TCDD levels and health effects from elevated exposure: Medical and scientific evidence, Environmental Science and Pollution Research 12 (1): S. 1–4, doi:10.1065/espr2004.12.131.
- ↑ Cohen-Barnhouse AM, Zwiernik MJ, Link JE, Fitzgerald SD, Kennedy SW, Hervé JC, Giesy JP, Wiseman S, Yang Y, Jones PD, Wan Y, Collins B, Newsted JL, Kay D, Bursian SJ.: Sensitivity of Japanese quail (Coturnix japonica), Common pheasant (Phasianus colchicus), and White Leghorn chicken (Gallus gallus domesticus) embryos to in ovo exposure to TCDD, PeCDF, and TCDF., Toxicol Sci. 2011 Jan;119(1):93-103, PMID 20861070.
- ↑ Umweltbundesamt: Sachstand Dioxine. Erich Schmidt Verlag, Berlin, 1985, zitiert nach Ballschmiter und Bacher (1996)
- ↑ F. W. Kutz et al.: The international toxicity equivalency factor (I-TEF) method of risk assessment for complex mixtures of dioxins and related compounds. Chemosphere 20:751–757, 1990, zitiert nach Ballschmiter und Bacher (1996); Vorgeschlagen wurde dieses System erstmals 1988 vom NATO-Committee on the challenges of the Modern Society (NATO-CCMS).
- ↑ The International Programme of Safety, WHO, Genf, 2005
- ↑ Industrieemissionsrichtlinie, Richtlinie 2010/75/EU vom 17. Dezember 2010
- ↑ Großfeuerungs- und Gasturbinenanlagenverordnung 13. Verordnung zur Durchführung des Bundes-Immissionsschutzgesetzes, zuletzt geändert in 2009
- ↑ 2005 Re-evaluation of human and mammalian toxic equivalency factors (TEFs), WHO, Genf, 2005
- ↑ Auswirkung veränderter Toxizitätsäquivalentfaktoren (TEF) auf die Toxizitätsäquivalente (TEQ) der Weltgesundheitsorganisation Stellungnahme Nr. 011/2007, Bundesinstitutes für Risikobewertung (BfR), 14. Februar 2007
- ↑ E. Eljarrat, D. Barceló: Toxicity Potency Assessment of Persistent Organic Pollutants in Sediments and Sludges in D. Barceló: Emerging Organic Pollutants in Waste Waters and Sludge, The Handbook of Environmental Chemistry, Vol. 5 Part 1, Springer Verlag, Berlin, 2004, S. 99-140, ISBN 3-540-21365-1.
- ↑ Eurochlor: Science Dossier: Dioxins and furans in the environment, 2003, S. 6.
- ↑ Studie zur Überarbeitung der Richtlinie 2000/75/EG Sander/Tebert/Schilling/Jepsen: Assessment of the application and possible development of community legislation for the control of waste incineration and co-incineration, Ökopol im Auftrag der EU-Kommission, 2007 (engl.)
- ↑ Tagesordnung und Ausschussempfehlungen zur 904. Bundesratsitzung am 14. Dezember 2012
- ↑ Plenarprotokoll zur 904. Bundesratsitzung am 14. Dezember 2012
- ↑ Vera Zylka-Menhorn: Dioxin-Vergiftung: Eine tickende Zeitbombe. Deutsches Ärzteblatt 101, Ausg. 51–52, vom 20. Dezember 2004, S. A-3470/B-2934/C-2777.
- ↑ Alexander Lindemeier: Chlorakne: Keine kausale Behandlungsoption. Hautnah, 5. Jahrg., Nr. 3, 2006.
- ↑ Dioxin-Datenbank des Bundes und der Länder
- ↑ Fachstelle Bodenschutz Zürich: Bodenbelastung mit Dioxinen und Furanen im Kanton Zürich
- ↑ Endbericht MONARPOP (PDF, engl., 16 MB).
- ↑ MONARPOP takeaway info.
- ↑ Schweizer Fernsehen: Dioxin im Tierfutter, Analytik ab 3:09.
- ↑ Menotta S, D'antonio M, Diegoli G, Montella L, Raccanelli S, Fedrizzi G.: Depletion study of PCDD/Fs and dioxin-like PCBs concentrations in contaminated home-produced eggs: preliminary study. Anal Chim Acta. 2010 Jul 5;672(1-2):50-4, PMID 20579489.
- ↑ Malavia J, Abalos M, Santos FJ, Abad E, Rivera J, Galceran MT.: Ion-trap tandem mass spectrometry for the analysis of polychlorinated dibenzo-p-dioxins, dibenzofurans, and dioxin-like polychlorinated biphenyls in food., J Agric Food Chem. 2007 Dec 26;55(26):10531-9, PMID 18052095.
| Dieser Artikel wurde am 5. Dezember 2007 in dieser Version in die Liste der lesenswerten Artikel aufgenommen. |

