Strontiumbromid
| Kristallstruktur | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||
| __ Sr2+ __ Br− | |||||||||||||||
| Allgemeines | |||||||||||||||
| Name | Strontiumbromid | ||||||||||||||
| Verhältnisformel | SrBr2 | ||||||||||||||
| CAS-Nummer |
| ||||||||||||||
| PubChem | 25302 | ||||||||||||||
| Kurzbeschreibung |
farbloser Feststoff[1] | ||||||||||||||
| Eigenschaften | |||||||||||||||
| Molare Masse |
| ||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||
| Dichte | |||||||||||||||
| Schmelzpunkt | |||||||||||||||
| Siedepunkt |
2146 °C[4] | ||||||||||||||
| Löslichkeit | |||||||||||||||
| Sicherheitshinweise | |||||||||||||||
| |||||||||||||||
| LD50 |
1 g·kg−1 (Ratte, i.v.)[7] | ||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||
| ΔHf0 | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||
Strontiumbromid ist das Strontiumsalz der Bromwasserstoffsäure.
Herstellung
Strontiumbromid kann durch Salzbildungsreaktion aus Strontiumhydroxid und Bromwasserstoff hergestellt werden.
Auch aus Strontiumcarbonat und Strontiumcarbid ist die Synthese möglich.[8]
Eigenschaften
Strontiumbromid ist gut wasserlöslich, mit steigender Temperatur steigt auch die Löslichkeit: bei 0 °C lösen sich 852 g, bei 25 °C 1070 g und bei 100 °C 2225 g Strontiumbromid in 1 Liter Wasser.[5] Es tritt als Hexahydrat SrBr2 · 6 H2O auf, das sich bei 89 °C unter Kristallwasserabgabe in das Dihydrat SrBr2 · 2 H2O und schließlich bei 180 °C in das Anhydrat umwandelt.[5] Strontiumbromid ist in Ethanol löslich, aus diesen Lösungen scheiden sich Kristalle mit der Formel 2 SrBr2 · 5 C2H5OH ab.[8]
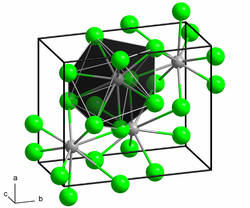
Wasserfreies Strontiumbromid kristallisiert im orthorhombischen Kristallsystem in der Raumgruppe Pnma mit den Gitterparametern a = 920 pm, b = 1142 pm und c = 430 pm. In der Elementarzelle befinden sich vier Formeleinheiten.[3]
Das Hexahydrat kristallisiert im trigonalen Kristallsystem in der Raumgruppe P321 und den Gitterparametern a = 822,8 pm und c = 416,4 pm. In der Elementarzelle befindet sich eine Formeleinheit.[3]
Verwendung
Strontiumbromid wirkt wie auch andere Salze der Bromwasserstoffsäure (Lithiumbromid, Kaliumbromid) zentraldämpfend. Die Verwendung als Sedativ ist heute obsolet.[9]
Einzelnachweise
- ↑ CRC Handbook of Chemistry and Physics, CRC Press, LLC 2005.
- ↑ 2,0 2,1 2,2 Datenblatt Strontiumbromid bei AlfaAesar, abgerufen am 7. Juni 2010 (JavaScript erforderlich).
- ↑ 3,0 3,1 3,2 Jean D'Ans, Ellen Lax: Taschenbuch für Chemiker und Physiker. 3. Elemente, anorganische Verbindungen und Materialien, Minerale, Band 3. 4. Auflage, Springer, 1997, ISBN 978-3-5406-0035-0, S. 742–743 (eingeschränkte Vorschau in der Google Buchsuche).
- ↑ 4,0 4,1 4,2 Datenblatt Strontium bromide bei Sigma-Aldrich, abgerufen am 23. April 2011.
- ↑ 5,0 5,1 5,2 5,3 5,4 Dale L. Perry, Sidney L. Phillips: Handbook of Inorganic Compounds. CRC Press, 1995, ISBN 978-0-8493-8671-8, S. 387 (eingeschränkte Vorschau in der Google Buchsuche).
- ↑ Seit 1. Dezember 2012 ist für Stoffe ausschließlich die GHS-Gefahrstoffkennzeichnung zulässig. Bis zum 1. Juni 2015 dürfen noch die R-Sätze dieses Stoffes für die Einstufung von Zubereitungen herangezogen werden, anschließend ist die EU-Gefahrstoffkennzeichnung von rein historischem Interesse.
- ↑ Vorlage:Strem
- ↑ 8,0 8,1 R. Abegg, F. Auerbach: Handbuch der anorganischen Chemie, Bd. 2, Verlag S. Hirzel, 1908. S. 214–216; Volltext
- ↑ C. Uferer, T. Hückel: Ausgewählte Standardrezepturen im NRF, in: Pharmazeutische Zeitung, Ausgabe 11/2000.