Nitrate


Nitrate sind die Salze und Ester der Salpetersäure (HNO3). Die Salze haben die allgemeine Zusammensetzung MINO3 (MI: einwertiges Kation). Einige der Salze werden mit dem historischen Trivialnamen Salpeter bezeichnet. Das planare Anion NO3− trägt eine negative Ladung. Die Ester der Salpetersäure werden auch Salpetersäureester genannt und haben die allgemeine Struktur R–O–NO2 (R: organischer Rest). Einige Salpetersäureester werden fälschlicherweise als Nitroverbindung bezeichnet, so z. B. Glycerintrinitrat als Nitroglyzerin. Nitroverbindungen (R–NO2) haben jedoch im Gegensatz zu Nitraten eine C-N-Bindung.
In der Mineralogie bilden die Nitrate je nach verwendeter Mineralsystematik zusammen mit den Carbonaten bzw. mit den Carbonaten und Boraten eine eigene Klasse. In der mittlerweile veralteten 8. Auflage der Strunz'schen und der vorwiegend im englischen Sprachraum gebräuchlichen Mineralsystematik nach Dana werden Carbonate, Nitrate und Borate in einer Klasse zusammengefasst, in der modernen und von der International Mineralogical Association (IMA) verwendeten 9. Auflage der Mineralsystematik nach Strunz dagegen nur die Carbonate und Nitrate.
Struktur
| Name | Formel | Trivialname |
|---|---|---|
| Kaliumnitrat | KNO3 | Kalisalpeter |
| Natriumnitrat | NaNO3 | Natronsalpeter, Chilesalpeter |
| Bariumnitrat | Ba(NO3)2 | Barytsalpeter |
| Calciumnitrat | Ca(NO3)2 | Kalksalpeter, Mauersalpeter |
| Ammoniumnitrat | NH4NO3 | Ammonsalpeter |
| Silbernitrat | AgNO3 | Höllenstein |
| Aluminiumnitrat | Al(NO3)3 | |
| Eisen(III)-nitrat | Fe(NO3)3 | |
| Weitere Beispiele siehe Kategorie:Nitrat | ||
Das Nitration ist planar gebaut. Alle Bindungswinkel O–N–O betragen 120°. Ebenso sind die Bindungslängen der N–O-Bindungen gleich lang und liegen zwischen den Längen für Einfach- bzw. Doppelbindungen. Die reale Struktur des Nitrations muss deshalb zwischen drei mesomeren Grenzstrukturen existieren:

Stickstoff verfügt als Element der zweiten Periode über keine Oktettaufweitung durch d-Orbitale, so dass die auf den ersten Blick ungünstig erscheinenden mesomeren Grenzstrukturen mit positiven und negativen Ladungen vorliegen.
Eigenschaften
Die Salze sind - mit Ausnahme des Bismutoxidnitrat BiONO3 - gut löslich in Wasser und spielen eine wichtige Rolle als Nährstoff für Pflanzen. Nitratanionen selbst sind weitgehend ungiftig. Grenzen zur Toxizität für Säugetiere und Menschen liegen in der gleichen Größenordnung wie diejenigen von Chloriden und Sulfaten, nämlich im zweistelligen Grammbereich. Große Mengen führen jedoch – wie bei allen Salzen – zu osmotischen Problemen (siehe: Osmoregulation). Als Lebensmittelzusatzstoffe werden Nitrate im Milligrammbereich verwendet.
Beim trockenen Erhitzen (Schmelzen) zerfallen Nitrate.
So reagiert Natriumnitrat unter Sauerstoffabspaltung zu Natriumnitrit:
Bleinitrat bildet Blei(II)-oxid und Stickstoffdioxid wird freigesetzt:
Alkalinitrate werden als Oxidationsmittel z. B. im Schwarzpulver verwendet.
Herstellung
Nitratsalze sind durch Umsetzung von Salpetersäure beispielsweise mit Hydroxiden, Carbonaten, Metallen o. ä. leicht zugänglich:
- Umsetzung von Salpetersäure mit Bariumhydroxid zu Bariumnitrat und Wasser.
- Umsetzung von Salpetersäure mit Kaliumcarbonat zu Kaliumnitrat, Wasser und Kohlendioxid.
- Umsetzung von Salpetersäure mit Zink zu Zinknitrat, Wasser und Stickstoffmonoxid.
Nitrate sind auch durch vollständige Oxidation von Stickstoffverbindungen wie Nitriten, Ammoniak oder Hydroxylamin zugänglich.
Vorkommen
Nitrate sind in der Biosphäre und Hydrosphäre allgegenwärtig. Abbauwürdige Mengen von Nitraten finden sich hauptsächlich in Form von Natriumnitrat. Der Hauptfundort dieses Salzes ist Chile, daher auch der Trivialname Chilesalpeter. Weitere natürliche Vorkommen gibt es in Ägypten, Kleinasien, Kolumbien und Kalifornien. Nitrate der häufigen Alkali- und Erdalkalimetalle kommen in natürlicher Form als Chile-, Kalk- oder Kalisalpeter vor.
Bildung und Abbau von Nitraten (siehe auch: Stickstoffkreislauf)
Im Boden und in Gewässern werden Nitrate durch bakterielle Nitrifikation gebildet. Bei der Zersetzung insbesondere eiweißhaltiger Stoffe wird zuerst Ammonium freigesetzt. Die Oxidation durch Bakterien der Gattung Nitrosomonas führt zu Nitrit, welches durch Bakterien der Gattung Nitrobacter zum Nitrat weiteroxidiert wird. Bei einem Mangel an Sauerstoff führt hingegen die bakterielle Denitrifikation von Nitrat zu elementarem Stickstoff. Diese Umsetzungen werden z. B. in Kläranlagen systematisch zur Beseitigung der Stickstoffverbindungen ausgenutzt.
Verwendung
Nitrat wirkt als effizienter Sauerstoffspender. Deshalb ist Kaliumnitrat Bestandteil des Schwarzpulvers (Sprengsalpeter). Es werden gegebenenfalls auch Nitrate anderer Kationen verwendet, wenn farbige Lichteffekte in der Pyrotechnik gewünscht werden.
Als Lebensmittelzusatzstoff wird Natriumnitrat (E 251) und Kaliumnitrat (E 252) als Konservierungsmittel z. B. zum Pökeln von Fleisch- und Wurstwaren verwendet, da es die Bildung anaerober Keime hemmt.
Nitrate finden auch Verwendung in der Medizin, unter anderem zur Herstellung des Medikaments Isosorbidmononitrat zur Gefäßerweiterung.
Düngung
Nitrate werden von Pflanzen als Nährstoffe verwertet und in der Landwirtschaft als Düngemittel eingesetzt. Sie können direkt von pflanzlichen Organismen als Stickstoffquelle aufgenommen und verwertet werden.
In der Landwirtschaft werden Nitrate als Dünger, auch in Form von Gülle (allg. Wirtschaftsdünger) eingesetzt. Diese Wirtschaftsdünger enthalten Stickstoff zum Teil als Nitrat (Calciumnitrat in Blaukorn) und zum Teil als Ammonium (Ammoniumnitrat, Ammoniumphosphat), oft aber auch in Form von organischen Stickstoffverbindungen (Proteine, Amine, Harnstoff), bei deren bakterieller Zersetzung im Boden primär Ammonium frei wird. Durch Nitrifikation entsteht im Boden unter Mitwirkung von Bakterien aus Ammonium über die Zwischenstufe Nitrit das Nitrat. Der organisch gebundene Stickstoff kann im Boden mineralisiert werden (Freisetzung von Ammonium und letztlich auch Nitrat) oder in den Bodenhumusvorrat eingehen, aus dem er erst allmählich wieder mineralisiert wird (i. d. R. 1 bis 3 % Mineralisierungsrate pro Jahr).
Insbesondere als Folge der Güllewirtschaft, (in untergeordneten Mengen auch durch übermäßige Düngung z. B. beim Anbau verschiedener Gemüsearten oder in privaten Hausgärten sowie durch undichte Abwasserleitungen) haben die Nitratgehalte der Grundwässer in den vergangenen Jahrzehnten deutlich zugenommen. Gesetzliche Regelungen über Art, Menge und Zeitpunkt der Düngung sowie entsprechende Weiterbildungs- und Sanierungsmaßnahmen sollen zu einer allmählichen, allerdings stark verzögerten, Sanierung des Grundwassers führen.
Gesundheitliche Bedeutung
Die Ursache für gesundheitliche Risiken liegt in der Gefahr einer Reduktion des Nitrats zu Nitrit und der Bildung von krebserregenden Nitrosaminen. Eine solche Umwandlung findet zum einen im Darm durch entsprechende Bakterien statt, zum anderen können auch die Speicheldrüsen über den Blutweg angeschwemmtes Nitrat reduzieren.[1] Die Darmflora des Säuglings kann (wie die Darmflora eines Erwachsenen) Nitrit bildende Bakterien enthalten. Das entstehende Nitrit oxidiert das Hämoglobin zu Methämoglobin, welches der Säugling aufgrund seiner noch nicht ausgereiften Reduktionskapazität nicht wieder zu Hämoglobin rückreduzieren kann, so dass der Säugling von innen erstickt. Auch bei Wiederkäuern besteht durch Nitratreduktion im Pansen eine akute Gefahr der Nitritbildung. Hier werden sogar Nitratkonzentrationen über 20 mg/l im Trinkwasser als schädlich betrachtet.
Nitrate in Trinkwasser
Der aktuelle Grenzwert für NO3− in Trinkwasser liegt laut der deutschen Trinkwasserverordnung bei 50 mg/l, nach der schweizerischen Gewässerschutzverordnung bei 25 mg/l.[2] Wässer, die diesen Grenzwert überschreiten, werden von Wasserversorgern oft mit nitratärmerem Wasser vermischt, um den Grenzwert einzuhalten. In jüngster Zeit wurden erste Wasseraufbereitungen mit Umkehrosmose oder Nanofiltration gebaut, um durch Teilentsalzung den Nitratwert im Trinkwasser abzusenken.
Nitrat selbst ist in den Größenordnungen der Grenzwerte vollkommen ungiftig. Gefahr besteht für Säuglinge und für Menschen mit entarteter Darmflora durch die mögliche Bildung von Nitrit. In der Hauptsache aber dienen die Grenzwerte für Nitrat als Indikatorwerte für eine allgemeine Belastung der Trinkwasserquellen mit stickstoffhaltigen organischen Verschmutzungen, die eingedämmt bleiben sollen (siehe Absatz zur Philosophie der Grenzwerte in der Trinkwasserverordnung).
Salpeter
Salpeter (von lat. sal petrae, „Felsensalz“) ist der Trivialname einiger häufig vorkommender Nitrate. Im Einzelnen unterscheidet man folgende Salpeterarten:
- Ammonsalpeter, brennbarer Salpeter (Ammoniumnitrat)
- Barytsalpeter (Bariumnitrat)
- Chilesalpeter, Natronsalpeter (Natriumnitrat)
- Kalisalpeter (Kaliumnitrat)
- Kalksalpeter, Mauersalpeter (Calciumnitrat)
In der Natur können sie auf unterschiedlichen Wegen entstehen. Salpeter bildet sich in trockenen, heißen, ariden, vegetationslosen Gebieten bei biochemischer Zersetzung (Oxidation) stickstoffhaltiger organischer Stoffe (Guano und andere Exkremente von Vögeln und anderen Tieren), ebenso von Mikroalgen, Stickstoffbakterien u. a. Weiterhin kann es durch atmosphärische Stickstoffbindung und die Korrosionswirkung der Salpetersäure auf Gesteinstrümmern des Wüstenbodens gebildet werden. Nitrate entstehen aus Tuffen in ausgedehnten Liparit-Formationen.
In früherer Zeit wurden die Hersteller des Salpeters als Salpetersieder bezeichnet. Historisch sind Kali- und Chilesalpeter nicht nur als Sauerstoffspender im Sprengsalpeter (Schwarzpulver) von Bedeutung. Salpeter war bis zur Entdeckung der Haber-Bosch-Synthese von Ammoniak die einzige Quelle für größere Mengen von Stickstoff-Verbindungen, insbesondere für Nitratdünger und Salpetersäure. Er wurde weltweit verschifft (siehe Salpeterfahrt). Daher ergaben sich bis ins 20. Jahrhundert Konflikte um diesen Rohstoff, z. B. der Salpeterkrieg in Südamerika 1879 bis 1884. Mehrere Bauernaufstände im Hotzenwald führten im 18. und 19. Jahrhundert zu den Salpetererunruhen. Das Salpeterversprechen, ein Vertrag zwischen Carl Bosch und der Obersten Heeresleitung von 1914, sollte die synthetische Herstellung von Salpeter im industriellen Rahmen ermöglichen.
Salpetersäureester
| Name | Formel | |
|---|---|---|
| Ethylnitrat | ||
| Glycerintrinitrat | 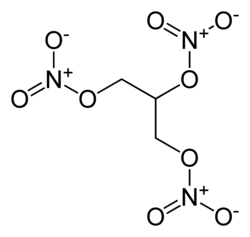
| |
| Zellulosenitrat | 
| |
| Weitere Beispiele siehe Kategorie:Salpetersäureester | ||
Organische Nitrate – die Salpetersäureester – sind häufig Verbindungen, die sich explosionsartig zersetzen können. Daher finden einige von ihnen als Explosivstoffe Verwendung (z. B. Nitropenta, Pentaerythrittrinitrat oder Glycerintrinitrat). Zellulosenitrat mit unterschiedlichen Nitrierungsgraden findet Verwendung in der Pyrotechnik, ist ein Bestandteil in Nitrozelluloselacken (Nitrolacke) und in Zelluloid.
Synthese
Ester der Salpetersäure werden durch Veresterung eines Alkohols mit Salpetersäure erhalten. Zur Nitrierung kann ein Gemisch aus konzentrierter Salpetersäure und konzentrierter Schwefelsäure, der so genannten Nitriersäure, eingesetzt werden. In der Nitriersäure bildet sich das Nitroniumion NO2+:
- Alkohol und Nitryl-Kation reagiert unter Deprotonierung zu einem Salpetersäureester
Nachweise
Die Umsetzung mit Schwefelsäure und Salicylsäure führt zu einem intensiv gelben Reaktionsprodukt, das nach DIN 38405-29 (Deutsche Einheitsverfahren D29), modifiziert nach ISO 7890-3, zu einer empfindlichen Bestimmung des Nitratgehalts in Wasserproben genutzt werden kann.
Qualitative Nachweismethoden sind:
- Ringprobe
- Reduktion mit Devarda-Legierung zu Nitrit und anschließender Nachweis mit Lunges Reagenz
- qualitativ und quantitativ mit dem Reagenz nach Busch
Literatur
- Ulrich Rohmann, Heinrich Sontheimer: Nitrat im Grundwasser – Ursachen, Bedeutung, Lösungswege. ZfGW-Verlag, Frankfurt am Main 1985, ISBN 3-922671-12-8.
Einzelnachweise
- ↑ Martin Ledig, Georg Wittke: Nitrat in Lebensmitteln, In: Naturwissenschaften im Unterricht - Chemie, 5(1994), 23, S. 7-9.
- ↑ Gewässerschutzverordnung (Schweiz).
Weblinks
- Nitrat, Nitrit und Nitrosamine: Alles Wurscht?
- Informationen der Behörden über Nitrat im Trinkwasser (Schweiz)
- Salpeter in der "Oekonomische Encyklopädie von J. G. Krünitz"
- Bericht zur Umsetzung der EG-Nitratrichtlinie in Deutschland - Zusammenfassung des Umweltbundesamtes
- Nitrat - das neue Brainfood. Vom Umweltgift zum Therapeutikum