Calciumnitrat
| Strukturformel | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||
| Allgemeines | ||||||||||||||||||
| Name | Calciumnitrat | |||||||||||||||||
| Andere Namen |
| |||||||||||||||||
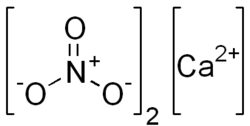
| Summenformel | Ca(NO3)2 | |||||||||||||||||
| CAS-Nummer |
| |||||||||||||||||
| Kurzbeschreibung |
farblose, zerfließende, monokline Prismen (Tetrahydrat)[1] | |||||||||||||||||
| Eigenschaften | ||||||||||||||||||
| Molare Masse | 164,09 g·mol−1) | |||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||
| Dichte | ||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||
| Siedepunkt |
Zersetzung[2] | |||||||||||||||||
| Löslichkeit |
gut in Wasser (1470 g·l−1 bei 0 °C, 2710 g·l−1 bei 40 °C als Tetrahydrat)[2] | |||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||
| ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||
Calciumnitrat ist das Calciumsalz der Salpetersäure und hat die Summenformel Ca(NO3)2. "Kalk- oder Norgesalpeter" wird als Düngemittel verwendet.
Vorkommen
Calciumnitrat entsteht, wenn Ammoniumnitrat aus Tierdung durch Feuchtigkeit Mauern durchdringt und mit dem Kalk aus dem Mörtel reagiert. So entsteht das sogenannte Mauersalz oder Mauersalpeter, das die Wände langsam zerstört. In der Geschichte gab es Salpeterer, die herumwanderten und dieses Salz von den Mauern kratzten, säuberten und verkauften. Auf Grund seines hohen Wasseranziehungsvermögens ist es nicht direkt verwendbar, sondern muss zu Kaliumnitrat konvertiert werden. Aus diesem Produkt wurde dann Schwarzpulver hergestellt.

Gewinnung und Darstellung
Calciumnitrat lässt sich aus Calciumcarbonat bzw. Calciumoxid und Salpetersäure darstellen:
Die Reaktion von Calcium mit Salpetersäure ist ebenso möglich:
Calciumnitrat bildet zudem auf Mauern eine Art weißen Schleier, der die Konsistenz von Watte hat. Man kann es mit einem Besen abfegen oder mit einem Spachtel abkratzen. Das Salz wird in Wasser gelöst, die Verunreinigungen sinken dann auf den Boden. Die Salzlösung wird abgegossen, vorsichtig eingedampft und getrocknet. Es ist jedoch meist mit anderen Salzen verunreinigt.
Siehe: Salpetersieder
Einzelnachweise
- ↑ Helmut Sitzmann, in: Römpp Online - Version 3.5, 2009, Georg Thieme Verlag, Stuttgart.
- ↑ 2,0 2,1 2,2 2,3 2,4 2,5 2,6 2,7 Eintrag zu Calciumnitrat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 3.1.2008 (JavaScript erforderlich)
- ↑ Datenblatt Calciumnitrat bei Sigma-Aldrich, abgerufen am 15. März 2011.
- ↑ Seit 1. Dezember 2012 ist für Stoffe ausschließlich die GHS-Gefahrstoffkennzeichnung zulässig. Bis zum 1. Juni 2015 dürfen noch die R-Sätze dieses Stoffes für die Einstufung von Zubereitungen herangezogen werden, anschließend ist die EU-Gefahrstoffkennzeichnung von rein historischem Interesse.