Bariumchlorid
| Kristallstruktur | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
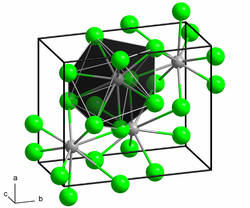
| |||||||||||||||
| __ Ba2+ __ Cl− | |||||||||||||||
| Allgemeines | |||||||||||||||
| Name | Bariumchlorid | ||||||||||||||
| Andere Namen |
Chlorbarium (veraltet) | ||||||||||||||
| Verhältnisformel | BaCl2 | ||||||||||||||
| CAS-Nummer |
| ||||||||||||||
| Kurzbeschreibung |
farblose, kubische oder monokline Kristalle[1] | ||||||||||||||
| Eigenschaften | |||||||||||||||
| Molare Masse |
| ||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||
| Dichte |
3,86 g·cm−3[1] | ||||||||||||||
| Schmelzpunkt | |||||||||||||||
| Siedepunkt |
1560 °C[2] | ||||||||||||||
| Löslichkeit |
gut in Wasser (375 g·l−1[2]) | ||||||||||||||
| Sicherheitshinweise | |||||||||||||||
| |||||||||||||||
| MAK |
0,5 mg·m−3 (Ba)[2] | ||||||||||||||
| LD50 |
118 mg·kg−1 (oral, Ratte) [2] | ||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||
| ΔHf0 |
−859,8 kJ·mol−1[6] | ||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||
Bariumchlorid ist eine farblose, kristalline chemische Verbindung und ein Chlorid des Bariums. Häufig liegt Bariumchlorid als Dihydrat (BaCl2 · 2 H2O) vor.
Gewinnung und Darstellung
Bariumchlorid lässt sich nach allen Salzbildungsreaktionen darstellen:
- Barium reagiert mit Chlor zu Bariumchlorid.
- Bariumhydroxid reagiert mit Salzsäure zu Bariumchlorid und Wasser.
- Bariumoxid reagiert mit Salzsäure zu Bariumchlorid und Wasser.
Kommerziell wird Bariumchlorid durch Reaktion von Bariumsulfid mit Salzsäure unter Bildung von Schwefelwasserstoffsäure synthetisiert:[1]
Auch durch Reaktion von Bariumcarbonat mit Salzsäure entsteht Bariumchlorid bei gleichzeitiger Bildung von Wasser und Kohlenstoffdioxid:[1]
Eigenschaften
Physikalische Eigenschaften

Bariumchlorid ist ein farbloses, kristallines Pulver mit einem Schmelzpunkt von 963 °C. Bariumchlorid weist wie Barium und alle seine Salze eine grüne Flammenfärbung auf, es ist gut in Wasser löslich und wie alle löslichen Bariumverbindungen giftig.
Bariumchlorid kommt meist in Verbindung mit zwei Molekülen Kristallwasser als Bariumchlorid-dihydrat vor. Wasserfreies Bariumchlorid erhält man, wenn man Bariumchloriddihydrat das Wasser durch Wärme entzieht (Dehydratation). Auch Bariumchloriddihydrat ist ein weißes, kristallines Pulver.
Chemische Eigenschaften
Reaktion mit Sulfat-Ionen:
- Magnesiumsulfat reagiert mit Bariumchlorid zu Bariumsulfat und Magnesiumchlorid.
Reaktion mit Kaliumchromat:
- Bariumchlorid reagiert mit Kaliumchromat zu Bariumchromat und Kaliumchlorid.
Verwendung
Bariumchlorid wird als Indikator für Sulfat-Ionen angewandt, da bei der Reaktion mit Sulfat-Ionen (siehe Reaktionen) Bariumsulfat als weißer Feststoff ausfällt. Diese Fällungsreaktion kann auch zur Reinigung von Natriumchlorid von Sulfaten eingesetzt werden.
Außerdem wird Bariumchlorid zum Härten von Stahl, in der Pyrotechnik aufgrund seiner grünen Flammenfärbung und zur Herstellung der Farbstoffe Bariumsulfat (siehe Reaktionen) und Bariumchromat (siehe Reaktionen) benutzt.
Die Rote Armee benutzte während des Zweiten Weltkriegs grünlich leuchtende Bariumchlorid-Leuchtspurgeschosse, um dem Schützen das Zielen zu erleichtern, während die Wehrmacht gelblich leuchtende Phosphor-Geschosse verwendete. Diese Geschosse wurden in den LMGs und MGs der Panzer eingesetzt. Auch halfen diese Geschosse anderen Soldaten, da sie sahen, wohin der Schütze zielte.
Toxizität
Bariumchlorid ist schwach wassergefährdend. Bariumchlorid ist giftig beim Einatmen und Verschlucken. Bei Unfall oder Unwohlsein auf Grund dieses Stoffes ist sofort ein Arzt hinzuzuziehen. Bariumchlorid ist unter Verschluss und für Kinder unzugänglich aufzubewahren.
Barium inaktiviert die passiven Kaliumkanäle in der Membran der Muskelzellen. Kalium kann so die Muskelzellen nicht mehr verlassen. Da die Natrium-Kalium-ATPase unvermindert Kalium in die Zellen pumpt, kommt es zum Abfall der Kalium-Spiegel im Blut. Die Symptome sind Hypermotilität des Magen-Darm-Traktes, Ausfall der Muskelreflexe (Areflexie), schlaffe Muskellähmung und Atemlähmung. Bei der Blutuntersuchung findet sich eine schwere Hypokaliämie.[7]
Als Erste-Hilfe-Maßnahme ist die Einnahme von Natrium- bzw. Kaliumsulfatlösung zu empfehlen, da Sulfationen die Bariumionen ausfällen und dabei unlösliches und somit ungiftiges Bariumsulfat bilden. Im Krankenhaus kann Barium durch Dialyse entfernt werden.
Einzelnachweise
- ↑ 1,0 1,1 1,2 1,3 Helmut Sitzmann, in: Roempp Online - Version 3.5, 2009, Georg Thieme Verlag, Stuttgart.
- ↑ 2,0 2,1 2,2 2,3 2,4 Datenblatt Bariumchlorid bei Merck, abgerufen am 19. Januar 2011.
- ↑ 3,0 3,1 Eintrag aus der CLP-Verordnung zu CAS-Nr. 10361-37-2 in der GESTIS-Stoffdatenbank des IFA (JavaScript erforderlich)
- ↑ Eintrag zu CAS-Nr. 10361-37-2 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 9. März 2011 (JavaScript erforderlich)
- ↑ Seit 1. Dezember 2012 ist für Stoffe ausschließlich die GHS-Gefahrstoffkennzeichnung zulässig. Bis zum 1. Juni 2015 dürfen noch die R-Sätze dieses Stoffes für die Einstufung von Zubereitungen herangezogen werden, anschließend ist die EU-Gefahrstoffkennzeichnung von rein historischem Interesse.
- ↑ PAETEC Formelsammlung Ausgabe 2003, Seite 116
- ↑ Yu-Jen Su, et al.: An Industrial Worker Hospitalized With Paralysis After an Aerosolized Chemical Exposure. In: American Journal of Kidney Diseases. 56, Nr. 3, 2010, S. A38-A41. doi:10.1053/j.ajkd.2010.02.004. Abgerufen am 22. September 2010.