Glucose
| Strukturformel | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Offenkettige Darstellung in der Fischer-Projektion | |||||||||
| Allgemeines | |||||||||
| Name | Glucose | ||||||||
| Andere Namen | |||||||||
| Summenformel | C6H12O6 | ||||||||
| CAS-Nummer |
| ||||||||
| ATC-Code | |||||||||
| Kurzbeschreibung |
D-Glucose: | ||||||||
| Eigenschaften | |||||||||
| Molare Masse | 180,16 g·mol−1 | ||||||||
| Aggregatzustand |
fest | ||||||||
| Dichte |
1,562 g·cm−3[3] | ||||||||
| Schmelzpunkt | |||||||||
| Löslichkeit |
gut in Wasser (470 g·l−1 bei 20 °C)[1] | ||||||||
| Sicherheitshinweise | |||||||||
| |||||||||
| LD50 |
25,8 g·kg−1 (Ratte, oral) (D-Glucose)[4] | ||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||
Glucose (kurz Glc, auch Glukose geschrieben, von griechisch γλυκύς ‚süß‘) ist ein Monosaccharid (Einfachzucker) und gehört damit zu den Kohlenhydraten. Es gibt zwei Enantiomere: D-Glucose und L-Glucose (für eine Erklärung der Bezeichnungen „D“ und „L“ siehe Fischer-Projektion). In der Natur kommt ausschließlich D-Glucose vor. Diese wird auch als Traubenzucker oder in älterer Literatur als Dextrose bezeichnet. L-Glucose ist nur synthetisch zugänglich und besitzt nur geringe praktische Bedeutung.
Entdeckungsgeschichte
Der Traubenzucker wurde 1792 von Johann Tobias Lowitz in Weintrauben entdeckt und als von Rohrzucker (Saccharose) verschieden erkannt.[5] Glucose ist der von Jean Baptiste Dumas 1838 geprägte Begriff, der sich in der chemischen Literatur durchgesetzt hat. Von Friedrich August Kekulé stammt der Vorschlag Dextrose (von Lateinisch dexter = rechts), da Traubenzucker die physikalische Eigenschaft besitzt, die Ebene des linear polarisierten Lichtes nach rechts zu drehen.[6] Im Gegensatz dazu drehen D-Fructose (eine Ketohexose) und L-Glucose polarisiertes Licht nach links. Die Struktur der Glucose und die Strukturbeziehungen zu den anderen Monosacchariden wurden 1891 von Emil Fischer beschrieben und stellten einen Meilenstein der Naturstoffchemie dar.[6] Die Namen beziehen sich zunächst auf die Naturstoffe. Ihre Enantiomeren erhielten mit Einführung systematischer Nomenklaturen denselben Namen mit Berücksichtigung der absoluten Stereochemie [z. B. Fischer-Nomenklatur (D,L-Nomenklatur)].[7]
Vorkommen und technische Gewinnung
Traubenzucker ist als Baustein in Zweifachzuckern wie Lactose (Milchzucker) oder Saccharose (Rohr- oder Rübenzucker), in Mehrfachzuckern wie Raffinose und in Vielfachzuckern wie Stärke, Glycogen oder Cellulose enthalten. Er wird durch die vollständige enzymatische Spaltung von Stärke (z. B. aus Mais oder Kartoffeln) hergestellt. Daraus resultiert die früher gängige Bezeichnung „Stärkezucker“.[8]
Biochemie
| Übergeordnet | ||
| Stoffwechsel der Hexosen | ||
| Untergeordnet | ||
| Gluconeogenese Glycolyse Entner-Doudoroff-Weg | ||
| Gene Ontology | ||
|---|---|---|
| QuickGO | ||
Glucose wird hauptsächlich von Pflanzen mithilfe der Photosynthese aus Sonnenlicht, Wasser und Kohlenstoffdioxid produziert und kann von allen Lebewesen als Energie- und Kohlenstofflieferant verwertet werden. Normalerweise kommt Glucose aber nicht frei, sondern in Form ihrer Polymere, also Milchzucker, Rübenzucker, Stärke, Cellulose und andere vor, die in Pflanzen sowohl Reservestoffe als auch Bestandteil der Zellstruktur sind. Diese Polymere werden bei der Nahrungsaufnahme durch Tiere, Pilze und Bakterien mithilfe von Enzymen erst zu Glucose abgebaut. Beim Mensch geschieht dies teilweise bereits beim Kauen mittels Amylase, die im Speichel enthalten ist. Alle Lebewesen sind außerdem in der Lage, Glucose aus bestimmten Ausgangsprodukten selbst herzustellen, wenn sich die Notwendigkeit ergibt. Der Glucosegehalt des Blutes beträgt etwa 0,1 % und wird durch die Hormone Insulin und Glucagon geregelt.
Glucose wird in Lebewesen zu mehreren anderen chemischen Verbindungen umgesetzt, die Ausgangsprodukt verschiedener Stoffwechselwege sind. Neben der Phosphorylierung zu Glucose-6-phosphat, die Teil der Glycolyse ist, kann Glucose bei ihrem Abbau zunächst zu Glucono-1,5-lacton oxidiert werden. Glucose dient als Baustein bei der Biosynthese von Trehalose in Bakterien und von Glycogen. Glucose kann außerdem von der bakteriellen Xylose-Isomerase in Fructose umgewandelt werden.
Nicht zuletzt muss Glucose, um in Zellen und Zellkompartimente oder heraus zu gelangen, durch Membranen transportiert werden, wofür es beim Mensch mehrere Dutzend spezielle Transportproteine gibt, die hauptsächlich zur Major-Facilitator-Superfamilie gehören.[9]
Biosynthese
Biosynthese aus kleineren Molekülen
Der Stoffwechselweg, der mit Molekülen beginnt, die zwei bis vier Kohlenstoffatome (C) enthalten und im Glucosemolekül endet, das sechs Kohlenstoffatome enthält, heißt Gluconeogenese und kommt in allen Lebewesen vor. Die kleineren Ausgangsstoffe sind das Resultat anderer Stoffwechselwege und stammen bei Pflanzen letztlich von der Assimilation von Kohlenstoffdioxid.
Biosynthese aus Reservestoffen und Polymeren
Glucose ist ein Baustein vieler Kohlenhydrate und kann aus diesen mithilfe von bestimmten Enzymen abgespalten werden. So genannte Glycosidasen katalysieren zunächst die Hydrolyse langkettiger Polysaccharide, wobei endständige Glucose oder Disaccharide entfernt werden. Disaccharide wiederum werden meist von speziellen Glycosidasen zu Glucose abgebaut. Die Namen der abbauenden Enzyme sind oft vom jeweiligen Poly- und Disaccharid abgeleitet; so gibt es unter anderem für den Abbau von Polysaccharidketten Amylasen (von Amylose, Bestandteil der Stärke), Cellulasen (von Cellulose), Chitinasen (von Chitin) und mehr; weiters für die Spaltung von Disacchariden die Lactase, Saccharase, Trehalase und andere.
Beim Menschen sind etwa 70 Gene bekannt, die für Glycosidasen codieren. Sie haben Funktionen bei der Verdauung und beim Abbau von Glycogen, Sphingolipiden, Mucopolysacchariden und Poly(ADP-Ribose).[10]
Abbau und Verwertung

Der physiologische Brennwert von Glucose beträgt 15,7 kJ/g (3,74 kcal/g).[11]Die hohe Verfügbarkeit von Kohlenhydraten durch die pflanzliche Biomasse hat während der Evolution, besonders der Mikroorganismen, zu einer Vielfalt von Methoden geführt, den Energie- und Kohlenstoffspeicher Glucose zu verwerten. Unterschiede bestehen darin, bis zu welchem nicht mehr für die Energiegewinnung nutzbaren Endprodukt der Weg führt. Hier entscheidet das Vorhandensein einzelner Gene, und ihrer Genprodukte, der Enzyme, welche Reaktionen möglich sind (siehe Abbildung). Dabei wird der Stoffwechselweg der Glycolyse von nahezu allen Lebewesen genutzt. Lediglich die an Extrembedingungen angepassten Bakterien und Archaeen haben weitere Abbaureaktionen erschlossen, die im Entner-Doudoroff-Weg zusammengefasst werden. Ein wesentlicher Unterschied dieses Wegs besteht in der Gewinnung von NADP-Reduktionsäquivalenten, die sonst indirekt erzeugt werden müssten.[12]
Zuletzt findet Glucose als Baustein bei der Glycosylierung von Proteinen und anderen Stoffen (katalysiert von Glycosyltransferasen) Verwendung und kann von den resultierenden Glycoproteinen, Peptidoglycanen und Glycosiden wieder abgespalten werden.
Medizin
Traubenzucker kann im Körper über die Glycolyse, die oxidative Decarboxylierung, den Citratzyklus und die Atmungskette vollständig zu Wasser und Kohlenstoffdioxid abgebaut werden. Ist dafür nicht genügend Sauerstoff verfügbar, erfolgt der Glucoseabbau anaerob bis zum Lactat durch die Milchsäuregärung und setzt weniger Energie frei. Bei hohem Angebot an Glucose kann der Metabolit Acetyl-CoA aber auch zur Fettsäuresynthese genutzt werden. Ebenfalls wird durch Glucose der Glycogen-Speicher des Körpers wieder aufgefüllt, der vor allem in Leber und Skelettmuskulatur zu finden ist. Diese Vorgänge werden hormonell reguliert. Durch die Gluconeogenese kann der Organismus Glucose aus anderen Stoffwechselprodukten, unter anderem aus Lactat oder bestimmten Aminosäuren unter Energieverbrauch aufbauen. Die Neubildung von bis zu 250 g Glucose am Tag findet hauptsächlich in der Leber statt. Auch die Tubuluszellen der Nieren können Glucose bilden. Eine dauernde Erhöhung des Glucosegehalts im Blut wird als Zuckerkrankheit (Diabetes mellitus) bezeichnet.
Glucosekonzentration im Blut
Die Glucose im Blut wird als Blutzucker bezeichnet. Der Blutzuckergehalt eines gesunden Menschen beträgt im nüchternen Zustand, d. h. nach Übernachtfasten, etwa 70 bis 100 mg/dl Blut (4 bis 5,5 mM). Im Blutplasma liegen die gemessenen Werte etwa 10–15 % höher. Außerdem liegen die Werte im arteriellen Blut über den Konzentrationen im venösen Blut, da Glucose während der Passage des Kapillarbettes in das Gewebe aufgenommen wird. Auch im Kapillarblut, das häufig zur Blutzuckerbestimmung verwendet wird, liegen die Werte teils höher als im venösen Blut. Nach Nahrungsaufnahme steigt die Blutzuckerkonzentration an. Werte über 180 mg/dl in venösem Vollblut sind sicher pathologisch und werden als Hyperglykämie bezeichnet. Ein wiederholt oder dauerhaft erhöhter Blutzuckerwert weist in der Regel auf Diabetes mellitus hin. Glucosekonzentrationen unter 40 mg/dl in venösem Vollblut werden als Hypoglykämie bezeichnet.[13]
Systematik der Glucose
| Verschiedene Formen und Darstellungen von D-Glucose im Vergleich | ||
|---|---|---|
| Keilstrichformel | Haworth-Schreibweise | |
α-D-Glucofuranose |
β-D-Glucofuranose | |
α-D-Glucopyranose |
β-D-Glucopyranose | |
| α-D-Glucopyranose in (1) Tollens/Fischer- (2) Haworth- (3) Sessel-Darstellung (4) stereochemischer Ansicht | ||
Als Kohlenhydrat mit sechs C-Atomen gehört Glucose zu den Hexosen. Als Aldose hat die Glucose eine Aldehydfunktion am ersten Kohlenstoffatom (Kohlenhydrate mit einer Ketogruppe werden als Ketosen bezeichnet). Durch eine intramolekulare Halbacetal-Bildung entsteht ein Ring: In der Pyranose-Form wird das erste mit dem fünften, in der selteneren Furanose-Form das erste mit dem vierten Kohlenstoffatom über eine Sauerstoffbrücke verbunden. Der Carbonylsauerstoff der Aldehydgruppe wird dabei zur Hydroxygruppe.
Die oben abgebildete Darstellung der pyranoiden Form – im Beispiel die β-D-Glucopyranose – wird als Haworth-Projektion bezeichnet. Dabei wird der Ring als eben dargestellt, was nicht der Realität entspricht, aber für viele Zwecke ausreichend ist. Durch den Ringschluss wird das erste C-Atom zu einem neuen, weiteren Chiralitätszentrum, so dass die Bildung von Diastereomeren möglich wird. Die Struktur, bei der die Hydroxy-Funktion des Halbacetals in der Haworth-Projektion nach unten weist, wird als α-D-Glucose bezeichnet, die mit der Hydroxy-Funktion nach oben als β-D-Glucose. Allgemein gilt, dass bei der α-Form die beim Ringschluss gebildete Hydroxy-Funktion auf der entgegengesetzten Seite der Ringebene der Haworth-Projektion steht wie die Hydroxymethylengruppe (C-Atom 6), bei der β-Form auf derselben. In dieser Form gilt die Definition sowohl für die D- und L-Zucker, als auch für Aldosen und Ketosen. α- und β-D-Glucose sind Beispiele für als Anomere bezeichnete Strukturen. Anomere sind stereoisomere Zucker, die sich nur in der Konfiguration an dem beim Ringschluss gebilden Chiralitätszentrum unterscheiden. Anomere sind somit ein Spezialfall der Epimere.
Die Fischer-Projektion ist bei den cyclischen Halbacetal-Formen, siehe 1, unübersichtlich. Um die gewinkelte Anordnung der Kohlenstoff-Kette zu verdeutlichen, wird die Sessel-Darstellung 3 gewählt. Auch die Darstellung 4 ist üblich und stereochemisch eindeutig.
Reaktionen der Glucose
Verhalten in wässriger Lösung
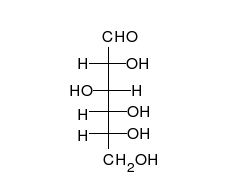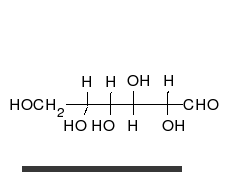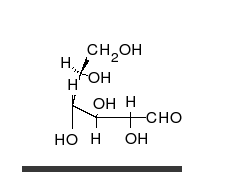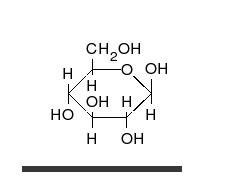
In wässriger Lösung kann der Ring geöffnet und geschlossen werden, so dass ein Gleichgewicht zwischen Pyranose- (Sechsring mit endozyklischem Sauerstoffatom, 99,75 %), Furanoseform (Fünfring, in Spuren) und offenkettiger Aldehydform (0,25 %) vorliegt. Die Zugabe von Säure oder Lauge beschleunigt diesen Vorgang. Da beim Ringschluss entweder die Alpha- oder die Beta-Form entstehen kann, liegt auch ein Gleichgewicht zwischen Alpha-Form (36,4 %) und Beta-Form (63,6 %) vor. Das Gleichgewicht liegt, wie an den prozentualen Anteilen zu erkennen ist, auf der Seite der β-D-Glucose. Sie ist das stabilere Anomer, da alle Hydroxygruppen in der Sesselkonformation äquatorial angeordnet sind und somit den größtmöglichen Abstand voneinander haben. Dass das α-Anomer mit immerhin 36,4 % trotz der axialen OH-Gruppe vorliegt, deutet darauf hin, dass es noch weitere Einflüsse geben muss. Die relative Stabilität der α-Konfiguration wird als anomerer Effekt bezeichnet.
Mutarotation

Die Umwandlung zwischen den beiden Anomeren kann im Polarimeter beobachtet werden, da reine α-D-Glucose einen spezifischen Drehwinkel von +112° hat, reine β-D-Glucose von +18,7°. Hat sich nach einer gewissen Zeit das Gleichgewicht eingestellt, liegt ein Drehwinkel von +52,7° vor. Diese Veränderung des Drehwinkels wird als Mutarotation bezeichnet. Durch Zugabe von Säure oder Base kann diese Umwandlung massiv beschleunigt werden. Die Gleichgewichtseinstellung läuft über die offenkettige Aldehyd-Form.
Isomerisierung
In verdünnter Natronlauge werden Mannose, Glucose und Fructose ineinander umgewandelt (Lobry-de-Bruyn-Alberda-van-Ekenstein-Umlagerung), so dass sich ein Gleichgewicht zwischen diesen Isomeren ausbildet. Diese Reaktion verläuft über ein Endiol:
R-CH(OH)-CH=O R-C(OH)=CH-OH R-C(=O)-CH2-OH
Analytik
Klassische qualitative Nachweisreaktionen
Diese Reaktionen haben nur historische Bedeutung:
Fehling-Reaktion
Die Fehling-Probe ist ein klassischer Nachweis für Aldosen. Aufgrund der Mutarotation liegt Glucose immer zu einem geringen Anteil als offenkettiger Aldehyd vor. Durch Zugabe der Fehling-Reagenzien wird die Aldehydgruppe zur Carbonsäure oxidiert, während der Cu2+-Tartratkomplex zu Cu+ reduziert wird und als roter Niederschlag (Cu2O) ausfällt.
Tollens-Reaktion
Nach Zugabe von ammoniakalischen AgNO3 zur Probelösung wird Ag+ von Glucose zu elementarem Silber reduziert, welches sich an der Gefäßwand als Silberspiegel ablagert.
Instrumentelle quantitative Bestimmung
Optische Methoden zur Bestimmung der Glucosekonzentration
Photometrisch-enzymatische Verfahren in Lösung
Das Enzym Glucose-Oxidase (GOx) setzt Glucose unter Verbrauch von Sauerstoff zu Gluconsäure und Wasserstoffperoxid um. Ein weiteres Enzym, die Peroxidase, katalysiert eine chromogene Reaktion (Trinder-Reaktion) von Phenol mit 4-Aminoantipyrin zu einem violetten Farbstoff.[14]
Photometrische Teststreifen-Methode
Die Teststreifen-Methode bedient sich der oben erwähnten enzymatischen Umsetzung von Glucose zu Gluconsäure unter Bildung von Wasserstoffperoxid. Die Reagenzien sind auf einer Polymermatrix immobilisiert, dem sog. Teststreifen, der eine mehr oder weniger starke Farbe annimmt. Diese kann mit Hilfe eines LED-basierten Handphotometers bei 510 nm reflektometrisch ausgelesen werden. Dies ermöglicht die routinemäßige Blutzuckerbestimmung durch Laien. Neben der Reaktion von Phenol mit 4-Aminoantipyrin wurden neue chromogene Reaktionen entwickelt, welche die Photometrie bei höheren Wellenlängen (550 nm, 750 nm) erlauben.[15]
Amperometrische Glucosesensorik
Die Elektroanalytik der Glucose basiert ebenfalls auf der oben erwähnten enzymatischen Umsetzung. Das produzierte Wasserstoffperoxid kann durch anodische Oxidation bei einem Potential von 600 mV amperometrisch quantifiziert werden[16]. Die GOx wird auf der Elektrodenoberfläche oder in einer dicht vor der Elektrode angeordneten Membran immobilisiert. Als Elektroden kommen neben den klassischen Edelmetallen wie Platin oder Gold in jüngster Zeit immer häufiger Kohlenstoffnanoröhren-Elektroden zum Einsatz, welche z. B. mit Bor dotiert wurden.[17]. Auch Cu-CuO-Nanodrähte finden als enzymfreie amperometrische Elektroden Verwendung. Es wurde damit eine Nachweisgrenze von 50 µmol/L erzielt.[18]. Eine besonders aussichtsreiche Methode besteht im sog. „enzyme wiring“. Dabei wird das bei der Oxidation fließende Elektron direkt aus dem Enzym über einen molekularen Draht auf die Elektrode abgeleitet.[19]
Andere sensorische Methoden
Für die Glucose gibt es eine Vielzahl anderer chemischer Sensoren [20]. Angesichts der Bedeutung der Analytik von Glucose in den Biowissenschaften sind auch zahlreiche optische Sonden für Saccharide entwickelt worden, die auf der Verwendung von Boronsäuren[21] beruhen und vor allem für intrazelluläre, sensorische Anwendungen in Frage kommen, wo andere (optische) Methoden gar nicht oder nur bedingt einsetzbar sind. Neben den organischen Boronsäurenderivaten, welche oft hochspezifisch an die 1,2-Diolgruppen der Zucker binden, gibt es noch weitere nach Funktionsmechanismen klassifizierte Sondenkonzepte, die selektive Glucose-bindende Proteine (z. B. Concanavalin A) als Rezeptor verwenden [20]. Des Weiteren wurden Methoden entwickelt, welche die Glucosekonzentration indirekt über die Konzentration von verstoffwechselten Produkten erfassen, z. B. den Verbrauch von Sauerstoff mit Hilfe fluoreszenz-optischer Sensoren.[22] Schließlich gibt es enzymbasierte Konzepte, die die intrinsische Absorbanz bzw. Fluoreszenz von (fluoreszenzmarkierten) Enzymen als Informationsträger nutzen.[20]
Biotechnologische Produkte aus Glucose
Glucose ist ein bedeutender biotechnologischer Rohstoff. Folgende Schautafel gibt einen kurzen Überblick über wichtige Produkte (Klick auf die Namen führt zu den entsprechenden Artikeln). Die industriell interessanten Produkte bzw. deren Vorstufen sind fett gekennzeichnet:
Merkhilfen zur Stereochemie

Um sich die Glucose-Konfiguration in der Fischer-Projektion zu merken, gibt es folgende Eselsbrücke: Die Positionen der Hydroxygruppen rechts und links der Kohlenstoffkette lassen sich durch „Ta-Tü-Ta-Ta“ (wie das Martinshorn) „versinnbildlichen“. Die Anordnung der Hydroxygruppen der Galactose kann man sich hingegen als Blaulicht (siehe Abbildung) merken.
Siehe auch
Literatur
- Jochen Lehmann: Kohlenhydrate. Chemie und Biologie. 2. neu bearb. und erw. Aufl., Thieme, Stuttgart; New York 1996.
- Stefan Schenk: Glucose. Der Energielieferant des Körpers. 1. Aufl. München, 2001.
Weblinks
Einzelnachweise
- ↑ 1,0 1,1 1,2 1,3 1,4 Eintrag zu CAS-Nr. 50-99-7 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 29. März. 2008 (JavaScript erforderlich).
- ↑ Alfred Töpel: Chemie und Physik der Milch: Naturstoff - Rohstoff - Lebensmittel. Behr's Verlag DE, 2004, ISBN 389947131-8, S. 101 (eingeschränkte Vorschau in der Google Buchsuche).
- ↑ CRC Handbook of Chemistry and Physics, 90. Auflage, CRC Press, Boca Raton, Florida, 2009, ISBN 978-1-4200-9084-0, Section 3, Physical Constants of Organic Compounds, S. 3-268.
- ↑ Datenblatt Glucose bei Carl Roth, abgerufen am 24. August 2010.
- ↑ The Development of Modern Chemistry. Aaron J. Ihde. Harper and Row, New York, 1964.
- ↑ 6,0 6,1 Essentials of Carbohydrate Chemistry. by John F. Robyt. Springer Advanced Texts in Chemistry, 1998. ISBN 0-387-94951-8.
- ↑ http://www.chem.qmul.ac.uk/iupac/2carb/.
- ↑ Autorenkollektiv: Stärkezucker. Merck's Warenlexikon, Verlag von G. A. Gloeckner, Leipzig, Dritte Auflage, 1884, S. 547–548.
- ↑ Suchergebnis UniProt.
- ↑ Suchergebnis UniProt.
- ↑ Schmidt, Lang: Physiologie des Menschen, Springer Verlag 2007, 30. Auflage, Seite 907.
- ↑ Dandekar T, Schuster S, Snel B, Huynen M, Bork P: Pathway alignment: application to the comparative analysis of glycolytic enzymes. In: Biochem. J.. 343 Pt 1, Oktober 1999, S. 115–24. PMID 10493919. Volltext bei PMC: 1220531.
- ↑ W. A. Scherbaum, B. M. Lobnig, in: Wolff, Weihrauch: Internistische Therapie, 16. Auflage, Elsevier, München S. 927 u. S. 985.
- ↑ P. Trinder; Determination of glucose in blood using glucose oxidase with an alternative oxygen acceptor; Annals of Clinical Biochemistry 6 (1969) 24-27.
- ↑ M. Mizoguchi, M. Ishiyama, M. Shiga, K. Sasamoto; Water-soluble chromogenic reagent for cholorimetric detection of hydrogen peroxide – an alternative to 4-aminoantipyrine working at a long wavelength; Analytical Communications 35 (1998) 71-73.
- ↑ J. Wang; Electrochemical Glucose Biosensors; Chem. Rev. 108 (2008) 814-825.
- ↑ X. Chen, J. Chen, Ch. Deng, Ch. Xiau, Y. Yang, Z. Nie, S. Yao; Amperometric glucose biosensor based on boron-doped carbon nanotubes modified electrode; Talanta 76 (2008) 763-767.
- ↑ G. Wang, Y. Wei, W. Zhang, X. Zhang, B. Fang, L. Wang; Enzyme-free amperometric sensing of glucose using Cu-CuO nanowire composites; Microchimica Acta 168 (2010) 87-92.
- ↑ T. J. Ohara, R. Rajagopaian, A. Heller; „Wired“ Enzyme Electrodes for Amperometric Determination of Glucose or Lactate in the Presence of Interfering Substances; Anal. Chem. 66 (1994) 2451–2457.
- ↑ 20,0 20,1 20,2 S.M. Borisov, O.S. Wolfbeis; Optical Biosensors; Chem. Rev. 108 (2008) 423-461.
- ↑ H.S. Mader, O.S. Wolfbeis; Boronic acid based probes for microdetermination of saccharides and glycosylated biomolecules; Microchimica Acta 162 (2008) 1-34.
- ↑ O.S. Wolfbeis, I. Oehme, N. Papkovskaya, I. Klimant; Glucose Biosensors Employing Optical Oxygen Transducers, and a Method for Compensating for Variable Oxygen Background; Biosensors and Bioelectronics 15 (2000) 69-76.