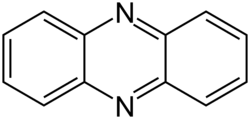
Phenazin
| Strukturformel | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||
| Allgemeines | |||||||||||||||
| Name | Phenazin | ||||||||||||||
| Andere Namen |
Dibenzopyrazin | ||||||||||||||
| Summenformel | C12H8N2 | ||||||||||||||
| CAS-Nummer | 92-82-0 | ||||||||||||||
| PubChem | 4757 | ||||||||||||||
| Kurzbeschreibung |
gelber Feststoff[1] | ||||||||||||||
| Eigenschaften | |||||||||||||||
| Molare Masse | 180,21 g·mol−1 | ||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||
| Schmelzpunkt | |||||||||||||||
| Siedepunkt | |||||||||||||||
| Löslichkeit |
| ||||||||||||||
| Sicherheitshinweise | |||||||||||||||
| |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||
Phenazin ist eine polycyclische aromatische chemische Verbindung mit zwei Stickstoffatomen im mittleren der drei Ringe. Diese Struktur liegt auch im Pyrazin als Einzelring vor. Phenazin ist ein gelber Feststoff[1] und ist Ausgangsstoff für viele abgeleitete Verbindungen, die als Farbstoffe (z. B. Neutralrot, Safranin, Eurhodin, Indulin, Pyocyanin, Mauvein) dienen.
Vorkommen
Einige Phenazinderivate besitzen eine antibiotischer Wirkung und werden deshalb von vielen Bakterien (z.B. Pseudomonas aeruginosa, Streptomyces, Pantoea agglomerans) synthetisiert und zur Verteidigung ihres Lebensraums in die Umgebung abgegeben[6]. Die Biosynthese der beiden sechsgliedrigen Kohlenstoffringe der Phenazine erfolgt auf dem Shikimisäureweg der Aromatenbiosynthese über Chorisminsäure.[6][7][8]Fast 100 solcher in der Natur vorkommenden Verbindungen sind inzwischen identifiziert[9].
Gewinnung und Darstellung
Eine klassische Methode zur Synthese von Phenazin ist die Reaktion von Nitrobenzol und Anilin bei der Wohl-Aue-Reaktion (1901).[10][11] Es sind aber noch weitere Methoden bekannt:
- Oxidation von Dihydrophenazin, welches durch Erhitzung von Brenzcatechin mit ortho-Phenylendiamin gewonnen werden kann[12]
- Cyclisierung von ortho-Aminodiphenylamin mit Salzsäure und Eisen(III)-chlorid[13]
Verwendung
Phenazin ist Ausgangsstoff für viele Farbstoffe (auch als Azin-Farbstoffe bezeichnet) wie Neutralrot, Safranin und Mauvein, wobei der Ring mit den beiden Stickstoffatomen als Chromophor auftritt. Phenazin-Farbstoffe enthalten im Allgemeinen die Struktur von Phenazin als Grundgerüst für diese Farbstoffklasse. Der Phenazinring und Phenazinderivate sind wichtige Ausgangsstoffe für die industrielle Herstellung von Pestiziden, Riechstoffen und Arzneistoffen. Phenazin ist weiterhin ein Komplexbildner.
Einzelnachweise
- ↑ 1,0 1,1 1,2 1,3 1,4 Datenblatt Phenazin bei AlfaAesar, abgerufen am 9. März 2010 (JavaScript erforderlich).
- ↑ Ullrich Jahn: Römpp Online - Version 3.5, 2009, Georg Thieme Verlag, Stuttgart.
- ↑ Datenblatt Phenazine bei Sigma-Aldrich, abgerufen am 18. April 2011.
- ↑ Seit 1. Dezember 2012 ist für Stoffe ausschließlich die GHS-Gefahrstoffkennzeichnung zulässig. Bis zum 1. Juni 2015 dürfen noch die R-Sätze dieses Stoffes für die Einstufung von Zubereitungen herangezogen werden, anschließend ist die EU-Gefahrstoffkennzeichnung von rein historischem Interesse.
- ↑ Datenblatt Phenazin bei ChemBlink, abgerufen am 25. Februar 2011.
- ↑ 6,0 6,1 Die Biosynthese von Phenazinen.
- ↑ G.S. Byng J. Gen. Microbiology 97 (1976) 57–62.
- ↑ G.S. Byng u. J.M. Turner Biochem. J. 164 (1977) 139–145.
- ↑ Strukturgestützte Untersuchungen zur Phenazin-Biochemie.
- ↑ A. Wohl, W. Aue, Ueber die Einwirkung von Nitrobenzol auf Anilin bei Gegenwart von Alkali, in: Chem. Ber., 1901, 34, 2442–2450; doi:10.1002/cber.190103402183.
- ↑ I. J. Pachter and M. C. Kloetzel: The Wohl-Aue Reaction. I. Structure of Benzo [a] phenazine Oxides and Syntheses of 1,6-Dimethoxyphenazine and 1,6-Dichlorophenazine, in: J. Am. Chem. Soc., 1951; 73(10), 4958–4961; doi:10.1021/ja01154a144.
- ↑ C. Ris: Ueber das Phenazin, in: Chem. Ber. 1882, 19, 2206–2208; doi:10.1002/cber.188601902128.
- ↑ M. L. Tomlinson: The preparation of 2:2′-diaminodiphenylamines and 2:2′-diacetamidodiphenylamines and their behaviour on oxidation, in: J. Chem. Soc., 1939, 158–163; doi:10.1039/JR9390000158.