Homochiralität
Der Begriff Homochiralität wird verwendet, um eine Gruppe von Molekülen zu beschreiben, die den gleichen Chiralitätssinn besitzen. Die Moleküle sind dabei nicht unbedingt identisch, aber ähnliche Substituenten sind auf die gleiche Weise um ein zentrales Atom, das Chiralitätszentrum, angeordnet. Homochiralität wird vor allem in lebenden Organismen beobachtet. So haben beispielsweise alle natürlich vorkommenden Aminosäuren die L-Form. Ebenso besitzen die meisten biologisch relevanten Zucker die D-Form. Die entsprechenden anderen Enantiomere dieser Moleküle sind üblicherweise biologisch inaktiv und zum Teil sogar toxisch für lebende Organismen. Der Ursprung dieses Phänomens ist noch nicht vollständig geklärt. Es ist noch nicht einmal geklärt, ob Homochiralität einen Zweck hat. Eine Theorie besagt, dass Homochiralität die Entropiebarriere bei der Ausbildung großer, organisierter Moleküle verringert. Es wurde experimentell nachgewiesen, dass Aminosäuren große Aggregate in größerer Ausbeute bilden, wenn sie enantiomerenrein und nicht als Racemat vorliegen[1].
Homochiralität soll sich in drei Schritten entwickeln: Durch den Bruch der Spiegelsymmetrie entsteht ein winziges, enantiomeres Ungleichgewicht, dies ist der Schlüssel zur Homochiralität. Die Chirale Amplifizierung führt zu einer enantiomeren Anreicherung. Chiralitätsübertragung erlaubt die Übertragung der Chiralität von einer Molekülgruppe auf eine andere.
Bruch der Spiegelsymmetrie
Die am schwierigsten zu beantwortende Frage ist, wie ein enantiomeres Ungleichgewicht ursprünglich erzeugt wird. Einige Wissenschaftler unterstützen die Theorie einer extraterrestrischen Herkunft, was auf der Entdeckung eines Enantiomerenüberschusses in verschiedenen, insbesondere alpha-methylierten Aminosäuren im Murchison-Meteorit basiert. Es gibt Beweise für die Existenz zirkular polarisierten Lichts im Weltraum, welches vermutlich durch Mie-Streuung an ausgerichteten interstellaren Staubpartikeln entstanden ist. Die Wechselwirkung dieses zirkular polarisierten Lichtes mit racemischen organischen Verbindungen könnte die Bildung eines kleinen Enantiomerenüberschusses ausgelöst haben. Unter simulierten Weltraumbedingungen gelang es mithilfe von zirkular polarisierter Synchrotronstrahlung einen Enantiomerenüberschuss von 2,6 % in die Aminosäure Leucin zu induzieren.[2]
Eine klassische Studie beinhaltet ein Laborexperiment[3]. Wenn Natriumchlorat aus Wasser auskristallisiert und die gewonnenen Kristalle in einem Polarimeter untersucht werden, stellt man fest, dass jeder Kristall chiral ist und ausschließlich aus der L- bzw. D-Form besteht. In einem normalen Experiment sind die jeweiligen Mengen an L- und D-Kristallen gleich, wenn statistische Effekte korrigiert werden. Wenn die Natriumchloratlösung jedoch während des Kristallisationsprozesses gerührt wird, erhält man ausschließlich L- oder D-Kristalle. Bei 32 Kristallisationsexperimenten ergaben 14 Experimente D-Kristalle und die restlichen 18 Experimente L-Kristalle. Es gibt keine eindeutige Erklärung für diesen Bruch der Symmetrie, aber man nimmt an, dass es mit der Autokatalyse zusammenhängt, die beim Keimbildungsprozess stattfindet.
Chirale Amplifizierung
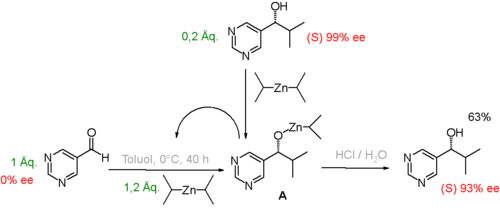
In Laborexperimenten konnte demonstriert werden, wie in bestimmten autokatalytischen Reaktionssystemen die Präsenz von kleinen Mengen des Reaktionsprodukts mit Enantiomerenüberschuss am Reaktionsbeginn zu einem viel größeren Enantiomerenüberschuss am Ende der Reaktion führen kann. In einer wegweisenden Studie[4] wurde Pyrimidin-5-carbaldehyd (Abb. 1) mit Diisopropylzink zum entsprechenden Pyrimidyl-Alkohol alkyliert. Das anfängliche Reaktionsprodukt ist auch ein effizienter Katalysator, somit ist die Reaktion autokatalytisch. Die Anwesenheit von nur 0,2 Äquivalenten des S-Enantiomers des gebildeten Alkohols am Beginn der Reaktion ist ausreichend, um den Enantiomerenüberschuss auf 93 % zu erhöhen.
Eine andere Studie[5] betrifft die Prolin-katalysierte Aminoxylierung von Propanal mit Nitrosobenzol (Abb. 2). In diesem System führt die Anwesenheit eines enantiomer angereicherten Katalysators ebenfalls zu einem der beiden möglichen, optischen Isomere.

Serin-Octamer-Cluster[6][7] sind ein weiteres Beispiel. Diese Cluster, die aus acht Serin-Molekülen bestehen, zeigen in der Massenspektrometrie eine ungewöhnliche homochirale Präferenz, es gibt jedoch keinen Beweis, dass solche Cluster unter nicht-ionisierenden Bedingungen existieren. Zudem ist das Verhalten der Aminosäuren an Phasengrenzen präbiotisch weitaus relevanter.[8] Die Beobachtung, dass die partielle Sublimation einer um 10 % enantiomer angereicherten Probe von Leucin zu einer Anreicherung von bis zu 82 % im Sublimat führt, zeigt, dass eine Enantiomerenanreicherung bei Aminosäuren auch im Weltraum erfolgen könnte.[9] Partielle Sublimationsprozesse können auf der Oberfläche von Meteoren stattfinden, wo große Temperaturvariationen vorkommen. Diese Entdeckung könnte Konsequenzen für die Entwicklung des Mars Organics Detectors haben, dessen Start für 2013 geplant ist. Diese Sonde soll kleine Mengen Aminosäuren mittels einer Sublimationstechnik von der Marsoberfläche gewinnen.
Eine hohe Amplifizierung des Enantiomerenüberschusses von Zuckern wird auch bei der Aminosäuren-katalysierten, asymmetrischen Bildung von Kohlenwasserstoffen beobachtet.[10]
Chiralitätsübertragung
Viele Strategien der stereoselektiven Synthese basieren auf Chiralitätsübertragung. Besonders wichtig ist die sogenannte Organokatalyse organischer Reaktionen durch Prolin, zum Beispiel bei Mannich-Reaktionen.
Racematspaltung bei racemischen Aminosäuren
Es existiert keine Theorie, die die Korrelation zwischen L-Aminosäuren aufklärt. Vergleicht man beispielsweise Alanin, das eine kleine Methylgruppe trägt, und Phenylalanin, das eine große Benzylgruppe besitzt, stellt sich die einfache Frage, in welchem Aspekt L-Alanin dem L-Phenylalanin mehr ähnelt als dem D-Phenylalanin und welche Art von Mechanismus die Selektion aller L-Aminosäuren bewirkt. Es wäre genauso möglich, dass natürliches Alanin eine L-Konfiguration besitzt, natürliches Phenylalanin hingegen eine D-Konfiguration.
Im Jahr 2004 wurde berichtet[11], dass ein Überschuss von racemischem D,L-Asparagin (Asn), das während der Umkristallisation spontan Kristalle der reinen Isomere bildet, die Racematspaltung einer ebenfalls in Lösung befindlichen, racemischen Aminosäure, wie zum Beispiel Arginin (Arg), Asparaginsäure (Asp), Glutamin (Gln), Histidin (His), Leucin (Leu), Methionin (Met), Phenylalanin (Phe), Serin (Ser), Valin (Val), Tyrosin (Tyr) und Tryptophan (Trp), induziert. Der Enantiomerenüberschuss dieser zweiten Aminosäuren korreliert fast linear mit dem entsprechenden Wert der induzierenden Aminosäure, also Asparagin. Bei der Umkristallisation einer Mischung von 12 D,L-Aminosäuren (Ala, Asp, Arg, Glu, Gln, His, Leu, Met, Ser, Val, Phe und Tyr) und einem Überschuss D,L-Asn wurde festgestellt, dass alle Aminosäuren mit der gleichen Konfiguration wie Asn bevorzugt mit auskristallisierten.[11] Es hing vom Zufall ab, ob die Anreicherung mit dem L- oder D-Asparagin erfolgte. Sobald jedoch die Auswahl getroffen war, wurde die koexistierende Aminosäure mit der gleichen Konfiguration am α-Kohlenstoffatom bevorzugt mit einbezogen, was sich mit der thermodynamischen Stabilität der gebildeten Kristallstrukturen erklären lässt. Der höchste berichtete Enantiomerenüberschuss lag bei 100 %. Basierend auf diesen Resultaten wird angenommen, dass aus einer Mischung racemischer Aminosäuren eine spontane und effektive Racematspaltung erfolgen kann, selbst wenn die asymmetrische Synthese einer einzelnen Aminosäure ohne die Hilfe eines optisch aktiven Moleküls nicht stattfinden kann.
Dies ist die erste Studie, die die Entstehung von Chiralität aus racemischen Aminosäuren mit experimentellen Beweisen erklärt.
Geschichte
Der Begriff Homochiralität wurde von Kelvin 1904 eingeführt, demselben Jahr, in dem er seine "Baltimore Lecture" von 1884 veröffentlichte.[10][12] In letzter Zeit wurde der Begriff homochiral jedoch auch im selben Sinne wie enantiomerenrein verwendet. Dies ist in einigen Journalen erlaubt, es wird jedoch nicht ermutigt. In diesen Journalen bedeutet der Begriff allerdings, dass bei einem Prozess oder System ein einzelnes von zwei optischen Isomeren bevorzugt wird.
Siehe auch
Einzelnachweise
- ↑ R. R. Julian, S. Myung, D. E. Clemmer: Do Homochiral Aggregates Have an Entropic Advantage? In: J. Phys. Chem. B 2005, 109, 440-444; doi:10.1021/jp046478x.
- ↑ U. J. Meierhenrich: Asymmetrische Vakuum-UV-Photolyse der Aminosäure Leucin in fester Phase. In: Angewandte Chemie 2005, 117, 5774-5779;doi:10.1002/ange.200501311.
- ↑ D. K. Kondepudi, R. J. Kaufman, S. Singh: Chiral Symmetry Breaking in Sodium Chlorate Crystallization. In: Science 1990, 250, 975-976.
- ↑ T. Shibata, H. Morioka, T. Hayase, K. Choji, K. Soai: Highly Enantioselective Catalytic Asymmetric Automultiplication of Chiral Pyrimidyl Alcohol. In: J. Am. Chem. Soc. 1996, 118, 471-472. doi:10.1021/ja953066g
- ↑ P. M. Suju, H. Iwamura, D. G. Blackmond: Amplification of Enantiomeric Excess in a Proline-Mediated Reaction. In. Angew. Chem. Int. Ed. 2004, 43, 3317-3321.
- ↑ R. G. Cooks, D. Zhang und K. J. Koch: Chiroselective Self-Directed Octamerization of Serine: Implications for Homochirogenesis. In. Anal. Chem. 2001, 73, 3646-3655; doi:10.1021/ac010284l.
- ↑ S. C. Nanita, R. G. Cooks: Serinoctamere: Clusterbildung, Reaktionen und Auswirkungen auf die Homochiralität von Biomolekülen. In: Angew. Chem. 2006, 118, 568-583. doi:10.1002/ange.200501328
- ↑ D. G. Blackmond, M. Klussmann: Spoilt for choice: assessing phase behaviour models for the evolution of homochirality. In: Chem. Commun. 2007, 3990–3996; doi:10.1039/b709314b.
- ↑ S. P. Fletcher, R: B. C. Jagt, B. L. Feringa: An astrophysically relevant mechanism for amino acid enantiomer enrichment. In: Chem. Commun. 2007, 2578-2580; doi:10.1039/b702882b.
- ↑ 10,0 10,1 A. Córdova, M. Engqvist, I. Ibrahem, J. Casas, H. Sundén: Plausible origins of homochirality in the amino acid catalyzed neogenesis of carbohydrates. In: Chem. Commun. 2005, 15, 2047-2049.
- ↑ 11,0 11,1 S. Kojo, H. Uchino, M. Yoshimura, K. Tanaka: Racemic D,L-asparagine causes enantiomeric excess of other coexisting racemic D,L-amino acids during recrystallization: a hypothesis accounting for the origin of L-amino acids in the biosphere, in: Chem. Commun. 2004, 2146-2147; doi:10.1039/b409941a.
- ↑ D. G. Morris: Stereochemistry. Royal Society of Chemistry, Cambridge 2001, S. 30.
Weblinks
- On the Genesis of Homochirality. A. Maureen Rouhi, Chemical & Engineering News, 17. Juni 2004.
- Scienceweek digest 1998
- How left-handed amino acids got ahead: a demonstration of the evolution of biological homochirality in the lab. Pressemitteilung, Imperial College London, 2004.