Campher
| Strukturformel | |||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| (+)-Campher (links) und (–)-Campher (rechts) | |||||||||||||||||||||
| Allgemeines | |||||||||||||||||||||
| Name | Campher | ||||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||||
| Summenformel | C10H16O | ||||||||||||||||||||
| CAS-Nummer |
| ||||||||||||||||||||
| ATC-Code | |||||||||||||||||||||
| Kurzbeschreibung |
farbloser Feststoff mit aromatischem Geruch[1] | ||||||||||||||||||||
| Eigenschaften | |||||||||||||||||||||
| Molare Masse | 152,23 g·mol−1 | ||||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||||
| Dichte |
0,99 g·cm−3 [(±)-Campher] [1] | ||||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||||
| Siedepunkt |
209 °C [(±)-Campher][1] | ||||||||||||||||||||
| Dampfdruck | |||||||||||||||||||||
| Löslichkeit |
unlöslich in Wasser[1] | ||||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||||
| |||||||||||||||||||||
| MAK |
13 mg·m−3, 2 ml·m−3[1] | ||||||||||||||||||||
| LD50 | |||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||||
Campher bzw. Camphora (fachsprachlich, standardsprachlich: Kampfer) ist ein farbloser Feststoff. Er ist ein bicyclisches Monoterpen-Keton und leitet sich formal vom Camphan ab. Es gibt zwei Enantiomere des Camphers, (+)-Campher [Synonym: (1R,4R)-Campher] und (−)-Campher [Synonym: (1S,4S)-Campher]. Die Struktur wurde von Julius Bredt aufgeklärt.
Campher kommt in verschiedenen Gewächsen natürlich vor und wird industriell synthetisch hergestellt. Er ist arzneilich wirksam, in missbräuchlicher Dosierung psychoaktiv und toxisch und in großen Mengen ein Gefahrstoff geringerer Gefährlichkeit, der u. a. als Bestandteil verschiedener Chemieprodukte eingesetzt wird.
Campher ist in Europa seit der Spätantike (5. Jahrhundert) unter dem griechischen Namen kaphoura (καφουρά) bekannt, der auf Sanskrit karpura bzw. Prakrit kappura zurückgeht. Der indische Name wiederum entstand durch Entlehnung aus einer austronesischen Sprache Sumatras.
Vorkommen
Beide Enantiomere des Camphers [(+)-Campher bzw. (−)-Campher] sowie das Racemat (±)-Campher kommen in der Natur vor[5]. Campher findet sich hauptsächlich in den ätherischen Ölen von Lorbeergewächsen, Korbblütlern und Lippenblütlern. (+)-Campher kommt in der Rinde und im Harz des Campherbaums (Cinnamomum camphora), eines immergrünen Baums, der hauptsächlich in Asien wächst, vor[5].
Eigenschaften
Campher ist ein farbloses oder weißes, meist krümeliges und brockig zähes Pulver aus wachsweichen Kristallen. Mit Ethanol können rhomboedrische Kristalle erzeugt werden. Beim Abschrecken geschmolzenen Camphers bilden sich kubische Kristalle. Campher hat einen charakteristischen, starken, wohlriechenden, aromatisch-holzigen, eukalyptusartigen Geruch. Der Geschmack ist scharf und bitter, auch leicht kühlend wie bei Menthol. Er schmilzt bei 177 °C und siedet bei 207 °C. In Wasser ist das Pulver kaum löslich (1,2 g pro Liter Wasser); in Ethanol hingegen löst es sich gut. Außerdem ist es sehr leicht löslich in Petrolether, leicht löslich in Ether, Aceton, Chloroform und in fetten Ölen und sehr schwer löslich in Glycerol. Es bildet mit Ethanol farblose Lösungen, aus denen sich, wenn Wasser hinzugegeben wird, das Campher wieder abscheidet. Die Dichte beträgt 0,96 g/cm3. Campher ist leicht flüchtig und sublimiert schon bei Zimmertemperatur. Er verbrennt mit rußender Flamme. Der Flammpunkt liegt bei 74 °C, die Zündtemperatur bei 466 °C. Zwischen einem Luftvolumenanteil von 0,6 und 3,5 % bildet er explosive Gemische. Beim Campher ist die molare Schmelzpunkterniedrigung auffällig groß: Die Gefrierpunkterniedrigung beträgt 39,7 °C·(kg/mol). So verflüssigt sich Campher bereits, wenn es in Kontakt mit Menthol, Naphthol oder Chloralhydrat kommt. Der spezifische Drehwinkel beträgt +48 °.
Wirkungen und Nebenwirkungen
Campher wirkt auf das Zentrale Nervensystem und die Niere, in höheren Dosen auch auf das Atemzentrum. Er ist durchblutungsfördernd und schleimlösend, führt aber auch zu Übelkeit, Angst, Atemnot und Aufgeregtheit. In Überdosis oral eingenommen, kommt es zu Verwirrtheits- und Dämmerzuständen, Depersonalisation, extremen Déjà-vu-Erlebnissen, Panik und akuten tiefgreifenden Störungen des Kurzzeitgedächtnisses bis hin zu Amnesie und epileptischen Anfällen. Die tödliche Dosis für einen Erwachsenen liegt bei 0,1 g/kg Körpermasse[6]. Der Metabolismus geht zunächst zum vom Campher abgeleiteten Alkohol 2-Borneol, welcher in der Leber weiter zum Glucuronid umgewandelt wird. Dieses wird schließlich über den Harn ausgeschieden[7].
Campher ist schwach wassergefährdend (WGK 1).
Verwendung

Chemieprodukte: Campher wird in Feuerwerkskörpern, teilweise in Sprenggelatine und in Mottenabwehrmitteln verwendet. Außerdem wird er für die Celluloidproduktion und als Weichmacher für Celluloseester verwendet.
Biologische und physikalische Anwendungen: In der Bienenpflege findet Campher als von der EU zugelassener Wirkstoff gegen Milbenbefall eine Anwendung. Auch in Sturmglasbarometern findet er Verwendung.
Medizin und Kosmetik: In geringen Mengen wird er in Kosmetik- und Medizinpräparaten benutzt, zum Beispiel bei Muskelzerrungen, Rheuma oder Neuralgien, in Mitteln gegen Erkältungen, in der Zahnmedizin zur Desinfektion von infizierten Wurzelkanälen; früher wurde er auch als Analeptikum verwendet, heute jedoch seltener wegen der Wirkungen auf das Herz und den Kreislauf.
Genuss- und Rauschmittel: Seltene Fälle der Verwendung von Campher als Rauschmittel sind bekannt. Die Wirkungen beim Inhalieren von Campher zeigen sich in Lachanfällen trotz Schmerzen in den Atemwegen. Campher findet noch Verwendung in Schnupftabak aus England, wohingegen er in Deutschland laut Tabakverordnung zu den in Tabak verbotenen Stoffen zählt und nicht hinzugefügt werden darf.
Religiöse Praxis: Allein oder in Verbindung mit Baumharzen und/oder anderen Stoffen wird er als Räucherwerk beim Räuchern verwendet. Ferner werden im Islam die Verstorbenen während der letzten Waschung häufig mit Waschwasser gereinigt, dem zur Parfümierung Campher beigemischt wurde.[8]
Wegen seiner hohen Kryoskopischen Konstanten, sie beträgt 39,7 K·(kg/mol), wurde Campher früher zur Bestimmung der Molmasse nach Beckmann genutzt.
Bei der Reduktion von Campher mit Natriumborhydrid oder Lithiumaluminiumhydrid entsteht vorwiegend das Stereoisomer Isoborneol:[9]
Pharmakologische Eigenschaften und Anwendungen
Campher wird heute fast nur noch äußerlich in Form 10 %iger Salben angewendet, höhere Konzentrationen können zu schweren Vergiftungen führen. Die Salben wirken durchblutungsfördernd und werden bei chronischer Arthritis, Sehnenscheidenentzündung, traumatischer Schwellung, Myalgie, Bursitis, Zerrung, Verstauchung und entzündlichem Ödem eingesetzt. Konzentrationen von 0,1 % haben eine geringe lokalanästhetische und durch Reizung von Kälteempfindungen leitender Nervenendigungen kühlende Wirkung. Campher wird schnell über die Haut resorbiert und gelangt über das Blutplasma vor allem in das Fettgewebe. Es passiert die Blut-Hirn-Schranke, die Blut-Milch-Schranke und die Plazentaschranke. Die Metabolisierung erfolgt zu Carbonsäuren und/oder Campheralkoholen, teilweise wird der Wirkstoff glukuronidiert. Die Ausscheidung erfolgt vor allem über die Niere, in geringer Menge auch über die Lunge, den Kot und die Milch.[6]
Campher ist das älteste Analeptikum. Analeptika steigern in geeignetem Dosisbereich die Aktivität bestimmter Abschnitte des Zentralnervensystems. Die pharmakologische Anwendung von Campher wird heute als obsolet bezeichnet. Die früher übliche Anwendung von Campher zusammen mit Pentetrazol (Cardiazol ®) in der Krampfbehandlung von Geisteskrankheiten erlebte einen Höhepunkt um 1938. Die Bezeichnung der Cardiazolschockbehandlung ist im Schrifttum der Geschichte der Psychiatrie noch heute gebräuchlich.[10] [11]
Gewinnung und Darstellung
Campher kann synthetisch hergestellt, aber auch durch Wasserdampfdestillation und Kristallisation aus zerkleinerten Pflanzenteilen des Campherbaums gewonnen werden. Natürlicher Campher ist meistens rechtsdrehend ((+)-Campher, "Japancampher". In Matricariaarten findet sich aber auch linksdrehender (–)-Campher ("Matricariacampher")[12]. Heutzutage wird Campher technisch ausgehend von α-Pinen synthetisiert. Über das intermediäre Carboniumion entsteht dabei hauptsächlich das thermodynamisch stabilere Isobornylacetat, welches in der Folge nach Hydrolyse des Esters zu (–)-Campher oxidiert wird.
α-Pinen wird protoniert; durch Wagner-Meerwein-Umlagerung wird es zu Bornan in Form eines Carboniumions umgelagert. Dieses reagiert mit Natriumacetat zu Isobornylacetat, welches anschließend zum Isoborneol hydrolysiert und zum Schluss zum Campher oxidiert wird.
Biosynthese
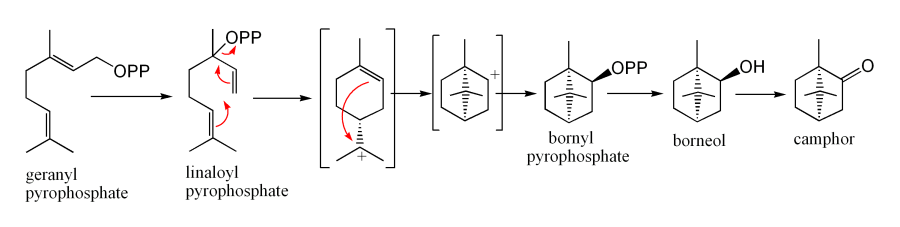
Aus Geranylpyrophosphat über Cyclisierung von Linalool-Pyrophosphat zu Bornyl-Pyrophosphat gefolgt von einer Hydrolyse zu Borneol und anschließender Oxidation entsteht Kampfer enzymatisch im Salbei (Salvia officinalis).[13]
Einzelnachweise
- ↑ 1,0 1,1 1,2 1,3 1,4 1,5 1,6 1,7 Eintrag zu CAS-Nr. 76-22-2 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2008 (JavaScript erforderlich).
- ↑ 2,0 2,1 2,2 Datenblatt Campher bei Sigma-Aldrich, abgerufen am 15. März 2011.
- ↑ Seit 1. Dezember 2012 ist für Stoffe ausschließlich die GHS-Gefahrstoffkennzeichnung zulässig. Bis zum 1. Juni 2015 dürfen noch die R-Sätze dieses Stoffes für die Einstufung von Zubereitungen herangezogen werden, anschließend ist die EU-Gefahrstoffkennzeichnung von rein historischem Interesse.
- ↑ Thieme Chemistry (Hrsg.): RÖMPP Online – Version 3.5. Georg Thieme Verlag KG, Stuttgart 2009.
- ↑ 5,0 5,1 The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals, 14. Auflage (Merck & Co., Inc.), Whitehouse Station, NJ, USA, 2006, ISBN 978-0-911910-00-1; S. 279.
- ↑ 6,0 6,1 Wolfgang Löscher et al.: Pharmakotherapie bei Haus und Nutztieren. Paul Parey, 7. Aufl. 2006, S. 503–504.
- ↑ Auterhoff-Knabe-Höltje: Lehrbuch der pharmazeutischen Chemie. Wissenschaftliche Verlagsgesellschaft Stuttgart 1999, ISBN 3-8047-1645-8.
- ↑ Anne-Sophie Fröhlich: Priesterliche Aufgaben im sunnitischen Islam. LIT Verlag, Berlin-Hamburg-Münster 1997, ISBN 3-8258-3045-4, S. 44.
- ↑ Jonathan Clayden, Nick Greeves, Stuart Warren, Peter Wothers: Organic Chemistry, Orford University Press, 2001, S. 862. ISBN 978-0-19-850346-0.
- ↑ Kuschinsky, G. und H. Lüllmann: Pharmakologie. Georg Thieme, Stuttgart - 3. Auflage 1967, S. 170–171.
- ↑ Linde, Otfried K.: Pharmakopsychiatrie im Wandel der Zeit. Erlebnisse und Ergebnisse. Tilia-Verlag Klingenmünster 1988; S. 112–113. Textauszug:„Der Enthusiasmus, der in einem extrem kurzen Zeitraum des vierten Dezenniums unseres Jahrhunderts fast gleichzeitig mehreren Erschütterungstherapien zum therapeutischen Durchbruch verholfen hat, löste bei vielen Menschen Reflexionen über die Zusammenhänge von Medizin, Kultur und Politik aus.“
- ↑ Römpp CD 2006, Georg Thieme Verlag 2006.
- ↑ Rodney Croteau, Frank Karp: Biosynthesis of monoterpenes: Hydrolysis of bornyl pyrophosphate, an essential step in camphor biosynthesis, and hydrolysis of geranyl pyrophosphate, the acyclic precursor of camphor, by enzymes from sage (Salvia officinalis). In: Archives of Biochemistry and Biophysics. 198, Nr. 2, 1979, S. 523–532.
Weblinks
- Riechstofflexikon
- Campher in P. J. Linstrom, W. G. Mallard (Hrsg.): NIST Chemistry WebBook, NIST Standard Reference Database Number 69. National Institute of Standards and Technology, Gaithersburg MD