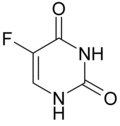
5-Fluoruracil
| Strukturformel | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||
| Allgemeines | |||||||||||||||
| Freiname | 5-Fluorouracil | ||||||||||||||
| Andere Namen |
| ||||||||||||||
| Summenformel | C4H3FN2O2 | ||||||||||||||
| CAS-Nummer | 51-21-8 | ||||||||||||||
| PubChem | 3385 | ||||||||||||||
| ATC-Code | |||||||||||||||
| DrugBank | APRD00516 | ||||||||||||||
| Arzneistoffangaben | |||||||||||||||
| Wirkstoffklasse | |||||||||||||||
| Verschreibungspflichtig: Ja | |||||||||||||||
| Eigenschaften | |||||||||||||||
| Molare Masse | 130,08 g·mol−1 | ||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||
| Schmelzpunkt | |||||||||||||||
| Löslichkeit |
löslich in Wasser (11,1 g·l−1 bei 22 °C)[1] | ||||||||||||||
| Sicherheitshinweise | |||||||||||||||
| |||||||||||||||
| LD50 | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||
5-Fluoruracil (5-FU), auch Fluorouracil (INN), ist ein Fluorpyrimidin, ein Analogon der Nukleinbase Uracil und ein Arzneistoff, welcher als Zytostatikum in der Chemotherapie, vor allem beim kolorektalen Karzinom und bei Brustkrebs verwendet wird. Es wurde von dem amerikanischen Chemiker Charles Heidelberger entwickelt und 1962 von der Pharmafirma Hoffmann-La Roche auf den Markt gebracht.
5-Fluoruracil findet auch Anwendung als Warzen-Therapeutikum (Verrumal®).
Pharmakologie
5-Fluoruracil ist ein Antimetabolit, der bei der Zellteilung aufgrund der Strukturähnlichkeit mit den Pyrimidinbasen Cytosin und Thymin (DNA-Nukleotide) beziehungsweise Uracil (RNA-Nukleotid) anstatt dieser in die DNA und RNA eingebaut wird. So wandelt das Enzym UMP-Pyrophosphorylase (EC 2.4.2.9) 5-Fluoruracil in 5-Fluor-UMP um, das dann weiter zu 5-Fluor-UTP phosphoryliert und in die RNA eingebaut wird. Dieses bewirkt die Synthese fehlerhafter RNA, die das Wachstum hemmt.
5-Fluor-dUMP hemmt darüber hinaus auch die Thymidylat-Synthase (EC 2.1.1.45), was letztendlich dazu führt, dass die DNA-Synthese und die Zellteilung inhibiert werden.[4]
Die Synthese von dTMP (1b) aus dUMP (1a) wird durch die Thymidylat-Synthase (A) katalysiert, dabei wird N5,N10-Methylentetrahydrofolat (2) zu 7,8-Dihydrofolat (3) umgesetzt. 5-Fluor-dUMP inhibiert das Enzym und damit diese Reaktion.
Es wirkt insbesondere in der Interphase des Zellzyklus. Neben einer Hemmung der DNA- und RNA-Synthese inhibiert es auch den sogenannten Exosomkomplex, der für die Zelle lebensnotwenig ist.
5-Fluoruracil wird in Form der Prodrugs Capecitabin oder 5-Fluorcytosin verabreicht und erst in der Zelle zum aktiven Metaboliten umgewandelt. Beispielsweise wird 5-Fluorcytosin durch eine Cytosin-Permease in die Zelle aufgenommen und dort sofort durch die Cytosin-Desaminase zu 5-Fluoruracil desaminiert.[5]
Nebenwirkungen
Die Nebenwirkungen (Übelkeit, Erbrechen, Schleimhautentzündungen, Knochenmarkschädigung) können beträchtlich sein (siehe Abschnitt Nebenwirkungen im Artikel Zytostatikum).
Als langfristige Nebenwirkungen wurden bei Tierexperimenten und Patientenuntersuchungen Gehirnschäden durch Schädigung von Gliazellen ausgemacht.[6]
Durch die zusätzliche Gabe von Tetrahydrofolsäure bzw. Folinsäure ist eine höhere Dosierung von 5-FU möglich, man nutzt diesen Effekt für Kombinationstherapien. Eine Wirkungsverstärkung bewirkt auch Interferon-α.
Der Abbau von 5-Fluoruracil geschieht über das Enzym Dihydropyrimidindehydrogenase.[7]
Siehe auch
Handelsnamen
Benda-5 FU (D), Efudix (D, CH), Haemato-fu (D), Neofluor (D), Onkofluor (D), Ribofluor (D), diverse Generika (D, A, CH)
Verrumal (D, A, CH)
Weblinks
- Arzneimittel-Kompendium der Schweiz: Fluorouracil-Präparate
Einzelnachweise
- ↑ 1,0 1,1 1,2 1,3 5-Fluoruracil bei ChemIDplus.
- ↑ 2,0 2,1 2,2 Datenblatt 5-Fluorouracil bei Sigma-Aldrich, abgerufen am 18. März 2011.
- ↑ Seit 1. Dezember 2012 ist für Stoffe ausschließlich die GHS-Gefahrstoffkennzeichnung zulässig. Bis zum 1. Juni 2015 dürfen noch die R-Sätze dieses Stoffes für die Einstufung von Zubereitungen herangezogen werden, anschließend ist die EU-Gefahrstoffkennzeichnung von rein historischem Interesse.
- ↑ Joachim Morschhäuser: Resistenzen und Resistenzmechanismen: Wie entkommen Pilze der Therapie? In: Pharmazie in unserer Zeit, 2003, 32 (2), S. 124–129; doi:10.1002/pauz.200390029.
- ↑ F. von Bruchhausen: Hagers Handbuch der Pharmazeutischen Praxis: Drogen A-K, S. 226, 5. Auflage, Springer Verlag, Berlin, 1998, ISBN 3-540-61618-7.
- ↑ Wie 5-Fluorouracil das Gehirn schädigt.
- ↑ S. Maurer, J. Thödtmann: Das Mammakarzinom: Diagnostik und Therapie. Govi-Verlag, Eschborn 2003, ISBN 978-3-7741-0996-4.
| Bitte den Hinweis zu Gesundheitsthemen beachten! |