Thallium(I)-chlorid
| Kristallstruktur | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
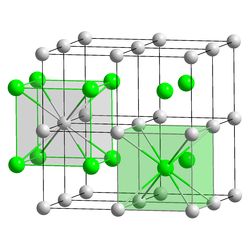
| ||||||||||||||||||||
| __ Tl+ __ Cl− | ||||||||||||||||||||
| Kristallsystem |
kubisch | |||||||||||||||||||
| Allgemeines | ||||||||||||||||||||
| Name | Thallium(I)-chlorid | |||||||||||||||||||
| Verhältnisformel | TlCl | |||||||||||||||||||
| CAS-Nummer | 7791-12-0 | |||||||||||||||||||
| PubChem | 24642 | |||||||||||||||||||
| Kurzbeschreibung |
weißer Feststoff[1] | |||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||
| Molare Masse | 239,84 g·mol−1 | |||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||
| Dichte |
7,0 g·cm−3[1] | |||||||||||||||||||
| Schmelzpunkt |
430 °C[1] | |||||||||||||||||||
| Siedepunkt |
806 °C[1] | |||||||||||||||||||
| Dampfdruck | ||||||||||||||||||||
| Löslichkeit |
Schwer löslich in Wasser (3,18 g·l−1 bei 20 °C)[1] | |||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||
| ||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||
Thallium(I)-chlorid ist eine chemische Verbindung aus der Gruppe der Thalliumverbindungen und Chloride.
Vorkommen
Thallium(I)-chlorid kommt natürlich als Mischform mit Thallium(I)-bromid in Form des sehr seltenen Minerals Lafossait vor.
Gewinnung und Darstellung
Thallium(I)-chlorid lässt sich durch Reaktion von Thallium(I)-sulfat oder Thallium(I)-nitrat mit Salzsäure gewinnen.[4]
Eigenschaften
Thallium(I)-chlorid ist ein weißer nicht brennbarer Feststoff, welcher schwer löslich in Wasser ist.[1] In verdünnter Salz- oder Salpetersäure ist es dagegen leicht löslich.[5] Er ist frisch hergestellt vollkommen farblos, wird am Licht aber violett. Er besitzt eine Kristallstruktur vom Cäsiumchlorid-Typ (a = 3,834 A).[4]
Verwendung
Thallium(I)-chlorid dient zur Herstellung Zweikernkomplexverbindungen (Tl-Cyclodiphosphazane), die interessante Metall-Metall-Wechselwirkungen besitzen.[6] Das Chlorid des Tl-201 kann für die Myokardszintigrafie eingesetzt werden.
Einzelnachweise
- ↑ 1,0 1,1 1,2 1,3 1,4 1,5 1,6 1,7 Eintrag zu CAS-Nr. 7791-12-0 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 12. Dezember 2010 (JavaScript erforderlich)
- ↑ 2,0 2,1 Nicht explizit in EU-Verordnung (EG) 1272/2008 (CLP) gelistet, fällt aber dort mit der angegebenen Kennzeichnung unter den Sammelbegriff „Thalliumverbindungen“; Eintrag aus der CLP-Verordnung zu Thalliumverbindungen in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. April 2012 (JavaScript erforderlich)
Referenzfehler: Ungültiges
<ref>-Tag. Der Name „CLP_520035“ wurde mehrere Male mit einem unterschiedlichen Inhalt definiert. - ↑ Seit 1. Dezember 2012 ist für Stoffe ausschließlich die GHS-Gefahrstoffkennzeichnung zulässig. Bis zum 1. Juni 2015 dürfen noch die R-Sätze dieses Stoffes für die Einstufung von Zubereitungen herangezogen werden, anschließend ist die EU-Gefahrstoffkennzeichnung von rein historischem Interesse.
- ↑ 4,0 4,1 Georg Brauer; Handbuch der präparativen anorganischen Chemie, Band 2, S.876; ISBN 3-432-87813-3
- ↑ William Crookes: Preliminary Researches on Thallium. In: Proceedings of the Royal Society of London. 12, 1862, S. 150–159.
- ↑ Datenblatt Thallium(I)-chlorid bei Sigma-Aldrich, abgerufen am 12. Dezember 2010.
Thallium(I)-Verbindungen: Thallium(I)-fluorid | Thallium(I)-chlorid | Thallium(I)-bromid | Thallium(I)-iodid
Thallium(I,III)-Verbindungen: Thallium(I,III)-chlorid | Thallium(I,III)-bromid
Thallium(III)-Verbindungen: Thallium(III)-fluorid | Thallium(III)-chlorid | Thallium(III)-bromid | Thallium(III)-iodid