Rydberg-Formel
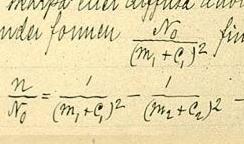
Die Rydberg-Formel (auch Rydberg-Ritz-Formel) wird in der Atomphysik benutzt, um das komplette Spektrum des vom Wasserstoff emittierten Lichtes zu bestimmen. Sie zeigt, dass die Energie des Elektrons im Wasserstoffatom proportional zur Hauptquantenzahl ist.
Die Formel wurde am 5. November 1888 vom schwedischen Physiker Johannes Rydberg vorgestellt; auch Walter Ritz arbeitete an ihr. Später wurde sie erweitert, um das Spektrum anderer Elemente zu bestimmen. Korrekturen aufgrund von Drehimpulsen oder relativistischen Effekten werden nicht berücksichtigt.
Rydberg-Formel für Wasserstoff
Dabei sind
- die Wellenlänge des Lichts im Vakuum
- die Rydberg-Konstante für das jeweilige Element: mit
- die Masse des Elektrons
- die Kernmasse (abhängig vom vorliegenden Isotop)
- die Rydberg-Konstante für Wasserstoff
- und ganzzahlige Werte der Hauptquantenzahl (mit ): ist die Quantenzahl des Orbits, von dem aus das Elektron in den tiefer gelegenen Orbit übergeht - also etwa vom dritten Orbit in den zweiten (siehe Bohrsches Atommodell).
Energie und Spektrallinien-Serien
Für die Energie des emittierten Photons und damit für die entsprechende Energiestufe im Atom gilt (siehe auch Rydberg-Energie):
mit
- Lichtgeschwindigkeit im Vakuum
- Planckscher Konstante .
Mit (Grundzustand) und erhält man eine Serie von Spektrallinien, die auch Lyman-Serie genannt wird. Der erste Übergang der Serie hat eine Wellenlänge von 121 nm, die Seriengrenze liegt bei 91 nm. Analog ergeben sich die anderen Serien:
| Name | Wellenlänge des ersten Übergangs (α-Linie) |
konvergiert gegen Seriengrenze | ||
|---|---|---|---|---|
| 1 | Lyman-Serie | 121 nm | 91,13 nm | |
| 2 | Balmer-Serie | 656 nm | 364,51 nm | |
| 3 | Paschen-Serie | 1.874 nm | 820,14 nm | |
| 4 | Brackett-Serie | 4.051 nm | 1458,03 nm | |
| 5 | Pfund-Serie | 7.456 nm | 2278,17 nm | |
| 6 | Humphrey-Serie | 12.365 nm | 3280,56 nm |
Rydberg-Formel für wasserstoffähnliche Atome
Für wasserstoffähnliche Ionen, d.h. Ionen, die nur ein Elektron besitzen, wie z. B. He+, Li2+, Be3+ oder K10+, lässt sich obige Formel erweitern zu:
mit der Kernladungszahl , d.h. der Anzahl der Protonen im Atomkern.
Eine Verallgemeinerung auf die Lichtemission von Atomen, die ein einzelnes Elektron in einer nicht abgeschlossenen Schale besitzen, führt zum Moseleyschen Gesetz.