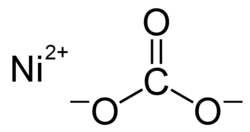
Nickel(II)-carbonat
| Strukturformel | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||
| Name | Nickel(II)-carbonat | |||||||||||||||||||
| Andere Namen |
Nickelcarbonat | |||||||||||||||||||
| Summenformel | NiCO3 | |||||||||||||||||||
| CAS-Nummer |
| |||||||||||||||||||
| PubChem | 18746 | |||||||||||||||||||
| Kurzbeschreibung |
hellgrüner geruchloser Feststoff[1] | |||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||
| Molare Masse | 118,70 g·mol−1 | |||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||
| Dichte |
2,6 g·cm−3[1] | |||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||
| Löslichkeit |
Praktisch unlöslich in Wasser (93 mg·l−1 bei 25 °C)[1] | |||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||
| ||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||
Nickel(II)-carbonat ist eine chemische Verbindung aus der Gruppe der Nickelverbindungen und Carbonate welche in mehreren Hydratformen vorkommt.
Vorkommen
Nickel(II)-carbonat kommt natürlich in als Mineral Hellyerit (Hexahydrat) sowie Zaratit, Nullaginit und Otwayit (Hydroxycarbonate) vor.
Gewinnung und Darstellung

Nickel(II)-carbonat-Hydrate können durch Elektrolyse von mit Kohlendioxid gesättigtem Wasser an Nickelelektroden gewonnen werden. Wasserfreies Nickel(II)-carbonat kann durch Reaktion einer Natriumhydrogencarbonat-Lösung mit einer mit Salzsäure angesäuerten Nickel(II)-chlorid-Lösung bei hohen Temperaturen und hohem Druck gewonnen werden. Es existiert auch eine gelbe Modifikation die bei anderen Druck-, Temperatur und Konzentrationsverhältnissen entsteht.[4] Nickel(II)-carbonat entsteht auch bei der Zersetzung von Nickelcarbonyl.[5]
Eigenschaften
Nickel(II)-carbonat und seine Hydrate sind hellgrüne geruchlose Feststoffe die sich bei Temperaturen größer als 120 °C in Kohlendioxid und Nickel(II)-oxid zersetzen. Wasserfreies Nickel(II)-carbonat ist unlöslich in Wasser und Säuren, dessen Hydrate sind jedoch leicht löslich in Säuren. Es kristallisiert rhomboedrisch mit der Raumgruppe R3c (a = 780,7 pm, a = 48°40').[4][5] Wasserfreies Nickelcarbonat ist nur schwer darstellbar. Die im Handel befindlichen Nickelcarbonate, sind basisch (Nickelhydroxycarbonat, NiCO3 · x Ni(OH)2 · x H2O, CAS: 12607-70-4, 12122-15-5 oder 12244-51-8) und schwer wasserlöslich.[1] Sie entstehen durch Fällung von Nickelsalzlösungen mit Natriumcarbonat.
Verwendung
Nickel(II)-carbonat wird als Katalysator bei der Fetthärtung und zur Herstellung von Nickel(II)-oxid, keramischen Farben (Pigment) und Glasuren sowie beim Galvanisieren verwendet.[1]
Sicherheitshinweise
Nickel(II)-carbonat ist wie viele Nickelverbindungen als krebserzeugend und reproduktionstoxisch eingestuft.[1]
Weblinks
Einzelnachweise
- ↑ 1,0 1,1 1,2 1,3 1,4 1,5 1,6 1,7 Eintrag zu CAS-Nr. 3333-67-3 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 19. Februar 2010 (JavaScript erforderlich)
- ↑ 2,0 2,1 Eintrag aus der CLP-Verordnung zu CAS-Nr. 3333-67-3 in der GESTIS-Stoffdatenbank des IFA (JavaScript erforderlich)
- ↑ Seit 1. Dezember 2012 ist für Stoffe ausschließlich die GHS-Gefahrstoffkennzeichnung zulässig. Bis zum 1. Juni 2015 dürfen noch die R-Sätze dieses Stoffes für die Einstufung von Zubereitungen herangezogen werden, anschließend ist die EU-Gefahrstoffkennzeichnung von rein historischem Interesse.
- ↑ 4,0 4,1 Georg Brauer; Handbuch der präparativen anorganischen Chemie
- ↑ 5,0 5,1 Nickel and its compounds (Inchem)